胶塞中残留水分 对艾司奥美拉唑钠冻干制剂质量的影响
何 艳 邹梅娟 卓秋琪 罗 舟
艾司奥美拉唑钠是奥美拉唑的S-旋光异构体,是阿斯利康公司研发的全球第一个旋光异构体质子泵抑制剂(proton pump inhibitor,PPI),其主要用于治疗胃食管反流病、幽门螺杆菌(Hp)阳性的消化性溃疡及与胃酸有关的消化系统紊乱性疾病。艾司奥美拉唑于2000年在瑞士首次上市,目前已在全球80 多个国家和地区上市[1-2]。
艾司奥美拉唑钠上市后迅速成为重磅炸弹产品,其化合物专利过期后成为国内药企的争相仿制对象,但仿制药开发中存在若干难点,艾司奥美拉唑钠的水分控制是主要难点之一。依据药物引湿性试验指导原则(中国药典2015年版四部通则9103)对艾司奥美拉唑钠原料药进行研究,发现原料引湿24 h 后,吸湿形成液体,说明本品引湿性极强[3]。因此,本产品除了冻干工艺控制的起始水分,长期贮存过程的水分控制也成为本产品的 质量控制重点。
冻干胶塞用于冻干粉针制剂的密封保存,起到隔绝微生物和水分的作用。冻干胶塞一般需要经过胶塞进行清洗、湿热灭菌、干燥等工艺处理,干燥后的胶塞会残留一部分水分。胶塞的残留水分可能在冻干粉针剂的长期保存过程中发生水分迁移,导致引湿性强的药物水分增加,胶塞的残留水分近年来已成为冻干制剂水分控制研究的热点之一[4-5]。因此,本实验对冻干胶塞干燥工艺及其残留水分进行研究,探讨胶塞中残留水分对艾司奥美拉唑钠冻干制剂质量的影响,并建立水分控制策略。
1 材料与仪器
1.1 材料
艾司奥美拉唑钠原料(深圳万乐药业有限公司,171001),枸橼酸(台山市新宁制药有限公司,161201),中硼硅管制西林瓶(肖特新康药品包装有限公司),覆膜溴化丁基胶塞(西氏医药服务有限公司),溴化丁基胶塞(Aptar Stelmi SAS),氯化丁基胶塞(江苏华兰药用新材料股份有限公司),铝塑组合盖(江门市新兴业包装材料有限公司),无水甲醇(广东广华科技股份有限公司),卡式液(天津市四友精细化学品有限公司)。
1.2 仪器
卡氏干燥炉-卡尔费休测定仪(瑞士万通,870+860 型),电子天平(梅特勒-托利多仪器有限公司,Mettle Teledo XP205),酸度计(梅特勒-托利多仪器有限公司,Mettle Teledo S220),脉动真空灭菌器(山东新华医疗器械有限公司,XG1.GWE-0.6B),真空冷冻干燥机(上海东富龙科技股份有限公司,LYO-5),药品稳定性试验箱(重庆市永生实验仪器厂,SHH-500SD-2)。
2 方法与结果
2.1 制备工艺
用70%处方量的注射用水溶解艾司奥美拉唑钠原料和枸橼酸,搅拌使完全溶解,然后用1.0 mol/L的NaOH 溶液调节药液pH 至11.0±1.0,最后补加注射用水至处方总量,搅拌均匀。药液经0.22 μm 过滤器除菌过滤,分装,半压塞,采用真空冷冻干燥机进行冻干除水。冻干结束后压胶塞,出箱,轧铝盖密封。
2.2 胶塞残留水分测定
国内尚未有关于冻干粉针胶塞水分测定标准,根据ISO_ 8362-5:1995 附录D 胶塞残留水分测定方法[6]及近年的胶塞残留水分测定方法研究[7-10],本研究采用操作简便且准确度高的卡氏干燥炉-卡尔费休法测定法进行胶塞残留水分的测定。
2.2.1 仪器参数瑞士万通870 水分仪器电极电流为400 mA,终点电位50.0 mV,终点相对停止漂移值为5 μg/min,开始漂移值为20 μg/min。860 卡式加热炉温度为250 ℃,载气为氮气,流速150 ml/min。
2.2.2 测定方法取至少10 只胶塞,每个胶塞沿顶面的垂直方向切取冠部部分一块,切块的长度约为7 mm;称重,将样品放入卡式炉的样品瓶中并密封,设定卡式炉将样品蒸发出来的水分导引至卡尔费休滴定池内,测定其水分。当卡尔费休滴定速度小于0.1 μg/s 时,即判定滴定结束。重复测定3 次,取其平均值。
2.3 检测项目
2.3.1 胶塞干燥工艺及残留水分取3 种不同配方的胶塞,按照艾司奥美拉唑钠冻干粉针工艺规程,进行胶塞清洗,清洗后的胶塞采用脉动真空灭菌器121 ℃湿热灭菌30 min,然后121 ℃分别干燥1 h、3 h、5 h、6 h。分别取湿热灭菌前、湿热灭菌后、干燥1 h、3 h、5 h、6 h 各30 个胶塞,按照2.2.1 项下进行胶塞残留水分的测定,结果见表1。
不同配方胶塞在湿热灭菌前水分含量均较低,在121 ℃湿热灭菌30 min 后,胶塞残留水分含量明显增加;干燥后残留水分含量随干燥时间延长而下降,但干燥3 h 后胶塞的残留水分趋于稳定,水分含量下降至未进行湿热灭菌前。此外,不同厂家生产的胶塞的水分含量略有差异,覆膜溴化丁基胶塞的水分较低,氯化丁基胶塞的水分含量略高。
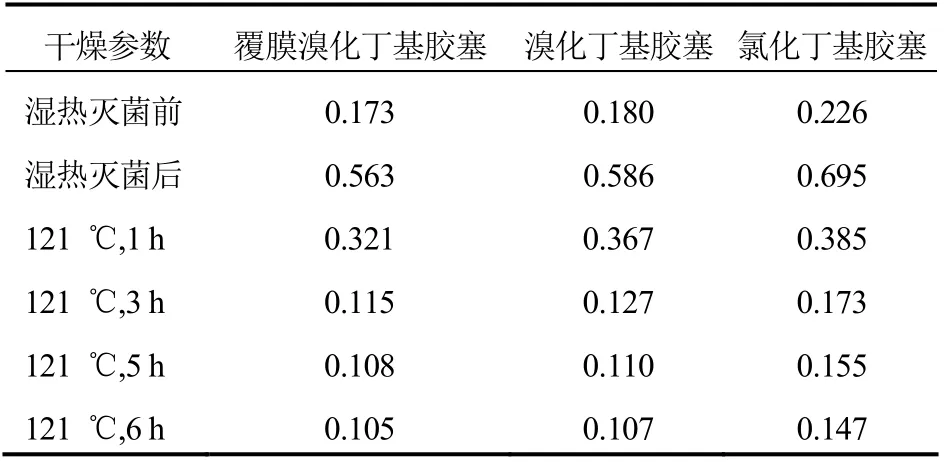
表1 不同配方胶塞经灭菌干燥后水分含量(%)
2.3.2 不同干燥方式的胶塞对产品水分的影响按照2.1 项下艾司奥美拉唑钠的制备工艺制备样品,分别取上述不同干燥处理的胶塞各10 个对分装后的药液半压塞、冻干,冻干后全压塞、轧铝盖。测定冻干产品的起始水分含量,然后将冻干产品置于高温60 ℃恒温恒湿箱留样30 d,测定冻干产品的水分含量,并计算水分增加值。见表2。
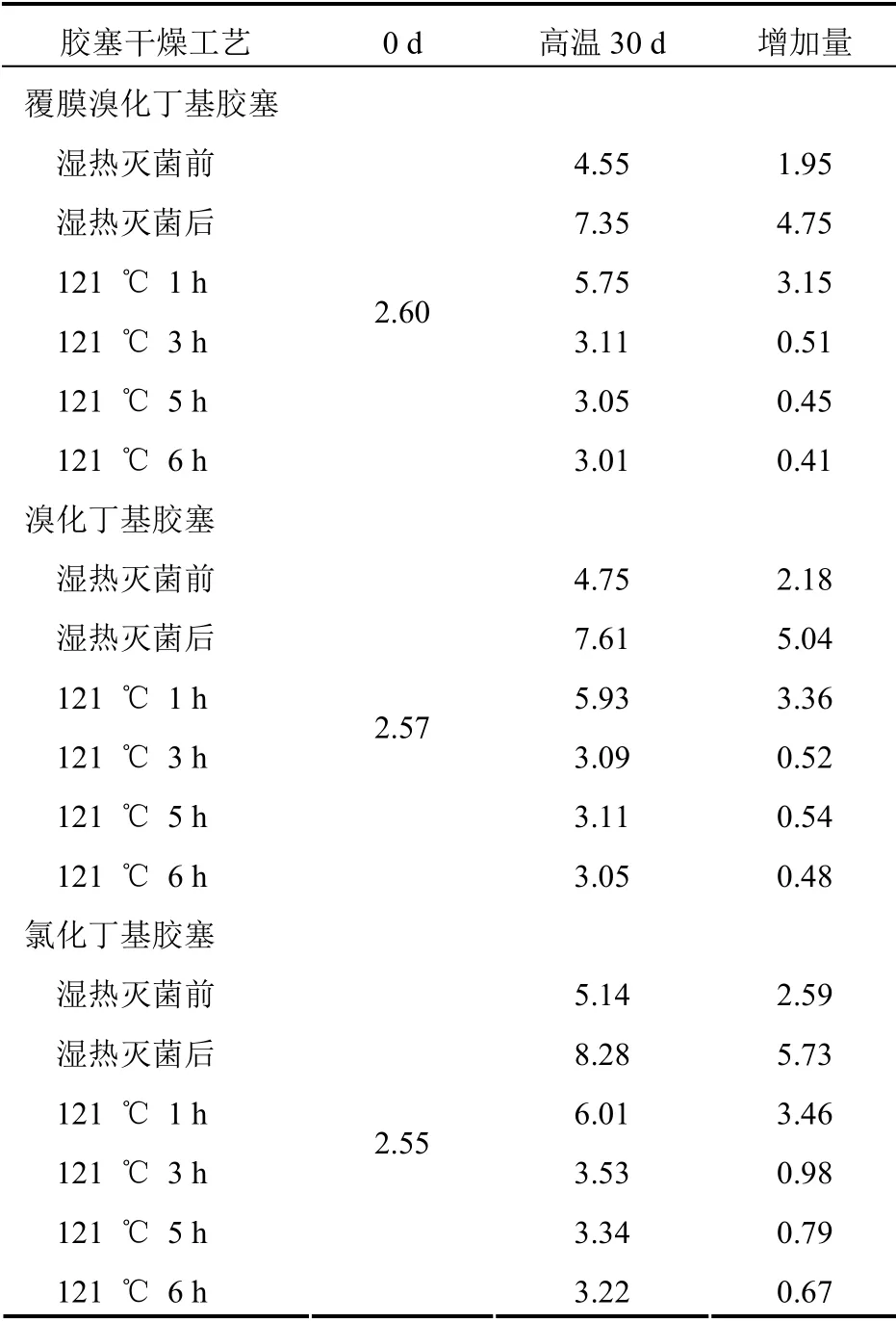
表2 艾司奥美拉唑钠冻干粉针高温留样水分含量(%)
对使用不同配方胶塞的冻干产品的高温影响因素水分变化及胶塞残留水分进行统计学分析,方差分析结果见表3,线性拟合图见图1。统计学分析结果显示,方差分析回归曲线P值几乎为0,回归曲线相关系数=0.967,说明回归曲线效果显著,胶塞残留水分含量与产品水分含量有显著相关性。
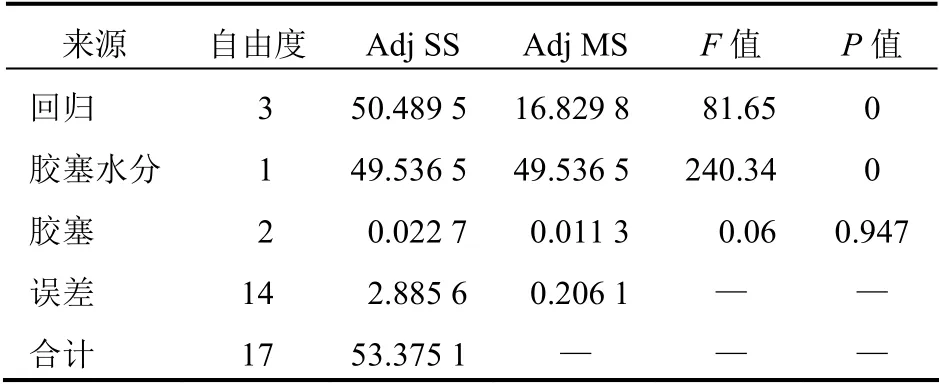
表3 冻干产品水分变化与胶塞残留水分相关性的 方差分析
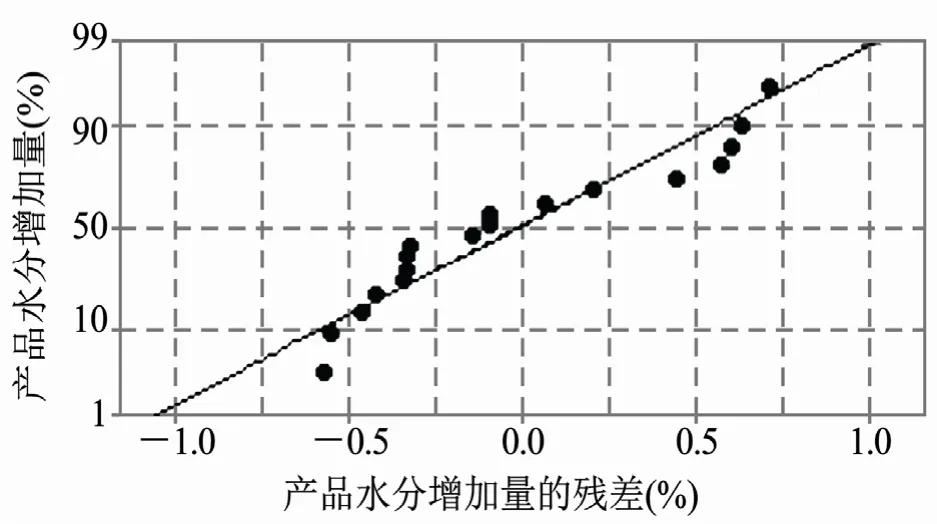
图1 冻干产品水分变化与胶塞水分相关性曲线
3 讨论
冻干粉针制剂的水分含量控制是重要的质量控制要求,冻干粉针制剂在贮存过程中水分增加主要有两种途径,一是胶塞残留水分的迁移,二是外界水分通过胶塞渗透至西林瓶内。后者受不同胶塞配方的通透性及产品贮存条件影响。本研究主要针对前者开展。
胶塞作为冻干制剂的主要内包材料,在产业化生产时,一般均应按照《药品生产质量管理规范》管理要求,对胶塞进行清洗、湿热灭菌、干燥等工艺处理。上述处理工序均会对胶塞残留水分含量产生较大影响,从而影响产品水分含量及产品质量[7-8]。
卡氏干燥炉-卡尔费休法测定法测定胶塞残留水分的准确性更高[8-10],与《国家药包材标准》注射用无菌粉末用卤化丁基橡胶塞(YBB00052005-2015)[11]和《中华人民共和国国家药典》2015年版[12]规定的干燥失重法比较灵敏度更高。因此,本研究采用卡氏干燥炉-卡尔费休法测定3 种不同胶塞湿热灭菌前、湿热灭菌后以及121 ℃干燥1 h、3 h、5 h、6 h后的胶塞水分含量。结果表明,胶塞湿热灭菌前的起始水分含量较低,经湿热灭菌后热蒸汽进入胶塞内,使得胶塞水分含量增加1~2 倍;胶塞在121 ℃干燥后水分含量随干燥时间延长逐渐下降,干燥3 h以上才恢复到湿热灭菌前的胶塞起始水分含量,干燥5 h 和6 h 后的胶塞残留水分含量已无明显下降趋势,说明胶塞在湿热灭菌后至少需要干燥3 h 以上才可能将胶塞残留水分含量控制至原有水平。本研究表明冻干粉针制剂水分含量与与胶塞湿热灭菌干燥后的残留水分成显著相关性[13]。此外,对不同配方的胶塞研究结果表明,采用121 ℃干燥3 h 以上的覆膜溴化丁基胶塞和溴化丁基胶塞的冻干产品水分差异不大,采用氯化丁基胶塞的冻干产品水分略高。说明除胶塞中残留水的迁移,不同配方的胶塞通透性不同也会对产品的水分产生影响。本研究结果表明,由于艾司奥美拉唑钠极具引湿性,胶塞残留水在稳定性留样过程中迁移到冻干粉中,导致产品水分迅速增加,从而影响产品质量。
综上所述,通过优化胶塞的干燥时间可降低胶塞残留水分,减少残留水分对艾司奥美拉唑钠质量的影响,从而保证产品质量。同时,由于胶塞配方的不同,建议针对不同产品进行胶塞残留水分研究,选择出合适的胶塞供应商,以提高产品质量。此外,值得注意的是,在进行胶塞残留水分控制工艺优化研究时,应进一步探讨胶塞经长时间干燥后的物理性能变化及其挥发性成分的变化是否对冻干产品质量产生不良影响。

