圆齿野鸦椿果实总黄酮对LPS诱导的RAW264.7细胞炎症反应的抑制作用
陈路遥, 邹小兴, 丁 卉, 苏超茹, 梁婷婷, 黄维2,
(1.福建农林大学林学院;2.自然生物资源保育利用福建省高校工程研究中心; 3.福建农林大学生命科学学院,福建 福州 350002)
炎症是机体对感染或组织损伤所产生的一种防御反应[1].炎症反应过程包含机体和机体细胞的参与,伴随一些化学物质的释放,这些化学物质称为炎症因子或炎症介质.脂多糖(lipopolysaccharides, LPS)在革兰氏阴性菌细胞壁中产生,是细菌内毒素的主要成分.LPS分子被嵌入外膜,分子的脂质部分在细菌细胞壁中起到锚定脂多糖的作用.当细菌进行繁殖或死亡时才被释放出来,其致炎性极强[2,3].
圆齿野鸦椿(EuscaphiskonishiiHayata),又名福建野鸦椿[4],为省沽油科野鸦椿属常绿小乔木[5],具有抗炎镇痛,清热解毒,消肿散结等功效[6,7],是福建省民间传统药材.具有很强的抗炎镇痛、清热解毒、消肿散结等功效,在民间有良好的药用基础及悠久的药用历史.本研究通过提取圆齿野鸦椿果皮的总黄酮(TFEP),并对TFEP进行抗炎效果和作用机制研究,以期为圆齿野鸦椿资源的开发提供依据.
1 材料与方法
1.1 材料
1.1.1 药品与试剂 DMEM高糖培养基,胎牛血清(FBS)和0.01 mol·mL-1PBS溶液购自Hyclone公司,四甲基偶氮唑盐(MTT)、内毒素脂多糖(LPS)购于北京索莱宝生物,PGE2、IL-6和TNF-α ELISA试剂盒购自上海酶联生物公司,地塞米松购自上海生工生物,蛋白含量检测试剂盒购于凯基生物, NO检测试剂盒均购于江苏碧云天公司,二抗山羊抗兔IgG-HRP、二抗山羊抗鼠IgG-HRP,ECL化学发光显色液,RNA提取试剂盒、反转录试剂盒和荧光定量PCR试剂盒均购于北京全式金公司,二甲基亚砜(DMSO)及其余试剂均为分析纯.一抗STAT3(signal transducers and activators of transcription3)、P-STAT3(磷酸化信号传导子及转录激活子3)、NF-κβ(nuclear factor-kappa β)、P-NF-κβ(磷酸化的核因子κβ)和β-actin(β-non-muscle)、GAPDH(glyceraldehyde-3-phosphate dehydrogenase)均购于Santa Cruz公司.PCR引物序列如下.

表1 引物列表Table 1 List of primers used in PCR amplification
1.1.2 仪器 CO2细胞培养箱(上海龙跃WJ-3D)、倒置生物显微镜(重庆奥特光学仪器BDS 300PH)、立式高压灭菌锅(LDZX-75KBS上海申安)、微孔板检测系统(酶标仪Bio-Rad16166)、荧光定量PCR仪(Thermo Scientific PIKOREAL 96)、荧光化学发光成像系统(SYNGENEG, BOX×74).
1.1.3 细胞培养 DMEM 高糖培养基(10% 胎牛血清、1%双青链双抗)培养小鼠巨噬细胞系RAW264.7细胞(中国科学院上海细胞库),并放置于37 ℃、5% CO2培养箱中,取对数生长期细胞用于试验.
1.2 方法
1.2.1 药品提取 称取圆齿野鸦椿果皮粗粉1.5 kg,用60%的乙醇(液料比1∶20),加热70 ℃回流提取3 h 2次,过滤、减压并回收乙醇.将圆齿野鸦椿的乙醇提取物上样到聚酰胺柱后,用蒸馏水洗脱除去色素、水溶性蛋白、糖类等杂质,再用50%的乙醇溶液洗脱,薄层色谱板进行检测至出现黄酮时,逐步增加乙醇含量洗脱至无黄酮出现为止,收集洗脱液、减压浓缩、干燥后得到果皮总黄酮.
1.2.2 MTT法细胞增殖毒性试验 在96孔培养板上以5×104个·mL-1接种细胞,每孔180 μL,试验组分别加入不同浓度的TFEP(50、100、200 μg·mL-1)或溶剂DMSO,每组设8个平行孔,37 ℃培养24 h,每孔加入5 g·L-1的MTT溶液20 μL,继续培养4 h后,弃去上清,加入150 μL DMSO溶解,在570 nm波长下测吸光度值,根据吸光度计算细胞生长抑制率.细胞生长抑制率/%=(D对照-D试验)/(D对照-D空白)×100%.
1.2.3 NO含量检测 RAW264.7细胞接种于96孔板内,细胞密度为 2×105个·mL-1, 每孔180 μL,置细胞培养箱中培养过夜.设对照组(无LPS)和模型组(1 μg·mL-1LPS),每个处理设5个复孔,试验组按50、100、200 μg·mL-1的药物浓度给药,给药2 h后,模型组和试验组每孔加20 μL相应浓度的LPS,对照组每孔加20 μL的含血清培养基,22 h后,利用NO试剂盒检测上清NO分泌情况.
1.2.4 ELISA测定PGE2、IL-6及TNF-α蛋白表达 设正常组、模型组、试验组(LPS+50、LPS+100、LPS+200 μg·mL-1剂量组)和地塞米松阳性对照组(200 μg·mL-1),将RAW264.7细胞按2×106个·mL-1接种于25 cm2的培养瓶(5 mL)中,37 ℃、5% CO2条件下培养;24 h后去掉旧培养基,用PBS清洗2~3遍并吸净,用无血清培养基将药物母液稀释到所需浓度,每瓶加5 mL;给药后2 h,模型组、试验组和阳性对照组加入终浓度为1 μg·mL-1的LPS(500 μL),正常组加入等体积无血清培养基,继续培养20 h,取上清直接进行ELISA检测.
1.2.5 RT-PCR检测mRNA水平 RAW264.7细胞悬液接种于6孔板内,细胞密度为 5×105个·mL-1,每孔3 mL,置细胞培养箱中培养过夜,细胞贴壁后加入TFEP(50、100、200 μg·mL-1) ,2 h后,试验组和模型组加入1 μg·mL-1LPS各20 μL,设为正常组、LPS组、LPS+TFEP组,继续置于细胞培养箱中培养24 h后,按Trizol试剂盒提取总RNA,反转录为cDNA,然后扩增为DNA.扩增条件为:42 ℃孵育15 min;85 ℃加热5 s失活.溶解曲线扩增条件:95 ℃ 5 s,65 ℃ 1 min,97 ℃ 0 s,0.11 ℃·s-1,1 cycle.荧光定量PCR仪检测mRNA表达情况.
1.2.6 Western blot检测蛋白表达 RAW264.7细胞接种于6孔板,细胞密度为5×105个·mL-1,每 孔5 mL,置细胞培养箱中培养过夜,细胞贴壁后同时加入TFEP(50、100和200 μg·mL-1),2 h后试验组和模型组加入1 μg·mL-1LPS,设为正常组、LPS组、LPS+TFEP组,继续置于细胞培养箱中培养22 h后,提取细胞总蛋白,采用BCA蛋白定量法检测各组细胞蛋白浓度,煮沸灭活蛋白10 min,SDS-PAGE凝胶电泳,湿法转至PVDF膜,37 ℃下用封闭液封闭2 h后,加入一抗4 ℃孵育过夜,洗脱一抗,与二抗37 ℃下孵育1 h,ECL显色,放入成像仪曝光,保存图片.
1.2.7 统计学处理 试验数据以x±SD表示,应用SPSS 12.0软件进行统计学分析.组间比较采用单因素方差分析,P<0.05认为差异具有统计学意义.
2 结果与分析
2.1 TFEP成分
在Waters W 2690/5-W 2998系统上,采用Dikma Dionsil C18色谱柱(4.6 mm×150 mm,5 μm),30 ℃,使用Waters 2998 PDA检测器和ACQUITY QDA质谱检测器,确定了圆齿野鸦椿主要黄酮类化合物为芦丁、异鼠李素、山奈酚、槲皮素、夏佛托苷等.
2.2 TFEP对细胞NO分泌的影响
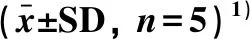
表2 圆齿野鸦椿果皮提取物对NO的影响Table 2 Effect of TFEP on NO production
1)与空白组比较,##P<0.01;与LPS模型组比较,*P<0.05,**P<0.01.
采用NO检测试剂盒分析TFEP对LPS诱导后RAW264.7细胞产生NO的影响.结果如表2所示,与空白组相比,模型组给予1 μg·mL-1LPS刺激22 h后,NO分泌显著增加(P<0.01) .采用50、100和200 μg·mL-1TFEP作用于LPS诱导的RAW264.7细胞,药物组中NO的分泌则受到明显抑制,并呈现剂量依赖性关系(P<0.05或P<0.01),TFEP对LPS诱导的RAW264.7产生NO的半数抑制浓度IC50为78.47 μg·mL-1.同时,采用MTT分析50、100和200 μg·mL-1TFEP的细胞毒作用,结果表明,RAW264.7细胞存活率均在90%以上,说明TFEP的抗炎活性与细胞毒性无关.
2.3 TFEP对PGE2、IL-6及TNF-α蛋白表达的影响
与空白对照组比较(表3),RAW264.7细胞在受到LPS刺激后,细胞上清液中TNF-α、PGE2和IL-6释放量显著增加(P<0.01).与LPS模型组相比,TFEP各剂量组对LPS诱导的RAW264.7细胞TNF-α、PGE2和IL-6释放量均有显著抑制作用(P<0.01),且呈剂量依赖关系.与LPS模型组比较,地塞米松阳性对照组对TNF-α、PGE2和IL-6释放量具有显著抑制作用(P<0.01);与TFEP各剂量组比较,当药物浓度均为200 μg·mL-1时,地塞米松阳性对照组对IL-6释放量的抑制作用低于TFEP剂量组,但两者差异不显著(P>0.05).
2.4 TFEP对IL-6、iNOS及TNF-α mRNA表达的影响
RAW264.7小鼠巨噬细胞经1 μg·mL-1LPS刺激后,与正常对照组比较,如图1所示,在未受到刺激的状态下,IL-6、iNOS和TNF-α的mRNA少量表达,LPS处理后,IL-6、iNOS和TNF-α的mRNA表达量明显增加(P<0.01).试验组随着TFEP给药剂量的增加,iIL-6、iNOS和TNF-α mRNA的表达量呈降低趋势,200 μg·mL-1剂量下达到最小值,且此时与阳性对照药地塞米松的差异无统计学意义(P>0.05),表明TFEP药物在200 μg·mL-1剂量时抑制IL-6、iNOS和TNF-α mRNA表达的作用效果与地塞米松相当(P>0.05).
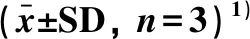
表3 TFEP对LPS诱导的RAW264.7细胞释放TNF-α、PGE2和IL-6的影响Table 3 Effect of TFEP on the contents of TNF-α, PGE2和IL-6 in LPS-induced RAW264.7 cells
1)与空白组比较,#P<0.01;与LPS模型组比较,*P<0.05,**P<0.01.
2.5 TFEP对NF-κβ/Stat3信号通路蛋白表达量的影响
NF-κβ(nuclear factor-kappa β)信号通路能通过转录激活多种炎症相关基因,JAK1(janus kinase 1)/Stat3(signal transducers and activators of transcription 3)信号通路活化能引起炎症反应,又能刺激NF-κβ的过度活化.如图2Western blot结果显示,NF-κβ和Stat3蛋白在各组RAW264.7细胞中条带粗细变化并不明显,P-NF-κβ和P-Stat3蛋白被LPS刺激后,模型组蛋白条带相对变粗,颜色加深.经TFEP各剂量给药处理后,与模型组相比较, P-NF-κβ和P-Stat3蛋白条带随给药浓度提高而逐渐变细,颜色逐渐变浅.
如图3所示,NF-κβ和Stat3蛋白在各组RAW264.7细胞中表达量未见明显变化,在被LPS刺激后,模型组细胞中P-NF-κβ和P-Stat3蛋白表达增加(P<0.01).经TFEP各剂量给药处理后,与模型组相比较, P-NF-κβ和P-Stat3表达量均显著降低,且呈明显的量效关系(P<0.05或P<0.01).
3 讨论
近年来的研究结果表明,圆齿野鸦椿具有很好的抗炎作用和效果.炎症是机体对外来病菌、有害刺激或物理损害等引起的一种组织学适应性反应,是许多疾病共有的基本病理过程[8].过度的炎症反应的防御机制会有所失调,甚至会演变成慢性或持久性疾病[9].在炎症发生过程中,巨噬细胞扮演着极为重要的角色,巨噬细胞能够被LPS刺激所激活.LPS经细菌释放,通过TLR4受体介导[10],使得炎症信号通路被激活,从而诱导大量炎症因子的合成与释放,如NO、PGE2等炎症介质以及TNF-α、IL-6等促炎细胞因子,随后机体会出现一连串的炎症反应.因此,LPS作为诱导剂激活巨噬细胞产生炎症反应常常用来评价药物的抗炎活性情况.
本研究通过圆齿野鸦椿果皮提取物对脂多糖诱导的小鼠巨噬细胞RAW264.7相关炎症细胞因子以及对炎症相关通路的影响,进一步研究圆齿野鸦椿的抗炎效果及作用机制.细胞因子被认为是炎性应答中重要的引发因子,炎症相关疾病的特征是炎症因子的过量表达[11].TNF-α和IL-6均为常见的促炎细胞因子,一般情况下表达量较低,当炎症发生时,它们的表达水平会显著升高.TNF-α是一种主要由单核—巨噬细胞分泌的前炎症细胞因子,过量的TNF-α会加重炎症损伤和诱导其他细胞因子的生成[12],它能刺激单核—巨噬细胞合成IL-1β、IL-6等细胞因子及TNF-α本身,能参与和调控多条炎症相关通路的开放与运行[13,14].IL-6是一种多功能细胞因子,当IL-6的表达水平处于正常标准时能促进B细胞分化并产生免疫球蛋白、促进细胞毒性T细胞成熟[15],一旦分泌过量则会导致一系列的炎性损伤.因此,减少TNF-α和IL-6的过度产生可很好的控制炎症反应,缓解机体因炎症反应而引起的组织损伤,具广阔的临床应用前景.
LPS是革兰氏阴性菌细胞壁的组成成分之一,具有极强的致炎性.LPS触发炎症反应中包含一系列复杂的级联反应,NF-κβ信号途径在其中起中心作用.静息状态下NF-κβ与其天然抑制蛋白IκBs(inhibitor of NF-κβ)结合,但在促炎因素的刺激下,IκBs发生磷酸化而失活,释放出游离的NF-κβ,随之NF-κβ被磷酸化激活,并核转位进入细胞核启动下游靶基因(如COX-2、iNOS、TNF-α等促炎介质)的转录与表达[16].酪氨酸激酶JAK(janus kinase)/信号转导活化因子Stats(signal transducers and activators of transcription)是重要的细胞因子信号转导通路,在炎症、肿瘤等多种疾病中有重要的调节作用[17].在正常生理条件下,Stat3的激活受到严格的调控,在炎症等条件刺激下,Stat3可被磷酸化而进入细胞核内,促进炎性细胞因子(如NO和IL-6等)的表达[18].因此,目前NF-κβ/Stat3信号途径在研究炎症相关基因表达的调控中具有重要的指导意义.
基于上述理论,通过检测TFEP对LPS刺激后,RAW264.7小鼠巨噬细胞的NO分泌、炎症相关蛋白和基因表达的变化,发现TFEP可剂量依赖性地抑制LPS诱导产生NO的分泌(表2),下调TNF-α、PGE2和IL-6蛋白的表达(表3),降低 TNF-α、iNOS和IL-6 mRNA水平(图1),ELISA与qRT-PCR两者结果相一致.TFEP是通过在转录水平调节TNF-α和IL-6 mRNA,影响TNF-α和IL-6的分泌以达到抗炎作用.同时发现,NF-κβ/Stat3信号通路中,P-NF-κβ和P-Stat3在受到LPS刺激后,其表达量显著上调,而TFEP给药后,其表达量随给药剂量的增加而显著下调,说明TFEP可抑制NF-κβ/Stat3的激活,从而抑制LPS诱导的炎症反应.这为TFEP抗炎作用的机制提供了体外试验证据,为下一步的体内抗炎动物模型验证提供了依据.

