光学无创血糖浓度检测方法的研究进展
郭 帅,苏 杭,黄星灿,刘 剑
(山东大学 控制科学与工程学院 生物医学工程系,山东 济南 250061)
1 引 言
国际糖尿病联盟发布的数据显示,截至2017年,全球糖尿病患者(20~79岁之间)数为4.25亿,预计到2045年将增至6.29亿;我国糖尿病患者(20~79岁之间)数达1.144亿,预计到2045年这一数字将增至1.198亿[1]。糖尿病及其引发的眼疾、神经损害和心血管疾病等并发症会给患者带来极大的痛苦,甚至危及患者生命[2]。目前糖尿病还没有根治方法[3],但研究表明连续监测并控制患者血糖水平,可以减少或延缓并发症的发生,提高患者的生存质量。
目前临床应用的血糖测量方式是有创伤性的,一般需经过采血、化学分析测定等步骤,得到血糖浓度[4]。有创测量需要生化试剂,检测成本高,易引起感染,同时,频繁采血也会给患者带来不便和痛苦。因此非侵入、无创伤性血糖检测是一种理想的测量方式[5],其中光学方法因检测便捷、蕴含信息丰富、能真正实现无创无痛等特点,成为国内外研究热点。许多研究小组进行了大量研究与实验,明确了不同光学检测方法的优势与不足。虽然利用光学方法检测血糖浓度已经过几十年的研究与发展,但由于组织背景和血液中其它物质的干扰、个体差异等问题还没有完全解决,目前光学无创血糖检测仍存在较大的测量误差,所以至今尚无一款无创血糖仪能够真正满足临床应用要求,获得认证批准[6]。
光学血糖浓度检测通常是将一束光聚焦在人体上,利用传输光的强度、相位、偏振角、频率以及靶区组织散射系数等信息都与血糖浓度密切相关的特点,通过分析这些信息的改变,即可间接测得血糖浓度。近年来,世界各国研究人员付出极大努力,尝试通过光学方法得到尽可能准确的血糖浓度值。目前常见的检测方法有偏振光旋光法[7-8]、光学相干断层成像法[9-12]、近红外光谱法[13-14]、中红外光谱法[15-17]、拉曼光谱法[18-19]、荧光光谱法[20-21]、光声光谱法[22-23]、基于超声调制的光信号技术[24-26]等。
2 血糖浓度检测的光学方法与研究现状
2.1 偏振光旋光法
由于葡萄糖具有稳定的旋光特性,故当一束线偏振光照射葡萄糖溶液时,透射光仍为线偏振光且偏振方向与原入射方向成一定角度,角度大小与葡萄糖浓度相关。偏转角由以下公式给出:
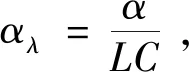
(1)
式中,αλ为特征偏转角,α为光学活性物质引起的偏转角,L为光程长,C为待测物浓度[8]。眼前房由于光程合适(约1 cm)、散射系数和去极化系数小,成为偏振法的最佳测量部位[7]。
1979年,March等人[27]首次通过测量眼前房水旋光度估计葡萄糖水平,发现偏转角随房水葡萄糖浓度的增加而变大,且不同波长光的偏转角度对葡萄糖浓度敏感性不同。1998年,Chou等人[28]首次报道了偏振法的在体检测结果,他们利用基于光学外差法的旋光仪,成功检测到兔眼前房水中低于10 mg/dL的葡萄糖水平。随后,Cameron等人[29]通过直接测量,发现新西兰兔血糖水平与其房水中葡萄糖浓度的平均延迟时间约为5 min,证明了通过眼前房水间接测量血糖浓度的可行性。
目前,由人眼运动引起的实时变化的角膜双折射仍是偏振法测血糖的主要限制因素。为此研究人员对旋光法进行了深入研究,通过在兔活体中进行实验[30],证实使用双波长偏振光进行测量可有效降低角膜双折射引起的噪声,提高测量精度。基于此结论,Wan[31]利用双波长偏振光测量前房水中葡萄糖浓度,在兔眼中存在由运动引起的角膜双折射情况下,测量误差小于25 mg/dL,较为理想地减少了运动伪影引起的双折射的影响。王洪[32]提出利用正交双偏振光测量血糖浓度的方法,提取出极其微弱的血糖旋光信号,并进行葡萄糖溶液、血清溶液测量实验,二者糖浓度预测标准差(Standard Deviation,SD)的平均值分别为12.47、20.63 mg/dL,进一步提高了测量精度。此外,Malik等人[33]设计的实时闭环双波长偏振测量系统、Grunden等人[34]设计的高速双波长偏振仪以及余振芳等人[35]提出的结合激光强度调制与法拉第偏振矢量调制的双调制法在克服运动伪影引起的双折射上效果明显。另一方面,Phan等人[36]成功开发了由偏振扫描发生器(Polarization Scanning Generator,PSG)和高精度斯托克斯偏振仪组成的斯托克斯-米勒矩阵偏振测量系统。该系统具有极高的旋光度测量分辨率(分辨率为10-6(°)/mm),有助于提高偏振法测量精度。
偏振法对活体兔血糖浓度预测的平均绝对相对差(Mean Absolute Relative Difference,MARD)已低至11.66 mg/dL[30],可见其是一种极具潜力的无创血糖检测方法。未来应从优化测量系统、改进测量原理以及引进校正算法等方面减少甚至消除人眼运动引起的双折射对测量精度的影响。此外,偏振法一般选择眼前房作为测量部位,故还需考虑眼前房水中糖浓度与血糖浓度的延迟时间以及人眼检测的安全性问题。延迟时间的存在会导致测得的血糖浓度并非真正意义上的实时数据,这对于需要严格控制血糖浓度的糖尿病患者或重症监护组(Intensive Care Unit,ICU)患者是极其不利的。
2.2 光学相干断层成像法
光学相干断层成像(Optical Coherence Tomography,OCT)技术是低相干干涉技术、共焦显微镜原理和超外差探测技术相结合的产物,具有非侵入、灵敏度和成像分辨率高(微米量级)的特点,可以获取高分辨率的人体组织结构图像[37-38]。OCT技术最早由Huang等人[39]于1991年提出,随后,该技术被应用于医学成像与诊断中[40]。
OCT 测量系统主要由迈克尔逊干涉仪组成,目前常用的是光纤式迈克尔逊干涉仪,其结构如图1所示。光从宽带光源出射后,由耦合器分为两路:一路进入参考臂由反射镜返回,另一路进入样品臂入射到样品组织上,经后向散射返回。当样品臂与参考臂长度一致时,两束光到达耦合器后发生干涉。调整反射镜在参考臂上的位置,能够实现对样品不同深度的探测。改变参考臂的长度,沿样品深度方向进行一次完整的扫描即为一个A-scan。干涉信号经光电探测器转换后传入计算机进行处理,便可得到组织内部图像[37]。
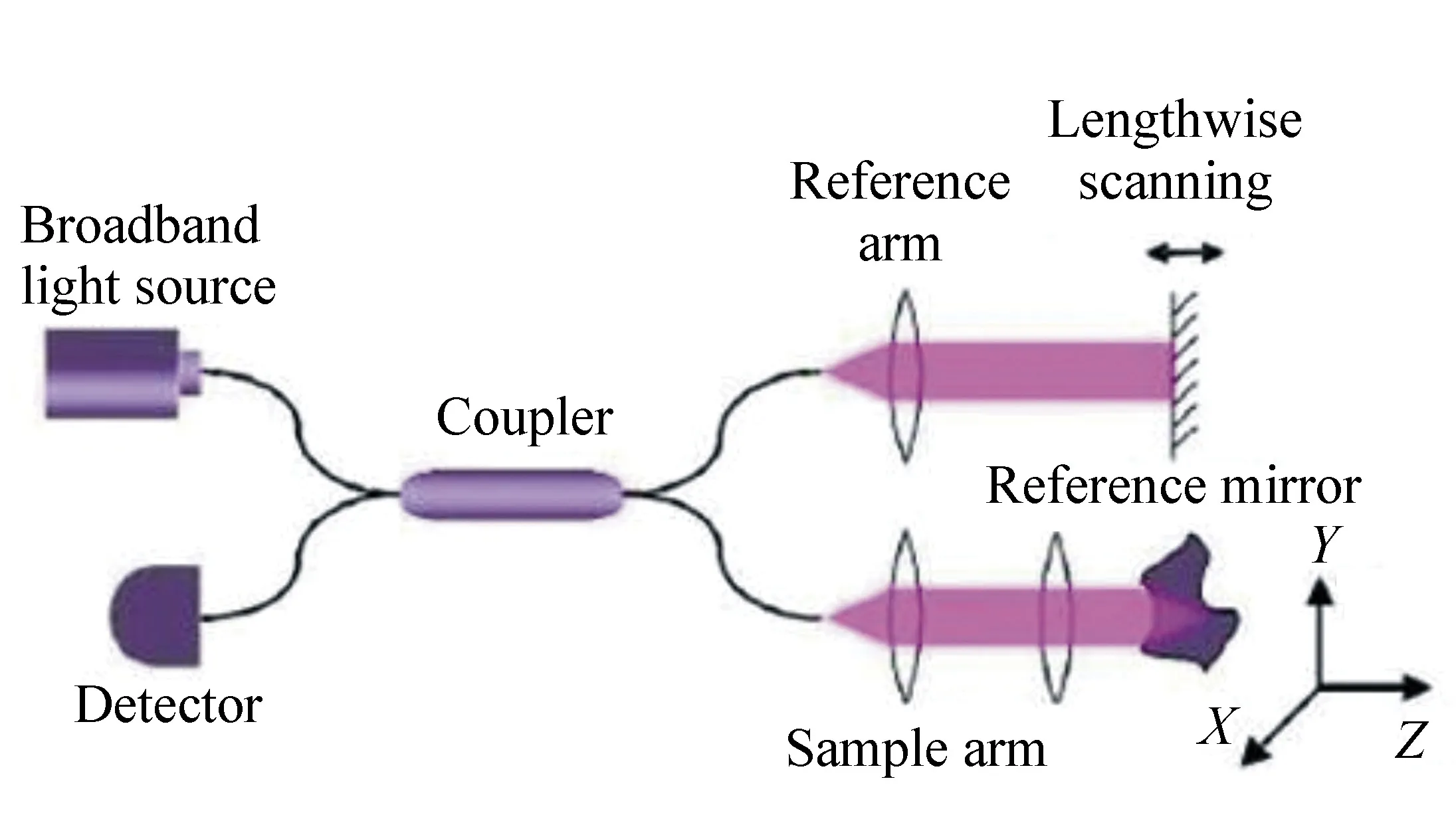
图1 光纤式迈克尔逊干涉仪结构示意图[37] Fig.1 Structural schematic of fiber-optic Michelson interferometer[37]
根据Lambert-Beer定律,组织内部的光衰减为指数衰减,根据特定组织层中的光衰减斜率,可计算出弹道光子衰减系数。该指数衰减斜率与弹道光子总衰减系数(μ=μs+μa,μ为总衰减系数,μs为散射系数,μa为吸收系数)成比例,在近红外波段,皮肤等大多数生物组织的散射系数显著大于吸收系数,故光衰减斜率与组织散射系数成比例[41]。血糖浓度的改变会导致特定组织层散射系数发生变化,因此,分析皮肤等组织中OCT信号斜率的变化,即可预测血糖浓度。
实验已经证实利用OCT技术能够检测到正常生理范围内的血糖浓度[9-11]。Pretto等人[42]发现葡萄糖溶液的光衰减系数与其浓度存在较好的相关性(决定系数R2为0.98)。Larin等人[9,11]发现细胞间质液中葡萄糖浓度每增加10 mg/dL,则组织散射系数降低了0.12%。此外,通过正常受试者的口服葡萄糖耐量试验(Oral Glucose Tolerance Test,OGTT),得到实际血糖浓度每变化10 mg/dL,OCT信号斜率平均变化1.9%的结论。Kuranov等人[10]发现提高OCT扫描的平均A-scan数,可以降低血糖预测误差。He等人[12]发现合适的光学清除剂可以提高OCT信号与血糖浓度之间的相关系数,如50%体积浓度的甘油溶液可以将该值提高7.1%。
与偏振法、近红外光谱法等测量方式类似,OCT方法也存在背景干扰问题。苏亚等人[43]提出一种可最大限度排除皮肤其它层无关信号的干扰,得到散射系数与血糖浓度变化最相关区域位置的算法;该研究小组[44]还发现组织液糖浓度与静脉血糖浓度的延迟时间与皮肤深度有关,皮下区域越深,延迟时间越短;测量应选择700~800 μm深度以下、靠近皮下组织的真皮网状层区域。此外,末梢血糖浓度、静脉血糖浓度与真皮层糖浓度的延迟时间基本相同。测量系统的回归、校正方法也会影响血糖预测模型的准确性。付磊等[38]发现在有异常点的情况下,与最小二乘法相比,广义极大似然估计(M估计)能有效降低模型的预测误差。在克拉克误差分析表格中,M估计表现也更为稳健。
OCT信号强度也与葡萄糖浓度有关,故除上述测量原理外,也可根据以下方法预测血糖浓度:对样本的一个区域进行探测,获得连续的A-scan,A-scan中单点信号强度的变化将改变OCT信号的自相关值,不同点的自相关值会以不同的速率衰减为零,根据去相关时间即可对糖浓度进行预测[45]。Pretto等人[45]通过体外测量葡萄糖溶液浓度发现,OCT信号去相关时间与葡萄糖浓度具有较高的相关性(决定系数R2为0.85)。此方法的在体研究必须考虑生物组织对OCT信号去相关时间的影响。
OCT方法可以选择皮肤特定层作为测量位置,极大地减少了皮肤表面或深部组织对信号的干扰,故OCT技术在无创血糖检测领域表现出良好的发展前景;但在近红外波段,OCT在皮肤中的可见深度仅约1 mm,这意味着在大部分情况下,OCT信号反映的是间质液中的糖浓度,因此建立血糖预测模型必须考虑间质液糖浓度与血糖浓度之间的延迟,这点与偏振法类似;信号可见深度低也导致目前该方法见报的在体测量数据较少,且误差较大,未来可选取嘴内唇等皮肤较薄的部位深入开展实验。在确定最佳测量深度并建立较准确的预测模型后,检测精度势必会不断提高,该方法也有望在未来无创血糖检测领域占据一席之地。
2.3 近红外光谱法
近红外光(750~2 500 nm)谱分析的理论依据是Lambert-Beer定律:溶液吸收或透过的光强是溶液中吸收物质浓度与光通过样品光程长的指数函数,即:
I=I0×10-εbc,
(2)
由此推导出:
lgI0/I=εbc,
(3)
式中,I0为入射光强,I为出射光强,c为溶液浓度,b为光程长,ε为消光系数。
红外光谱法原理如图2所示[46]。光进入人体组织后被吸收、散射,葡萄糖与体内其它成分对不同波长近红外光的吸收与散射强度不同,用不同波长光照射组织,测量光的吸收与散射光谱,以Lambert-Beer定律为基础,利用化学计量学方法进行分析,即可得到血糖浓度。近红外光谱法一般选择舌、唇、耳垂等血管丰富且皮肤较薄的部位进行测量[47]。
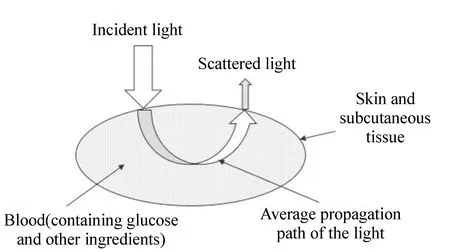
图2 红外光谱法原理图[46] Fig.2 Principle schematic of detection method of infrared spectroscopy[46]
利用近红外光谱法进行血糖浓度测量已有较多突破性研究成果。Chen等人[48]实验发现近红外合频波段(2 000~2 500 nm)比第一倍频波段(1 550~1 850 nm)更适用于无创生化检测。Heise等人[49]用近红外光谱测量了人体血浆、血浆模拟溶液的血糖浓度,利用偏最小二乘回归(Partial Least Squares Regression,PLSR)建立预测模型,血糖浓度预测标准误差(Standard Errors of Prediction,SEP)分别是20.34 mg/dL和16.02 mg/dL。Maruo等人[13]通过数值模拟方法建立校准模型,对ICU患者和正常受试者进行实验,ICU患者血糖预测值相关系数(R)为0.97,SEP为27.18 mg/dL,健康受试者R值为0.71,SEP为28.62 mg/dL。从上述实验结果可以看出,体外测量糖浓度可以得到较精确结果,但由于生理背景等的干扰,直接对人体进行检测的实验结果仍无法满足临床要求。为此,研究者们从不同角度对测量方法进行了改进。
Yamakoshi等人[50]借鉴脉搏测血氧原理提出脉搏测血糖理论,以降低组织背景干扰。Li等人[51-52]提出“动态光谱”法,根据动脉充盈程度对吸光度的影响,消除背景干扰。陈星旦[53]也根据短时间内人体背景的物理、化学参数保持不变,而血流容积持续改变的原理,提出与“动态光谱法”相似的“血流容积差光谱相减法”。该方法在短时间内获取不同血流容积下的近红外光谱,相减后得到引起容积差部分血液的光谱,以消除背景干扰。该方法要求光谱测试仪有足够高的信噪比,以保证从纯血液光谱中提取出血糖的吸收信息[53-54]。刘蓉、陈韵等人[46,55]提出“浮动基准”法。在时间或空间上寻找基准参考点,该点处吸光度变化量可反映各种干扰因素对光谱的影响,而与血糖浓度变化无关,通过参考基准点实现对光谱的修正。该方法的难点在于如何寻找“浮动基准点”的位置。Ramasahayam等人[14]利用基于神经网络的自适应噪声抵消来减少运动伪影的影响。其在现场可编程门阵列(Field Programmable Gate Array,FPGA)上实现了基于人工神经网络(Artificial Neural Network,ANN)的预测模型,处理采集于人体的光电容积描记法(Photoplethysmography,PPG)数据,效果较为明显。上述方法都较好地减少了背景的干扰,但在实际应用上仍存在一定的限制性。
目前,近红外光吸收、散射等理论已经在生物医学分析中得到广泛应用,对葡萄糖溶液、血清溶液等糖浓度的预测实验也得到较高的测量精度。近红外光较大的穿透深度和较强的光谱特性也使其能够应用于人体无创血糖检测,但血液中其它物质、人体组织背景以及体温变化、测量时接触压力等的干扰都会影响红外光谱,进而影响校正模型准确性与测量精度,最终导致测量稳定性低、可重复性差。如何排除干扰、获取高质量的有效信号,是未来研究中亟需解决的问题。
2.4 中红外光谱法
中红外光(2 500~25 000 nm)谱法血糖测量原理与近红外光谱法基本相同。由于水的强烈吸收,中红外光很难穿透皮肤进入内部组织,光谱采集较为困难[15],但利用中红外光谱测量血糖浓度仍具有可行性[56]。这是因为葡萄糖对中红外光的吸收受其它物质干扰较小,吸收峰窄,信息提取较容易,且中红外波段存在对葡萄糖浓度不敏感的波长[16],衰减全反射傅立叶变换红外光谱(Attenuated Total Reflection Fourier Transform Infrared Spectroscopy,ATR-FTIR spectroscopy)如图3所示。故可利用多波长光进行血糖浓度检测。
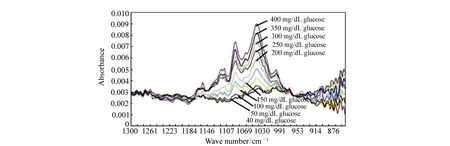
图3 通过ATR-FTIR获得的40~400 mg/dL葡萄糖溶液中红外光谱图[16] Fig.3 Mid-infrared spectra for nine aqueous glucose concentrations between 40 and 400 mg/dL obtained by ATR-FTIR spectroscopy[16]
CO2激光结合ATR技术,可以在一定程度上克服水等物质的背景干扰,对葡萄糖进行灵敏的光谱识别。Mendelson等人[15]利用中红外ATR技术检测全血中葡萄糖浓度,血糖浓度SEP约为22.2 mg/dL。Yu等人[17]利用中红外波长可调谐激光器,结合ATR技术,通过实验测得葡萄糖溶液浓度SEP为3.5 mg/dL。Kino等人[57]利用ATR光谱,结合棱镜多次反射增强测量灵敏度,测得人体嘴内唇间质液中葡萄糖浓度误差(与血液采样分析值相比)小于20%。Liakat等人[58]采集3名健康受试者手掌处的中红外光谱图,利用PLSR和衍生光谱技术精确预测了浓度在75~160 mg/dL之间的血糖水平。在给定最佳校准集的情况下,预测值的平均误差仅比商业电化学仪高2%,实验结果如图4所示。
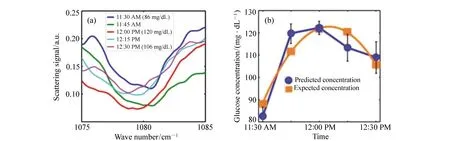
图4 受试者手掌散射光谱图(a)及预测血糖浓度曲线与预期血糖浓度曲线对比(b)[58] Fig.4 Spectra of backscattered light from the palm of a human subject(a); comparison between the predicted and the expected blood glucose concentrations(b)[58]
可以看出,中红外光谱法在血糖检测领域中有着巨大的应用潜力,Liakat等人[58]的实验测量误差已经接近商用电化学分析仪,但测量的可重复性还需进一步验证。目前中红外光谱法也存在一些问题:在中红外波段,葡萄糖产生的吸收信号非常微弱,从测量信号中提取出与血糖相关的信息较困难;此外中红外光谱法也存在与2.3节中所述近红外光谱法类似的问题。量子级联激光器(Quantum Cascade Lasers,QCL)可提供比FTIR功率更高的激光,且造价更低、体积更小,能够提高葡萄糖对中红外光信号的吸收强度,未来可将其应用于血糖无创检测中,Yoshioka等人[59]的实验也证实了QCL在体外葡萄糖溶液与人体实验中代替FTIR的可行性。
2.5 拉曼光谱法
拉曼光谱法测血糖浓度基于拉曼散射现象。光穿过透明介质后散射光频率发生变化。波长范围从可见光到中红外光的激光束入射透明介质后,可以收集到发生频移的拉曼谱线,通过分析得到的光谱可对葡萄糖含量进行定量分析[60]。拉曼光谱法有两方面优势:一是水的拉曼散射很弱,故该方法适用于生物样品水溶液检测;二是光谱谱峰清晰尖锐,易于分析处理[35]。拉曼光谱法的主要局限是葡萄糖的拉曼散射信号非常微弱,容易受到干扰,且利用拉曼光谱高精度定量分析葡萄糖溶液浓度时,必须考虑光谱重叠问题,因此光谱数据的处理与校正算法的选取非常重要。
Enejder等人[19]对17名健康受试者进行OGTT实验,在前臂处采集到461幅拉曼光谱图,利用PLSR校准,并进行一次性交叉验证,与参考血糖浓度相比,预测浓度的平均绝对误差(Mean Absolute Errors,MAE)为7.8%±1.8%,R2为0.83±0.10,证明了拉曼光谱用于血糖浓度检测的可行性。同时,PLSR校准在处理拉曼光谱数据上表现出更大的优势。Goetz等人[18]利用514.5 nm氩激光拉曼光谱仪,结合PLSR校准,测定了葡萄糖、乳酸和尿素混合溶液浓度,其中葡萄糖浓度SD为20.71 mg/dL。另外Shih等人[61]的实验结果也证明了PLSR校准在拉曼光谱法中的适用性。
人体其它内源拉曼活性成分和荧光团对光谱的干扰也是拉曼光谱法预测血糖浓度的一项挑战[62],这就对光谱数据处理和校正算法提出了很高的要求。另外,由于蛋白质分子产生的荧光信号强度等于甚至大于拉曼信号强度,因此该方法的最佳测量部位是眼前房。受眼睛安全照射约束,入射光较微弱,能检测到的信号更加微弱,故目前该方法对离体组织的研究成果较多,但尚未应用于临床。有研究者利用拉曼共聚焦显微技术分析眼睛前房水中葡萄糖浓度,获得了较高的精度,但临床应用的安全性仍需进行评估[47]。
2.6 荧光光谱法
血液中存在大量能发射荧光的基团,当这些基团处于激发态时,可通过辐射弛豫发射荧光,血糖浓度不同的血样,经激发产生的荧光强度与波长均有差异。荧光强度F由公式(4)给出[63]:
F=IAφFZ,
(4)
式(4)中,F为荧光强度,IA为激发态初始分布,φF为量子产率,Z为仪器因子。根据Lambert-Beer定律有,
F=ZφFI0×10εbc,
(5)
式(5)中,I0为入射光强,ε为消光系数,b为光程长,c为葡萄糖浓度。
Russell等人[20]在体外进行了葡萄糖浓度对异硫氰酸荧光素(Fluorescein Isothiocyanate,FITC)葡聚糖荧光强度的影响实验,四甲基罗丹明异硫氰酸酯伴刀豆球蛋白A(Tetramethylrhodamine Isothiocyanate Concanavalin A,TRITC-Con A)与FITC葡聚糖质量比为500∶5时,可以检测到最佳荧光变化。凌明胜等人[63]用365 nm光激发样品,测得不同血糖浓度血清和全血的荧光光谱,得到二者血糖浓度与特征峰强度间的拟合曲线。结果表明,光激发全血时,主要有720 nm和730 nm两个荧光特征峰;在730 nm附近,血清中葡萄糖特征峰强度随葡萄糖浓度的增加而增加。
上述实验表明,荧光光谱法用于血糖浓度检测具有一定的可行性,但血液中荧光物质的丰富性也造成血糖浓度分析的复杂性,而且皮肤颜色和表皮层厚度也会对荧光光谱产生影响。目前利用荧光光谱法检测血糖浓度时,更多的是通过传感器体外测量[64-65]或体内植入传感器[66-67]对血糖水平进行评估,未来若要利用荧光光谱法实现无创的血糖测量,激发光波长的选取、高灵敏度的荧光识别与检测技术以及完善的光谱处理方法至关重要。
2.7 光声光谱法
光声光谱法基于光致超声现象与热弹性机制,其原理是:单色光照射皮肤后,由于体液对光的吸收,照射区域会有一段时间的加热过程,期间热量扩散产生超声压力波,压力波峰峰值与血糖浓度相关,据此可测得血糖浓度[68]。光声过程中产生的超声压力值可通过以下波动方程描述[69]:
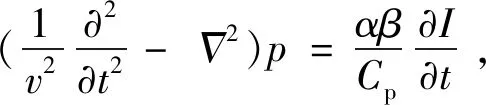
(6)
式(6)中,v为介质中声速,p(r,t)为声压,α为光吸收系数,β为体积热膨胀系数,Cp为比热容,I为激光强度。
对于弱吸收样品,可通过以下等式描述峰值压力P[70-71]:
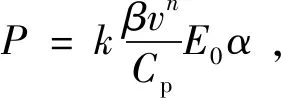
(7)
式(7)中,k为系统常数,n为1到2之间的常数,取决于具体实验条件,E0为入射激光脉冲能量。
光声光谱法常见的测量系统如图5所示,将激光聚焦到样本上,由压电换能器检测产生的热弹性声波,使用数字示波器放大并记录光声信号,最后由计算机进行数据处理[23]。
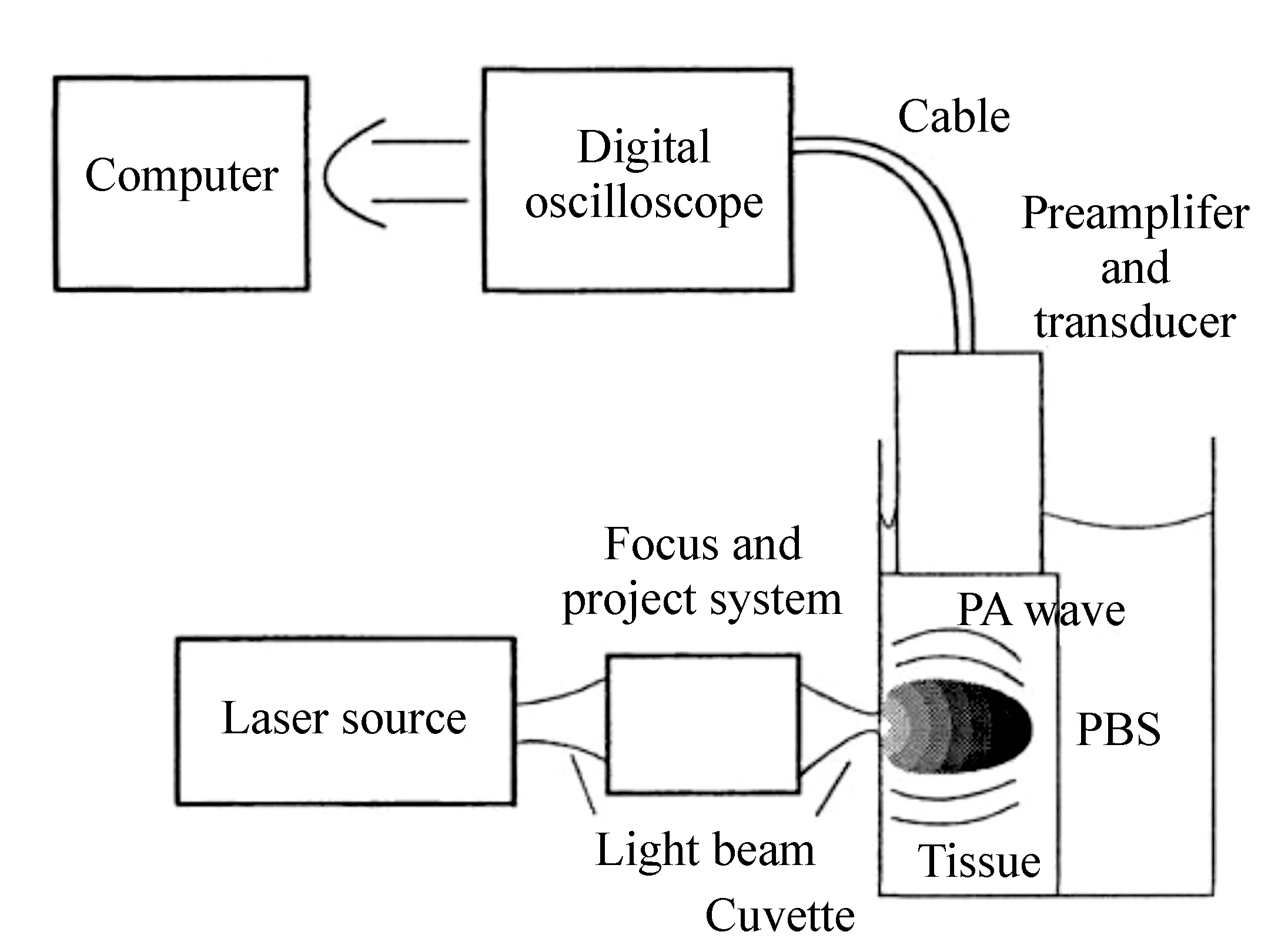
图5 光声光谱法系统示意图[23] Fig.5 Schematic of photoacoustic spectroscopy system[23]
光声光谱法能够消除传统光学测量中反射、散射带来的干扰,在物理、化学和材料等领域得到广泛应用,该方法在血糖检测领域也已经有一些报道。Namita等人[72]发现光声信号随马全血中血糖浓度的增加而线性增强,验证了光声光谱法定量测量血糖浓度的可行性。利用光声光谱法测血糖浓度时,激发光波长的选择灵活性较大。石小巍等人[73]进行了葡萄糖溶液对800~1 100 nm波段近红外光吸收强弱的实验,发现在970 nm波长处得到的声压信号最强。Ren等人[22]通过实验发现在1 300~2 300 nm激光波段中,1 410 nm和1 510 nm波长光对葡萄糖溶液浓度的预测效果要明显优于其它波长。Pai等人[74]利用光声光谱技术测量正常志愿者(通过OGTT实验或进食改变血糖浓度)的血糖浓度,与标准血糖仪测得的参考值相比,平均绝对差(Mean Absolute Difference,MAD)为15.27 mg/dL。另外,校正算法的选取与优化也对光声光谱法的检测结果有较大影响。Ren等人[75]用波长为532 nm的激光照射置于比色杯的葡萄糖溶液,利用一种改进的小波阈值函数,结合平移不变算法(Translation-Invariant Algorithm),获得了更加平滑的葡萄糖光声光谱图,与多诺霍软阈值函数去噪(Donoho′s Soft-Threshold Function Denoise)法相比,信噪比从27.365 8提高到44.706 0,均方根误差(Root Mean Square Error,RMSE)从0.272降低到0.017。
与血糖浓度波动引起的信号变化相比,人体血液循环、体温变化等因素会带来更强的压力波信号。提高激光激发功率,光声信号强度会随之增强[76],可在一定程度上降低背景干扰,但过高的激光强度会对人体产生刺激、灼伤等副作用。因此,未来的研究重点是探寻更合适的激光光源、校正算法以消除环境、组织等背景干扰,保证血糖测量的灵敏度和可重复性。
2.8 基于超声调制的光信号技术法
超声调制光学成像(Ultrasound-Modulated Optical Tomography)技术利用超声波对组织内穿过局域超声场的散射光进行调制,检测散射光中的调制成分,可推断超声区域组织的光学和超声性质。利用超声场对组织进行整体扫描,数据分析重建后即可得到生物组织光学和超声响应的成像图[77],利用这些信息可对血糖浓度进行预测。
陶曾等人[24]研究了超声调制光信号与浑浊介质中葡萄糖浓度的关系。结果表明,超声调制的光信号可以灵敏地反映出浑浊介质中葡萄糖浓度的微小变化;与在散射介质中相比,光信号在吸收介质中对葡萄糖浓度的变化更灵敏。目前超声调制的光信号技术法在体外与体内实验中都达到较高的测量精度。Srivastava等人[25]利用调制超声结合红外光谱检测正常志愿者与糖尿病患者血清溶液葡萄糖浓度,实验测得两者血清溶液的糖浓度最小误差分别为2.77%、6.70%。在此基础上,该研究小组的Chowdhury等人[26]利用上述方法分别对30名正常志愿者(接受OGTT实验)、30名志愿者(包括18名正常志愿者、7名糖尿病前期患者以及5名糖尿病患者)进行在体随机血糖预测实验,并分别与血糖参考值进行比较,获得的血糖浓度预测效果较好(预测血糖浓度MAE分别为15.92 mg/dL、17.76 mg/dL,相关系数分别为0.76、0.85)。
实际测量中,测量部位的形状和大小、运动伪影、仪器漂移、皮肤色素、生理参数(血压、心率、体温等)的改变以及环境的变化等都会对检测结果产生影响[26]。目前利用该方法测量血糖浓度更多的是体外实验的形式,其需要解决以下问题:易受温度干扰,光穿透深度较浅,成像质量较低等[24]。
3 研究展望
测量精度不足、测量可重复性低是目前光学方法无创血糖检测最主要的问题。为解决这些问题,国内外研究小组在完善基础理论与方法、设计实验系统和处理数据等方面进行了大量研究。表1列出了利用前文所述部分方法检测血糖浓度可达到的精度。未来,要继续提高测量精度,实现临床应用,并制成低成本的无创血糖检测设备,重点应把握以下4个方面。
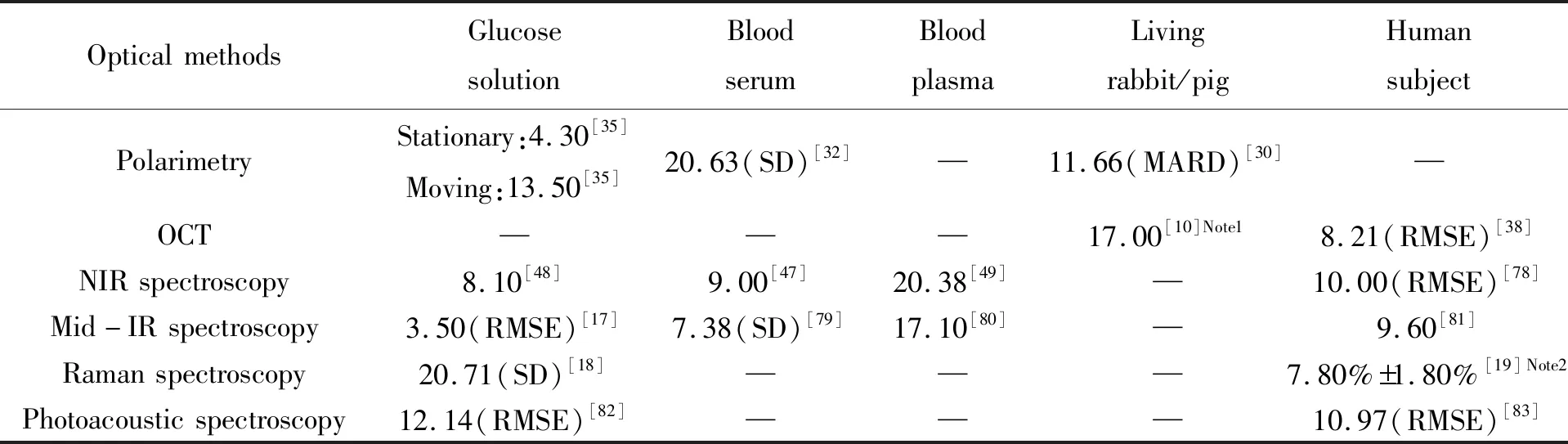
表1 光学无创血糖浓度检测的精度
Note 1:Minimum prediction uncertainty is 17.00 mg/dL; Note 2:MAE of blood glucose is 7.8%±1.8%.
(1)提高测量系统信噪比。血糖浓度变化引起光谱信号的起伏极其微弱,检测系统必须具有高信噪比,才可以使检测结果满足日常血糖监测或临床诊断中要求的精度。未来研究应从提高入射激光强度、提高分光系统效率以及抑制仪器漂移等方面切入,有效的办法是光源采用QCL或可调谐半导体激光器。采用可调谐半导体激光器后,光谱宽度只有几十纳米(合频)或几十波数(基频),可极大地提高测量精度[47]。
(2)消除背景干扰。人体生理背景复杂、易变,直接测量得到的光谱很难真实反映血糖浓度的变化[54]。前文提到的“动态光谱法”、“血流容积差光谱相减法”和“浮动基准法”等方法,都是利用分时对比的方式消除背景干扰,一定程度上降低了测量误差。未来随着光谱分析在生化检测领域更深入的发展,在目前的研究基础上,可尝试将人体内胆固醇、甘油三酯等微量成分的检测一并纳入到无创检测中。这样,既可将无创检测技术推广应用于人体其它成分的检测,同时也间接“消除”了生理背景中其它微量成分对血糖浓度测量的干扰。
(3)确定测量部位。人体不同部位皮肤组织存在差异。目前,眼前房、耳垂、脸颊、舌、前臂、手指等部位都有见报的血糖检测实验,但临床上必须解决测量可行性和安全性问题。如旋光法和拉曼光谱法一般选择眼前房或视网膜作为测量部位,此时应考虑测量时光照对人眼可能产生的影响,在测量精度与入射光强之间找到一个平衡点。
(4)建立更普适的校正模型。测量中仪器的能量漂移、测量对象的个体差异、测头与被测部位接触压力的变化等都会引起远大于由血糖浓度改变引起的光谱变化[54]。另外,OCT、中红外光等对皮肤的穿透深度非常小,实验得到的图像、光谱通常反应的是间质液中的葡萄糖水平。光学检测方法的研究想要更进一步,必须优化计量分析方法,建立更完善普适的校正模型,消除上述不利影响。光谱分析中主要校正方法有:多元线性回归(Multiple Linear Regression,MLR)、主成分回归(Principle Component Regression,PCR)、PLSR、ANN、支持向量机(Support Vector Machine,SVM)、拓扑(Topological)等。随着计算机技术、校正理论以及计量学的不断发展,光学无创血糖检测技术也会日渐成熟。
4 结束语
光学无创血糖检测技术在降低检测成本、减少患者采血痛苦、提高糖尿病患者生存质量方面具有重要意义,目前相关研究表明,实现临床意义上的光学无创检测是可行的。除测量精度高以外,未来真正适用于个人血糖监测的无创血糖仪还应具备以下特点:(1)携带方便;(2)测量迅速;(3)副作用较小;(4)成本较低。回顾几十年来光学无创血糖检测技术的发展,无论是理论研究,还是相关实验,成果都颇丰,但要真正实现其临床应用并制成便携的无创血糖仪,任重道远。近年来研究者将目光更多地集中在光与组织相互作用的原理、高质量光信息的收集以及光谱、图像数据处理方面。随着检测精度的不断提升,相信未来光学无创血糖检测技术势必得到真正普及。

