左旋多巴和姜黄素共递送protocells纳米粒的制备及体外评价
刘畅,周文凯,李桂玲
论著
左旋多巴和姜黄素共递送protocells纳米粒的制备及体外评价
刘畅*,周文凯*,李桂玲
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所制剂室
制备共载左旋多巴和姜黄素 protocells 纳米粒并进行体外评价。
以介孔二氧化硅为内核,脂质双分子层为外膜,制备共载左旋多巴和姜黄素 protocells 纳米粒。使用激光粒度分析仪和透射电子显微镜对所制备纳米粒的形貌、粒径、多分散系数(PDI)和 Zeta 电势进行表征;采用高效液相色谱法对所制备纳米粒的载药量和包封率进行测定;采用透析袋法对所制备纳米粒的体外释放特性进行考察;应用粒径、Zeta电势、载药量等指标对所制备纳米粒的室温贮存稳定性进行评价。
制备的载左旋多巴和姜黄素 protocells纳米粒粒径分布均一性好、粒子表面呈电负性、平均粒径为(210.9 ±2.8)nm、PDI 为(0.201 ± 0.011)。其中左旋多巴的载药量为(20.28 ± 0.43)%、包封率为(10.14 ± 0.22)%;姜黄素的载药量为(1.97 ± 0.01)%、包封率为(98.32 ± 0.01)%。体外释放结果表明该纳米粒 48 h 姜黄素累计释放率为 59.2%,且可有效阻止左旋多巴的泄漏,降低其在循环系统中的暴露量。稳定性结果表明左旋多巴和姜黄素在 protocells 纳米粒中稳定性良好。
载左旋多巴和姜黄素的 protocells纳米粒制备工艺简单,具有良好的理化性质、稳定性及所预期的释放性能。
左旋多巴; 姜黄素; Protocells; 纳米粒; 体外评价
帕金森病(Parkinson's disease,PD)是全球常见的老年慢性神经退行性疾病。据估计,全世界65 岁以上的老年人中,有 1% ~ 2% 的人受此疾病影响[1]。帕金森病的典型病理特征为中脑黑质多巴胺能神经元变性缺失及路易小体的出现。目前,PD 发病机制尚未明确[2]。大量研究表明,氧化应激、线粒体功能异常、细胞凋亡等多种机制参与 PD 发病致病过程[3-6]。
目前还没有研发出可根治 PD 的药物或治疗手段。现有的治疗方法仅能缓解病症,在一定程度提高患者的生活质量[7]。其中,治疗 PD 最有效的药物是左旋多巴,它被誉为治疗帕金森病的“金标准”[8]。其通过在体内转化为多巴胺,储存在多巴胺能神经元中起作用。但是左旋多巴性状不稳定、半衰期短,仅有1% 可以进入中枢神经系统[9]。值得一提的是,左旋多巴仅作为神经递质补充剂,并不能有效阻止或延缓 PD 的恶化。
姜黄素来源于姜科植物干燥根茎,是近年来研究较为热门的一种天然多酚类化合物,具有抗炎、抗氧化应激、抗癌等多方面药理作用[10-11],并可通过抗氧化作用以及螯合金属离子作用,减轻高水平氧化应激反应及神经毒性所致的细胞凋亡,实现对多巴胺能神经元的保护,提高脑内多巴胺水平[12-14]。近年来的研究表明,姜黄素可用于帕金森病的治疗[15]。因此,本研究将姜黄素与左旋多巴联用,在左旋多巴补充神经递质的基础上,进一步通过姜黄素所发挥的抗氧化及修复损伤神经元的作用,达到协同治疗 PD 的效果。
然而,左旋多巴和姜黄素理化性质差异较大,前者是水溶性药物,而后者脂溶性较强。经文献调研,近年来出现的一种新型递送系统 protocells 引起了我们的极大兴趣。Protocells 是一种由脂质双分子层包被介孔二氧化硅(mesoporous silica nanoparticles,MSNs)构成的有机-无机复合结构纳米粒,具有介孔二氧化硅和脂质体的结合优势。Protocells 的内核 MSNs 是一种比表面积大、孔径连续可调且吸附性能优良的无机纳米粒子,可作为药物运送的载体;但是 MSNs 孔道开放,容易发生药物的泄漏,而 protocells 外层脂质双分子层的包覆作用,可有效解决这一问题[16]。
MSNs 作为 protocells 的内核,可通过静电引力、疏水相互作用、氢键作用力等非共价相互作用力,将药物吸附并高效地装载于 MSNs 孔道内[17]。MSNs 孔道内通常用于装载亲水性的小分子化合物。与此同时,protocells 外壳脂质双分子层可以装载亲脂性药物,实现与内核 MSNs 所装载药物的共递送[18-19]。
目前,关于 protocells 的研究多集中于肿瘤治疗领域。Meng 等[19]关于吉西他滨和紫杉醇共载药的 protocells 用于治疗胰腺癌小鼠的研究证明,共载药 protocells 对肿瘤生长和转移的抑制作用优于单载药 protocells 疗效以及吉西他滨和紫杉醇游离药物联合治疗的疗效。Wang 等[20]制备了两种 protocells:载 8-羟基喹啉的乳腺癌干细胞靶向 protocells 以及载多西他赛的无靶向作用 protocells 用于乳腺癌的联合治疗。相比于两种游离药物的联合治疗以及单一 protocells 的治疗,两种 protocells 的联合治疗可显著抑制肿瘤的生长。同时,将多西他赛装载于 protocells 中,可有效避免游离多西他赛的高毒性引起的小鼠体重的显著下降。
因此,本文以介孔二氧化硅为内核,以脂质双分子层为外膜,构建了共载左旋多巴和姜黄素的 protocells 纳米给药系统,对其进行了理化性质表征,初步考察了体外释放及其稳定性。研究结果有望在降低左旋多巴的不良反应及改善治疗效果方面做出有益探索,为研究出低毒、高效、具有良好应用前景的治疗 PD 给药系统提供新的思路和途径。
1 材料与方法
1.1 材料
1.1.1 试剂 正硅酸四乙酯(TEOS)、十六烷基三甲基溴化铵(CTAB)、C20 聚氧乙烯醚(Brij 58)购自上海阿拉丁生化科技股份有限公司;均三甲苯(TMB)、冰醋酸、姜黄素购自阿法埃莎(中国)化学有限公司;左旋多巴购自北京伊诺凯科技有限公司;二棕榈酰磷脂酰胆碱(DPPC)、胆固醇(Chol)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)购自艾伟拓(上海)医药科技有限公司;三氟乙酸(色谱纯)购自北京百灵威科技有限公司;甲醇(色谱纯)、四氢呋喃(色谱纯)购自美国 Fisher Chemical 公司。
1.1.2 仪器 AL204 型分析天平购自美国梅特勒-托利多公司;PHS-3C 型 pH 计购自上海仪电科学仪器有限公司;D3024R 型高速离心机购自美国赛洛捷克公司;Epsilon1-4 型冷冻干燥机购自德国 Christ 公司;Nano-ZS 90 型激光粒度及 Zeta 电位分析仪购自英国 Malvern 公司;HWCL-3 型集热式恒温磁力搅拌浴购自郑州长城科工贸有限公司;2101TH 型超声波清洗器购自上海安谱科学仪器有限公司;JEM-100CX II 型透射电子显微镜购自日本电子株式会社;scientz-950E 型超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;RV10 digital 型旋转蒸发仪购自德国 IKA 公司;e2695 型高效液相色谱仪购自美国 Waters 公司;THZ-C 型恒温振荡器购自太仓市实验设备厂。
1.2 方法
1.2.1 载药 protocells 的制备
1.2.1.1 空白和载药 MSNs 的制备 精密称取 0.437 g CTAB、0.472 g Brij 58,置于 250 ml 圆底烧瓶中,加入 100 ml pH 7.4 PBS 溶液,60 ℃水浴中搅拌 20 min 使其完全溶解后,缓慢加入2.14 ml TEOS,在 60 ℃水浴中加热 60 min 后,缓慢加入2 ml TMB 进行扩孔,继续反应 8 h。然后将反应液离心,洗涤 3 次。取沉淀分散到酸性乙醇溶液中,78 ℃水浴回流 8 h 后,离心,洗涤。重复上述步骤加热回流 3 次,即得空白 MSNs。
取上述制备好的 10 mg MSNs 与 20 mg/ml 的左旋多巴盐酸溶液(盐酸浓度 0.1 mol/L)1 ml,室温共孵育 24 h,即得载左旋多巴 MSNs。
1.2.1.2 空白和载药 protocells 的制备 分别称取 DPPC、Chol、DSPE-PEG2000(摩尔比为75:20:5),置 100 ml 圆底烧瓶中,加入适量氯仿使溶解。制备载姜黄素或双载药 protocells 时,需向其中加入 1 mg/ml 姜黄素氯仿溶液 200 μl,然后通过旋转蒸发法除去氯仿,制得外层脂质薄膜,向其中加入与脂质薄膜同等质量的空白 MSNs 或载左旋多巴 MSNs,及 1 ml 生理盐水,于 37 ℃水浴超声 3 min。然后将液体转移至离心管中,50 w 探头超声 20 min,15 000 r/min 离心 10 min,所得沉淀以去离子水洗涤 2 次,即得空白 protocells(制备中不加入左旋多巴和姜黄素)、载左旋多巴 protocells(制备中不加入姜黄素)、载姜黄素 protocells(制备中不加入左旋多巴)、载左旋多巴和姜黄素 protocells,4 ℃保存备用。
1.2.2 粒径、分布与 Zeta 电势 分别取上述制备的空白 MSNs、空白 protocells 和各载药protocells 纳米粒,分散于水中,稀释至适宜浓度,作为待测样品液,采用 Nano-ZS 90 型激光粒度及 Zeta 电位分析仪测定其粒径、粒度分布(以多分散指数 PDI 表示)及 Zeta 电位。样品粒径测定条件:激光波长设定为 633 nm,入射光与散射光夹角为 90°,测定温度为 25 ℃,每次测定 20 个循环,20 次测定结果的平均值作为最后测定结果。
1.2.3 透射电子显微镜(TEM)形貌表征 采用 TEM 对上述制备所得空白 MSNs、空白protocells 和各载药 protocells 纳米粒的外观形态进行表征。TEM 检测用样品制备:将各纳米粒均匀分散于去离子水中,调节至适当浓度,然后取微量样品点样于洁净的铜网上,并用滤纸吸干多余溶液,5% 磷钨酸溶液负染,待挥干后,置于样品室中,观察纳米粒的结构特征并拍照。
1.2.4 HPLC 测定载药量和包封率
1.2.4.1 左旋多巴含量测定方法
⑴色谱条件 色谱柱:Agillent Eclipse XDB - C18(4.6 mm × 250 mm,5 μm);流动相:四氢呋喃:0.1% 三氟乙酸水溶液 = 3:97;流速:1.0 ml/min;检测波长:280 nm;柱温:25 ℃;进样体积:20 μl。⑵方法学验证 以流动相为溶剂,分别配制 0.01 ~ 4.0 mg/ml 范围内系列浓度左旋多巴溶液,按上述色谱条件进行测定,以峰面积(A)对浓度(C)进行线性回归,得标准曲线方程。取同一载左旋多巴和姜黄素 protocells 的离心洗涤上清液,按照上述色谱条件,同一天内连续进样 6 针,记录左旋多巴峰面积,进行精密度测定。
分别精密量取 20 mg/ml 的左旋多巴盐酸溶液 0.8、1.0、1.2 ml,与 1 ml 空白protocells 溶液混匀,得高、中、低 3 个浓度的供试品溶液。按照左旋多巴含量测定用溶液的处理方法进行处理,取上清液,以流动相稀释至 10 ml,按上述色谱条件分别进样,记录色谱图,量取主峰面积;另取20 mg/ml 的左旋多巴盐酸溶液作为对照溶液进样,记录色谱图,量取主峰面积。以外标法求得各样品液中左旋多巴含量,计算准确度(回收率)。
1.2.4.2 姜黄素含量测定方法
⑴液相色谱条件 色谱柱:Agillent Eclipse XDB - C18(4.6 mm × 250 mm,5 μm);流动相:甲醇:4% 醋酸溶液 = 75:25;流速:1.0 ml/min;检测波长:430 nm;柱温:25 ℃;进样体积:20 μl。
⑵方法学验证 以流动相为溶剂,分别配制0.5 ~ 40.0 μg/ml 范围内系列浓度姜黄素溶液,按上述色谱条件进行测定,以峰面积(A)对浓度(C)进行线性回归,得标准曲线方程。
取同一载左旋多巴和姜黄素 protocells 的离心洗涤上清液,按照上述色谱条件,同一天内连续进样 6 针,记录姜黄素峰面积,进行精密度测定。
分别精密量取 1 mg/ml 的姜黄素氯仿溶液 160、200、240 μl,与 1 ml 空白 protocells 溶液混匀,得高、中、低 3 个浓度的供试品溶液。按照姜黄素含量测定用溶液的处理方法进行处理,取上清液,以流动相稀释至 10 ml,照上述色谱条件分别进样,记录色谱图,量取主峰面积;另取 1 mg/ml 的姜黄素氯仿溶液作为对照溶液进样,记录色谱图,量取主峰面积。以外标法求得各样品液中姜黄素含量,计算准确度(回收率)。
1.2.4.3 Protocells 中左旋多巴、姜黄素的载药量和包封率测定方法[19]精密量取上述制备的各载药 protocells样品液适量,于 15 000 r/min 离心 10 min,吸取 2 ml 上清液,以流动相稀释至 10 ml。分别精密量取适量溶液,按上述左旋多巴和姜黄素含量测定方法,测定其中左旋多巴、姜黄素的浓度,记为 C(mg/ml)。按如下公式计算载药 protocells 中左旋多巴、姜黄素的载药量及包封率:
Protocells 载药质量=药物加入质量– 10C(注:公式中 10 代表测试液体积 10 ml)
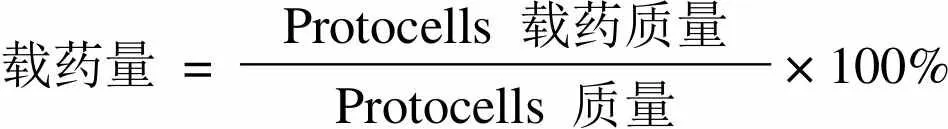
载药量 =Protocells 载药质量× 100% Protocells 质量

包封率 =Protocells 载药质量× 100% 投药量
1.2.5 载左旋多巴和姜黄素 protocells 体外释放度的测定[21]配制含2% 的吐温 80,pH 7.4 的磷酸盐缓冲溶液,作为 protocells 释放介质。
将制备好的载左旋多巴和姜黄素 protocells 装入透析袋(Mw 10 000)中,两端封口,置于装有 50 ml 释放介质的三角瓶中,于 37 ℃,75 r/min 条件下恒温持续振荡,并分别于 0、4、8、12、24、
36、48 h 取样 1 ml(同时补充等体积的释放介质),15 000 r/min 离心 5 min,取上清液,采用 HPLC法测定其中左旋多巴和姜黄素的浓度,按公式⑶,分别计算左旋多巴和姜黄素累积释放百分率,并绘制各自体外释放曲线。
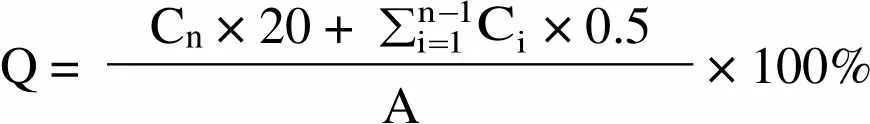
Q =Cn × 20 +× 0.5× 100% A
其中 Q 为累积释放百分率;Cn为第 n 个取样点测得的药物浓度(μg/ml);Ci为第 i 个取样点测得的药物浓度(μg/ml);A 为 protocells 中的左旋多巴或姜黄素的总量(mg)。
1.2.6 Protocells 中药物稳定性考察 由于左旋多巴和姜黄素通常存在不稳定问题,因此考察左旋多巴和姜黄素在 protocells 中的稳定性。制备载左旋多巴和姜黄素 protocells,于室温下储存。1 周后取样,考察粒径及分布、Zeta 电势,及左旋多巴和姜黄素含量,与初始时间点测定的结果进行比较。
2 结果
2.1 HPLC 方法学结果
结果表明,左旋多巴在浓度 0.01 ~ 4.0 mg/ml 范围内、姜黄素在浓度0.5 ~ 40.0 μg/ml 范围内,标准曲线方程分别为 A = 317.43C + 2.7634,2= 0.9999;A = 3.6947C – 0.5219,2= 1,说明其浓度与峰面积均呈良好的线性关系。左旋多巴溶液和姜黄素溶液重复进样的 RSD 分别为 1.13%(n = 6)和 0.92%(n = 6),表明该方法精密度良好。低、中、高浓度左旋多巴溶液和姜黄素溶液的平均回收率分别为 91.48% ~ 109.75% 和 95.47% ~ 111.18%,表明该方法准确度良好。
因此,该 HPLC 方法准确可靠,适用于左旋多巴和姜黄素的载药量和包封率测定、体外释放行为和稳定性的考察。
2.2 粒径、分布与 Zeta 电势
MSNs 及各 protocells 纳米粒的粒径、分布与 Zeta 电势测定结果见图 1 和表 1。制备的 MSNs 平均粒径为(91.7 ± 2.2)nm,粒径分布均一;MSNs 被脂质薄膜包覆后形成的 protocells,水化粒径均在 200 nm 左右,粒径分布均一性良好,粒子表面呈电负性。
2.3 透射电子显微镜形貌表征
由 MSNs 的透射电镜(TEM)形貌表征结果(图 2)可见,本研究所制备的MSNs 为表面多孔、粒径分布均匀的球状粒子。
以 MSNs 为内核,进行脂质薄膜包覆所制备的空白和各载药protocells 纳米粒 TEM 形貌表征结果见图 3。结果表明,与未包覆的 MSN 相比,包覆脂质薄膜后的纳米粒外层可见明显晕圈,证明脂膜成功包覆到 MSNs 表面,形成了核-壳结构的 protocells 纳米粒。
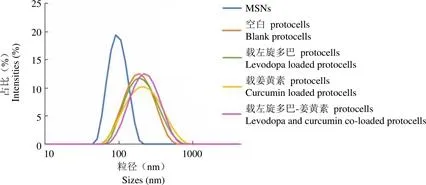
图 1 不同纳米粒的粒径分布图
Figure 1 Size distribution of different nanoparticles
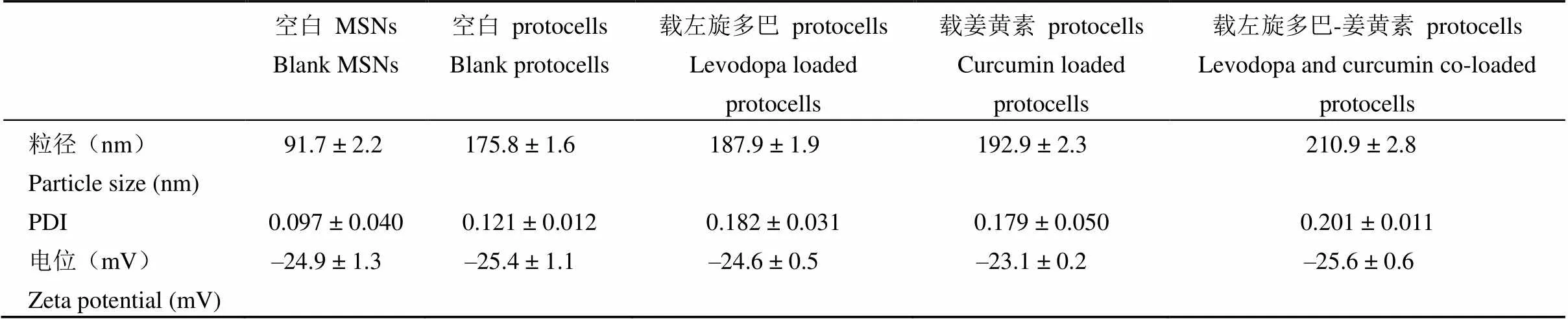
表 1 不同纳米粒的粒径、PDI 与 Zeta 电势

图 2 MSNs 的透射电镜图
Figure 2 TEM images of MSNs
由上述粒径和 Zeta 电势测定结果,及 TEM 表征结果可见,本研究制备的 protocells 纳米粒的粒径分布均一,且载左旋多巴及姜黄素对 protocells 的粒径、表面电性及形貌特征无显著影响。
2.4 Protocells 载药量和包封率
各载药 protocells 中左旋多巴和姜黄素的载药量和包封率测定结果如表 2 所示。结果表明,左旋多巴在 protocells 纳米粒中的载药量约为 20%,包封率约为 10%;姜黄素在protocells 纳米粒中的载药量约为 2%,包封率约为 97%,且左旋多巴和姜黄素双载药对两种药物各自在 protocells 中的载药量和包封率无明显影响。
2.5 载药 protocells 体外释放度的测定
载左旋多巴和姜黄素 protocells 中左旋多巴、姜黄素的体外释放度测定结果如图 4 所示。结果表明,protocells 中的姜黄素在 6 h 内可释放约 20%,12 h 内可释放约 30%,24 h 内可释放约50%,之后逐渐维持稳定。而在 0 ~ 48 h 时间段内未能通过 HPLC 法检测出体外释放介质中左旋多巴的含量。
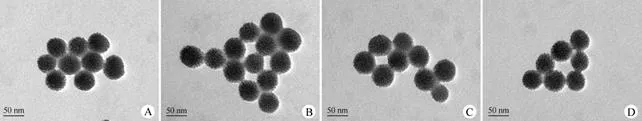
图 3 Protocells 的透射电镜图(A:空白 protocells;B:载左旋多巴 protocells;C:载姜黄素 protocells;D:载左旋多巴和姜黄素 protocells)
Figure3 TEM images of protocells (A:Blank protocells; B:Levodopa loaded protocells; C:Curcumin loaded protocells;D:Levodopa and curcumin co-loaded protocells)

表 2 不同 protocells 中左旋多巴和姜黄素的载药量和包封率
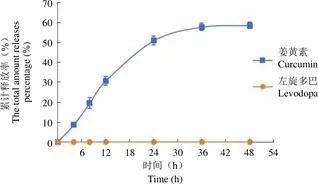
图 4 载左旋多巴和姜黄素 protocells 中左旋多巴和姜黄素的体外释放(,n = 3)
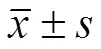
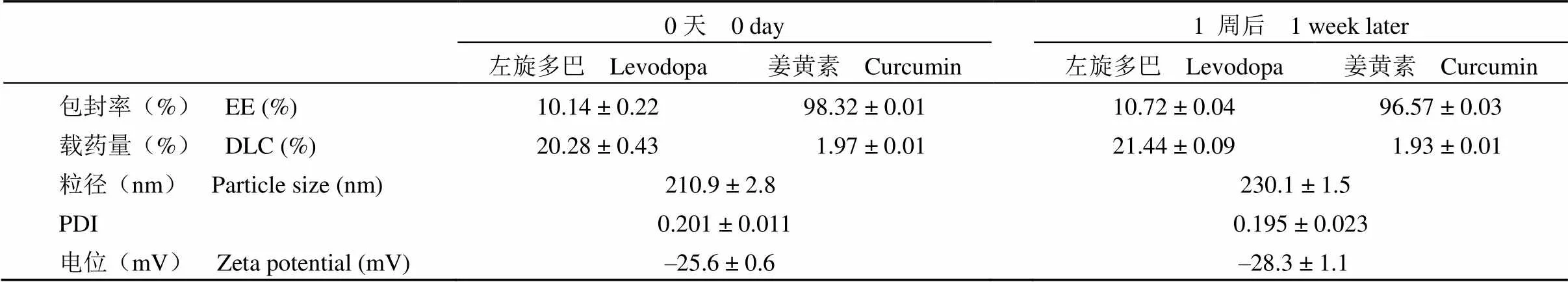
表 3 载左旋多巴和姜黄素 protocells 稳定性测定结果
2.6 Protocells 中药物稳定性考察
取制备的载左旋多巴和姜黄素 protocells,分别于初始时间点和室温贮存 1 周后进行粒径、分布、Zeta 电势及含量测定,结果见表 3。
由表 3 结果可知,室温放置 1 周后载左旋多巴和姜黄素 protocells 中粒径、PDI、Zeta电势及药物含量与初始时间点相比,各指标变化不大。表明载左旋多巴和姜黄素 protocells 在室温下放置 1 周稳定性较好。稳定性考察将继续进行,以考察该给药系统长期放置的稳定性。
3 讨论
近年来,关于新型 protocells 纳米粒在药物共递送方面的报道表明,protocells 作为药物递送系统具有以下优势:①内核介孔硅的高比表面积和高孔隙率,使其具有高载药率。②外膜脂质双分子层能有效封闭内核介孔二氧化硅的表面孔道,防止其中药物泄漏和降解。③内核介孔二氧化硅和外膜脂质双分子层可分别装载水溶性和脂溶性药物,实现不同性质药物的共递送。④在脂质双分子层表面可修饰靶向性配体,构建靶向性给药系统,如脑靶向给药系统[16, 19, 22]。
关于 protocells 的体内归属及安全性问题,protocells 外膜为类似脂质体的结构,而脂质体已被 FDA 批准为多种化疗药物的递送载体,其安全性及生物相容性已得到充分的验证[23]。因此,protocells 安全性问题的焦点在于其内核MSNs。MSNs 的归属问题及其可能带来的安全性隐患的确是该类材料用于体内药物递送的共性问题。近年来,MSNs 纳米粒相关的研究报道越来越多。有文献表明,无机材料 MSNs 体内应用是无毒的,并且脑内蓄积很少[24-25];Yang 等[26]研究表明小鼠静脉注射7 d 后,只有微量的 MSNs 积累在大脑中,尽管残留的 MSNs 在大脑中具有非生物降解性,但没有发现任何病变或组织病理学异常。大部分MSNs 以尿液和粪便的形式从体内排出。此外,我们后期也会对所构建的双载药protocells 体内降解及蓄积毒性进行全面系统的研究。
本研究通过薄膜分散法,以所制备的 MSNs纳米粒为内核,将其包覆在脂质薄膜中,成功制备了有机-无机复合结构纳米粒 protocells,有效解决了姜黄素溶解度和生物利用度低的问题,同时有效避免了左旋多巴在循环系统中泄漏可能带来的毒副作用。所制备的载药protocells 纳米粒在室温条件下放置1 周后各理化性质指标未发生明显变化,提示载药protocells 纳米粒在室温条件下 1 周内性质稳定。
体外释放试验结果表明 48 h 释放介质中检测不到左旋多巴含量。分析原因可能为:由于 48 h 姜黄素仅释放了 59.2%,未完全释放,表明 protocells 外层脂质双分子层在释放实验进行 48 h 后仍包裹于内核 MSNs 外,阻碍了左旋多巴的释放,从而大大降低该药物在外周的泄漏,使其安全性得到明显改善。后续研究中,我们将进一步探索该共载左旋多巴和姜黄素 protocells 在模拟细胞内环境中的释放情况,以及动物体内释放情况。
综上所述,本研究成功地制备并表征了脂质双分子层包裹 MSNs 形成的有机-无机复合结构纳米粒。该共载左旋多巴和姜黄素的 protocells 纳米粒具有递送不同性质药物的优势,并进行了体外评价。接下来,我们将对该纳米给药系统进行进一步细胞水平和动物水平治疗 PD 的药效学及相关机制的研究。期望该共载药 protocells 在补充脑内所缺失多巴胺的同时,可以发挥抗氧化及修复损伤神经元的作用,以达到治疗 PD 的优良效果。期望该双载药 protocells 的开发在 PD 给药系统治疗中的应用提供新的前景。
[1] Poewe W, Seppi K, Tanner CM, et al. Parkinson disease. Nat Rev Dis Primers, 2017, 3:17013.
[2] Przedborski S. The two-century journey of Parkinson disease research. Nat Rev Neurosci, 2017, 18(4):251-259.
[3] Calabrese V, Santoro A, Monti D, et al. Aging and Parkinson's disease:inflammaging, neuroinflammation and biological remodeling as key factors in pathogenesis. Free Radic Biol Med, 2018, 115:80-91.
[4] Hang L, Thundyil J, Lim KL. Mitochondrial dysfunction and Parkinson disease:a Parkin-AMPK alliance in neuroprotection. Ann
N Y Acad Sci, 2015, 1350:37-47.
[5] Sharma N, Nehru B. Characterization of the lipopolysaccharide induced model of Parkinson's disease:Role of oxidative stress and neuroinflammation. Neurochem Int, 2015, 87:92-105.
[6] Wu HM, Li T, Wang ZF, et al. Mitochondrial DNA variants modulate genetic susceptibility to Parkinson's disease in Han Chinese. Neurobiol Dis, 2018, 114:17-23.
[7] Connolly BS, Lang AE. Pharmacological treatment of Parkinson disease:a review. JAMA, 2014, 311(16):1670-1683.
[8] Franco MC, Viana T, Biscaia S, et al. Levodopa incorporation in alginate membranes for drug delivery studies. Adv Mater Res, 2013, 749:423-428.
[9] Kestenbaum M, Fahn S. Safety of IPX066, an extended release carbidopa-levodopa formulation, for the treatment of Parkinson's disease. Expert Opin Drug Saf, 2015, 14(5):761-767.
[10] Harish G, Venkateshappa C, Mythri RB, et al. Bioconjugates of curcumin display improved protection against glutathione depletion mediated oxidative stress in a dopaminergic neuronal cell line:Implications for Parkinson's disease. Bioorg Med Chem, 2010, 18(7):2631-2638.
[11] Ortiz-Ortiz MA, Morán JM, Ruiz-Mesa LM, et al. Curcumin exposure induces expression of the Parkinson's disease-associated leucine-rich repeat kinase 2 (LRRK2) in rat mesencephalic cells. Neurosci Lett, 2010, 468(2):120-124.
[12] Jagatha B, Mythri RB, Vali S, et al. Curcumin treatment alleviates the effects of glutathione depletion in vitro and in vivo:therapeutic implications for Parkinson's disease explained via in silico studies. Free Radic Biol Med, 2008, 44(5):907-917.
[13] Kulkarni AP, Kellaway LA, Lahiri DK, et al. Neuroprotection from complement-mediated inflammatory damage. Ann N Y Acad Sci, 2004, 1035:147-164.
[14] Liu Z, Yu Y, Li X, et al. Curcumin protects against A53T alpha-synuclein-induced toxicity in a PC12 inducible cell model for Parkinsonism. Pharmacol Res, 2011, 63(5):439-444.
[15] Monroy A, Lithgow GJ, Alavez S. Curcumin and neurodegenerative diseases. Biofactors, 2013, 39(1):122-132.
[16] Butler KS, Durfee PN, Theron C, et al. Protocells:modular mesoporous silica nanoparticle-supported lipid bilayers for drug delivery. Small, 2016, 12(16):2173-2185.
[17] Tarn D, Ashley CE, Xue M, et al. Mesoporous silica nanoparticle nanocarriers:biofunctionality and biocompatibility. Acc Chem Res, 2013, 46(3):792-801.
[18] Ashley CE, Carnes EC, Phillips GK, et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nat Mater, 2011, 10(5):389-397.
[19] Meng H, Wang M, Liu H, et al. Use of a lipid-coated mesoporous silica nanoparticle platform for synergistic gemcitabine and paclitaxel delivery to human pancreatic cancer in mice. ACS Nano, 2015, 9(4):3540-3557.
[20] Wang D, Huang J, Wang X, et al. The eradication of breast cancer cells and stem cells by 8-hydroxyquinoline-loaded hyaluronan modified mesoporous silica nanoparticle-supported lipid bilayers containing docetaxel. Biomaterials, 2013, 34(31):7662-7673.
[21] Cauda V, Engelke H, Sauer A, et al. Colchicine-loaded lipid bilayer-coated 50 nm mesoporous nanoparticles efficiently induce microtubule depolymerization upon cell uptake. Nano Lett, 2010, 10(7):2484-2492.
[22] Liu J, Stace-Naughton A, Jiang X, et al. Porous nanoparticle supported lipid bilayers (protocells) as delivery vehicles. J Am Chem Soc, 2009, 131(4):1354-1355.
[23] Deshpande PP, Biswas S, Torchilin VP. Current trends in the use of liposomes for tumor targeting. Nanomedicine (Lond), 2013, 8(9):1509-1528.
[24] Phillips E, Penate-Medina O, Zanzonico PB, et al. Clinical translation of an ultrasmall inorganic optical-PET imaging nanoparticle probe. Sci Transl Med, 2014, 6(260):260ra149.
[25] Park JH, Gu L, von Maltzahn G, et al. Biodegradable luminescent porous silicon nanoparticles for in vivo applications. Nat Mater, 2009, 8(4):331-336.
[26] Yang J, Fan L, Wang F, et al. Rapid-releasing of HI-6 via brain-targeted mesoporous silica nanoparticles for nerve agent detoxification. Nanoscale, 2016, 8(18):9537-9547.
Preparation andevaluation of levodopa and curcumin co-loaded protocells nanoparticles
LIU Chang, ZHOU Wen-kai, LI Gui-ling
We aim to prepare and evaluate the levodopa and curcumin co-loaded protocells nanoparticles.
Levodopa and curcumin co-loaded protocells nanoparticles were prepared with mesoporous silica nanoparticles (MSNs) as core and lipid bilayer as outer membrane. The morphology, particle size, polydispersion index (PDI) and Zeta potential of the nanoparticles were characterized by laser particle size analyzer and transmission electron microscope (TEM). The drug loading capacity (DLC) and entrapment efficiency (EE) of the nanoparticles were determined by HPLC. Therelease characteristics of the nanoparticles were investigated by dialysis bag method. The storage stability of the nanoparticles at room temperature was evaluated by particle size, Zeta potential and so on.
The particle size distribution of levodopa and curcumin co-loaded protocells nanoparticles was uniform with the average particle size of (210.9 ± 2.8) nm and PDI of (0.201 ± 0.011), and the surface of the particles was electronegative. The DLC and EE of levodopa were (20.28 ± 0.43)% and (10.14 ± 0.22)%, respectively. The DLC and EE of curcumin were (1.97 ± 0.01)% and (98.32 ± 0.01)%, respectively. The results ofrelease showed that the cumulative release rate of curcumin was 59.2% in 48 h, and the exposure amount of levodopa was significantly reduced in the circulatory system. The results of stability showed that levodopa and curcumin were stable in the nanoparticles.
The preparation process of levodopa and curcumin co-loaded protocells nanoparticles is simple, which have good physicochemical properties, stability and expected release properties.
Levodopa; Curcumin; Protocells; Nanoparticle;evaluation
LI Gui-ling, Email:liguilingl1999@163.com
10.3969/j.issn.1673-713X.2020.01.003
Author Affiliation:Formulation Laboratory, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, 100050 Beijing, China.
国家自然科学基金(81603062)
李桂玲,Email:liguilingl1999@163.com
2019-09-10
*同为第一作者

