除草剂草铵膦残留量检测方法研究进展
吴浪 张家俊 刘玉梅 刘杉杉 綦世金

摘要:草铵膦具有高效、低残留等特点,是广泛使用于蔬果、茶叶、大米等农作物的一种除草剂。随着人们对生活水平的要求越来越高,草铵膦残留量问题以及对农作物和环境的危害被广泛关注。从而对草铵膦残留量的最大限量值也越来越低,对其痕量残留的分析存在一定的考验。本文从草铵膦除草剂残留量的前处理方法和检测技术2个方面进行归纳总结,为今后草铵膦残留量的检测分析,技术完善以及与草铵膦相关的科学研究提供参考依据。
关键词:草铵膦;残留;检测;研究进展
中图分类号:S-3文献标识码:ADOI:10.19754/j.nyyjs.20200115001
收稿日期:2019-11-28
基金项目:国家民委重点实验室项目(项目编号:民委发(2019)28号);铜仁职业技术学院“黔东茶园土壤对草铵膦吸附-解吸的研究”(项目编号:tzky-2018年-ZK05号)
作者简介:吴浪(1989-),男,硕士,中级职称。研究方向:食品与药品质量安全;通讯作者张家俊。
我国是人口大国,也是农业大国,由于农作物草害时常发生,为了保证农产品的产量,除草剂的使用必不可少。除草剂的大量使用在保证农作物丰收的同时,也带来一系列食品安全和环境问题,造成食畜产品中除草剂残留和积累以及破坏环境生态平衡等问题。随着人类生活水平的提高,人们更加关注食品以及环境中的农药残留。食品安全和生态环境的保护已是国家民生大事,所以农药残留的检测方法和技术受到人们的广泛关注。
草铵膦(Glufosinate ammonium),又名草胺磷铵盐,(RS)-2-氨基-4-(羟基甲氧瞵基)丁酸铵;分子式为C5H15N2O4P;分子量为198.16。在常见的有机溶剂中溶解度较低,在水中溶解度较大。在pH值为5~9的环境下不稳定,易水解,土壤中半衰期<10d,对光稳定。草铵膦是一种目前广泛使用的有机磷类广谱触杀型除草剂,其具有内吸作用不强、活性高、吸收好、低毒、环境兼容性好等特点[1];被广泛应用于茶、玉米、大豆、中药材等农作物田地[2]。虽然草铵膦属于非持久性农药,但大量和随意的使用仍可造成在农作物和环境中残留,从而对生态环境和人类健康造成危害。目前世界各国已对食品中草铵膦的残留量做了最大限量标准。国际食品法典委的规定值为0.02~8mg/kg[3],美国和日本的规定值为0.05~6mg/kg[4,5],加拿大为0.1~2mg/kg[6],欧盟为0.1~5mg/kg[7]。我国食品安全标准GB2763-2016规定草铵膦在番茄、柑橘、茶叶中的最大残留量为0.5mg/kg,香蕉和木瓜中的最大残留量为0.2mg/kg[8]。
本文对草铵膦前处理及检测方法进行分析及探討,以为建立草铵膦的检测方法提供借鉴。目前草铵膦残留量检测的基体以水,土,蔬果、茶叶、大米等农作物为主,近期也有对血液中草铵膦残留量检测的报告。针对复杂的基质,前处理净化技术以液液萃取、固相萃取、分散固相萃取居多。对草铵膦残留量检测的方法主要有气相色谱法(GC)[2]、气相-质谱联用(GC-MS)[9,10]、高效液相色谱法(HPLC)[11,12]、液相-质谱联用法(HPLC-MS)[13,14]、离子色谱法(IC)[15,34]、毛细管电泳法(CE)[16,17]等。
1样品前处理技术
样品前处理对于得到准确的测定结果至关重要,包括样品的保存、制备、提取、净化、富集的过程。虽然目前有很多先进的样品前处理技术或试剂,但由于样本的多样性和样品基质的复杂性,样品的前处理仍然是农药残留检测中的薄弱环节。故对前处理的要求也越来越高,样品前处理正在向简单、快速、试剂消耗少、污染小的方向发展。
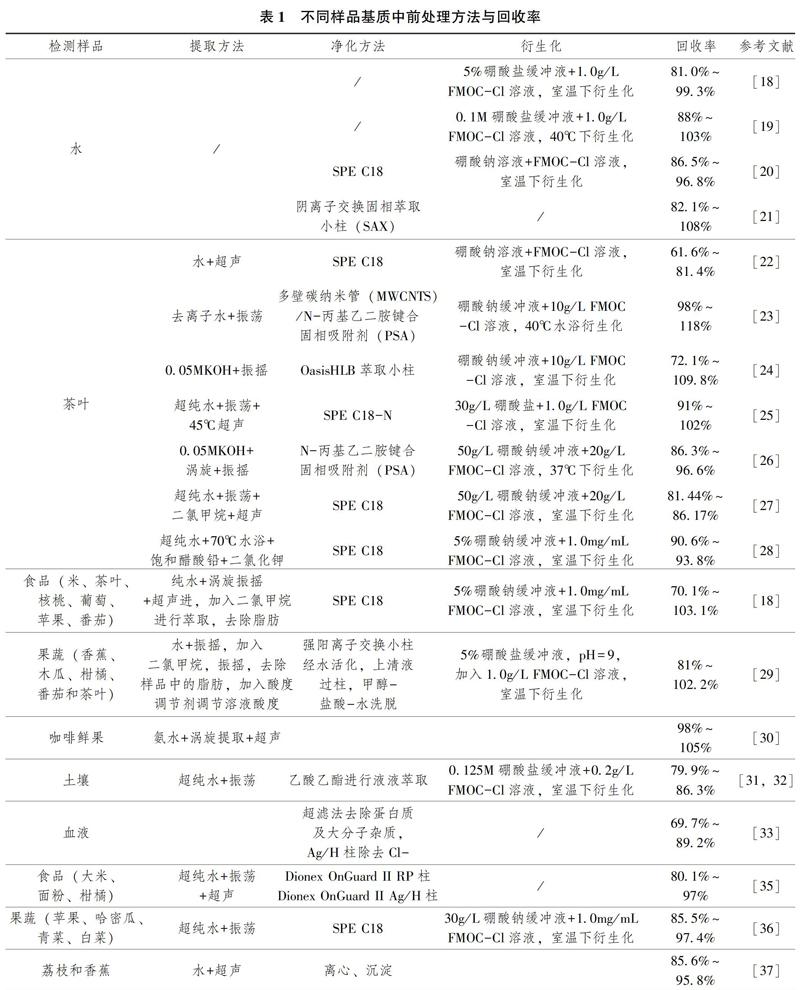
在草铵膦除草剂的残留检测中,不同样品的基质不一样,所以提取和净化方法也不同。一般来说,水和土壤的基质相对简单,其与草铵膦性质相近的物质较少,其基质效应较弱,所以水和土中草铵膦的提取与净化过程相对简单。农产品和生物样本中往往基质比较复杂,样品中含有大量的与草铵膦性质相近的物质,如色素、脂肪、蛋白质等。所以对于农产品和生物样本的提取与净化就比较复杂,有时还需综合使用多种处理方法,方能达到检测要求。表1统计了不同基质中草铵膦的提取和净化方法以及回收率。
1.1提取
提取是根据目标物的极性大小,利用相似相溶的原理来选择适当的提取剂和提取方式。由表1可以得出,无论是哪种类型的样品,对草铵膦提取比较简单的,都是采用超声、振荡、涡旋3种方式。提取溶剂几乎都是水,加入适量的酸碱进行酸度调节,使其提取效果更好;加入适量的有机溶剂(二氯甲烷)去除高脂肪基质中的脂肪,为后续的净化过程减轻压力。采用水作为提取剂的主要原因是草铵膦极性很大,用极性较大的水作为提取溶剂,其效果会更好,也减少了有机溶剂对环境和人的伤害。
1.2净化
在提取的过程中,为了充分地提取出目标物,一些与目标物性质相近的化合物也会随之被提取出来,对目标物的检测造成干扰,所以需要对其进行净化处理。食品(蔬菜、水果、茶叶等)中的色素、脂肪、蛋白质等极性较大的有机化合物与草铵膦的性质相近,会对草铵膦的检测造成一定的干扰,需对提取液进行净化处理。由表1可以得出,对草铵膦提取液的净化主要有液液萃取法、固相萃取法、基于分散固相萃取法等。
1.2.1固相萃取法
固相萃取法(SPE)是目前重要的、普遍运用的一种样品前处理方法。其原理是利用固相吸附剂将液体样品中的目标化合物吸附,与样品的基质和干扰物分离,再用洗脱液洗脱,达到分离净化的目的。目前运用最多的前处理材料是固相萃取小柱,其利用分析物在不同介质中被吸附的能力差将目标物分离提纯。SPE柱按照作用机理,可分为3类。正相萃取柱的固相填料为极性材料,极性官能团键合硅胶(如 CN、NH2、二醇基)和极性吸附物质(Al2O3、硅、硅酸镁、活性炭等)。反相萃取柱的固定性为非极性材料,如C18、C8、C4、HLB、CN、Ph。离子交换固相萃取根据被测物的带电荷基团与键合硅胶上的带电荷基团相互静电吸引实现吸附分离。离子交换分为阴离子(WAX、SAX)和阳离子(WCX、SCX)交换,阳离子填料通常用硅胶上键合磺酸钠盐、碳酸钠盐等作为阳离子交换固定相,阴离子常用脂肪族季铵盐、氨基键合作为固定相。在净化过程中可以根据样品中草铵膦与杂质性质选择合适的萃取小柱,将其分开,达到进化的目的。由表1可以得出,水、土壤、茶叶、蔬菜、水果、大米、血液等均采用了固相萃取法,采用最多的是C18小柱,也有采用HLB[38]、SAX、 PSA萃取小柱,其回收率等相关指标均能达到农药残留检测的要求。C18小柱为反相萃取柱,待净化液经过活化的萃取小柱时,柱填料吸附提取液中的杂质,而对草铵膦的吸附较少,收集净化流出液。此操作简单,有机溶剂的用量较少。
1.2.2液液萃取法
液液萃取法(LLE)是一种基础的提取净化的方法,向液体混合物中加入与目标物不相溶(或稍相溶)的溶剂,因其组分在溶剂中有不同溶解度从而使目标物被分离或提取,达到净化的目的。由表1可以看出,只有一些简单基质的样品(水、土壤等)采用了液液萃取的方法进行净化。茶叶、蔬果等样品中基质比较复杂,含有大量的色素、脂肪和蛋白质等。利用液液萃取法进行净化,往往会出现净化液浑浊和乳化的现象,其净化效果不明显,试剂消耗较大,环境污染大,还需要进一步的净化。
1.2.3其它净化方法
草铵膦的其它净化方法还有离心、沉淀、分散固相萃取法等。王思威[37]用水对荔枝和香蕉进行提取后,采用离心、沉淀的方法进行分离净化处理,净化效果良好,回收率为85.6%~95.8%。多壁碳纳米管(MWCNTS)、N-丙基乙二胺(PSA)对色素具有良好的吸附作用,采用分散固相萃取法对草铵膦提取液净化,目前已被广泛的应用于农药残留检测中[41,42]。杨梅[26]对比了C18净化粉、PSA净化粉、C18萃取柱、HLB萃取柱对草铵膦提取液的净化效果,PSA净化粉能有效地去除色素以及杂质,用量较少,回收率及净化效果较其它几种好,回收率为86.3%~96.6%。冯月超[23]用水对茶叶进行提取后,采用60mgMWCNTS/100mgPSA吸附剂对提取液进行净化,用量较少,净化效果良好,回收率为98%~118%。
2样品的衍生化处理
草铵膦的分子结构不存在共轭双键,缺少发色和荧光基团特性,直接进行检测时存在仪器响应低,干扰大的问题。所以需要对草铵膦提取液进行衍生化处理。由表1可知,对草铵膦的衍生化采用最多的是衍生化试剂是9-芴甲基氯甲酸酯(FMOC-Cl),很多研究者对其进行了改进[39]。FMOC-Cl在碱性环境下,FMOC-基團取代目标化合物氮原子上的氢原子,生成了在检测仪器上具有强响应的衍生化合物FMOC-R。从而能够检测微量以及痕量的草铵膦残留量,满足农药残留检测要求。除此之外,衍生化试剂还有邻苯二甲醛(OPA)、巯基乙醇、特丁甲硅烷基三氟乙酰胺[40]、原乙酸三甲酯[9]等。
3检测技术
草铵膦残留的分析检测已有很多种技术,主要有高效液相色谱法(HPLC)、液相色谱-串联质联法(LC-MS)、离子色谱法、毛细管电泳法(见表2)。其中高效液相色谱法、液相色谱-串联质联法应用最为广泛。
3.1高效液相色谱法
高效液相色谱法是检测草铵膦残留的常用方法之一,经过衍生化的处理液再用紫外检测器和荧光检测器进行检测。石立红等[43]经过衍生化的处理液在草铵膦最大吸收波长265nm下进行检测,检出限为0.4ug/mL,RSD为0.468%。杨华梅等[20]在荧光检测激发波长为266nm,发射波长为315nm下,对经过衍生化的处理液进行检测,检出限为0.0025mg/L,RSD为1.05%~4.04%。由表2可以看出,用高效液相色谱法测定草铵膦残留量几乎是水和土壤这类基质比较简单的样品。HPLC法的灵敏度相对较低,对样品的净化程度的要求较高。
3.2液相色谱-串联质联法
相比液相色谱法,液相色谱-串联质联法具有更强的专一性,定性能力更强,灵敏度更高,故目前被广泛的运用于食品、蔬果等食物中草铵膦的痕量残留的分析检测中。由表2可以看出,用LC-MS测定各种样品中草铵膦的残留量远远多于其它的检测方法。Chamkasem N等[44]在测定大豆和玉米中草铵膦的残留量中,样品经含有Na2EDTA和醋酸的水溶液振荡提取和HLB柱净化,采用LC-MS测定,草铵膦的检出限为14ng/g,RSD为1.6%~9.9%。诸力等[24]建立了超高效液相色谱-串联质谱测定不同茶叶中草铵膦的方法,样品经0.05MKOH振摇提取,提取液中加入硼酸钠缓冲液、10g/L FMOC-Cl溶液,摇匀,室温下衍生化,采用ESI+,离子源温度为500℃,MRM模式检测进行检测,草铵膦的检出限为0.03mg/kg,RSD为1.1%~2.2%。
3.3其它检测法
离子色谱法是将样品经离子交换树脂柱分离后采用电导检测器连续检测流出物电导变化的方法,其具有快速、灵敏、选择性好、在草铵膦残留检测的前处理中无需繁琐的衍生化过程等优点。林森煜等[35]建立了测定食物中草铵膦残留量的离子色谱法,样品经水提取后,乙腈沉淀蛋白质和氨基酸后,无需进行衍生化处理,离心取上清液进离子色谱(分析柱:AS-11阴离子分析柱,AG-11保护柱37minKOH溶液由6~50mmol/L,流速1.0mL/min,柱温 30℃)测定,检出限0.033mg/kg,RSD为2.19%~10.7%。毛细管电泳法是以高压直流电场为驱动力,根据样品各组分之间淌度和分配行为上的差异采用弹性石英毛细管对样品进行分离的方法,具有简单高效、分析速度快、草铵膦残留检测的前处理中无需繁琐的衍生化过程等优点,但重现性差。李小娟等[21]建立了直接测定饮用水中草铵膦残留量的毛细管电泳-间接紫外分析方法,用乙酸铵溶液混匀,收集甲酸-甲醇-乙腈(5∶45∶50)洗脱液进毛细管电泳仪(石英毛细管,紫外检测波长为214nm,分离电压:-25kV)进行测定,饮用水中草铵膦检出限分别为0.3mg/L,RSD为0.42%~2.1%。
4结语
草铵膦除草剂残留检测要求一般在痕量级别,但由于草铵膦独特的物理性质,给草铵膦残留量的检测分析造成一定的难度。为确保方法的科学性,达到农药残留检测要求,合适的前处理以及仪器设备显得尤为重要,为后续的仪器检测奠定基础。目前,草铵膦前处理主要朝高效、友好的方向发展。固相萃取法和分散固相萃取法因操作简单、净化效果好,有机溶剂用量少,对环境污染小,在草铵膦的前处理中运用较多,展现出良好的应用前景。仪器设备方面,对草铵膦的检测要求准确定性定量,灵敏度、准确高。高效液相色谱法的检测灵敏度相对较低,液相色谱-串联质联法凭借选择性好,定性定量准确,分析快速,能进行痕量检测等优点,被广泛的应用到草铵膦除草剂残留量的检测中。对于草铵膦除草剂残留量的检测,目前缺少前处理设备与色谱仪器联用技术。今后,对草铵膦残留量的检测可以向自动化、在线检测方向发展。
参考文献
[1] 凌进. 草铵膦、百草枯、草甘膦对非耕地杂草的防效比较[J]. 农药,2014, 53(08): 613-615.
[2] Tseng S H, Lo Y W, Chang P C, et al. Simultaneous Quantification of Glyphosate,Glufosinate, and Their Major Metabolites in Rice and Soybean Sprouts by Gas Chromatography with Pulsed Flame Photometric Detector[J]. J. Agric. Food Chemistry, 2004(52): 4057-4063.
[3] CODEX Alimentarius.Maximum Residue Limits for Glufosinate-Ammonium[S].
[4] U.S.Government Printing Office.Electronic Code of Federal Regulations[S].
[5] The Japan Food Chemical Research Foundation.Table of MRLs for Agricultural Chemicals[S].
[6] Health Canada.Proposed Maximum Residue Limit: Glufosinate-ammonium[S].
[7] European Commission.Commission Regulation(EU)[Z].
[8] GB 2763-2014食品安全国家标准食品中农药最大残留限量规定[S].北京:中国标准导报,2014.
[9] Royer A,Beguin S, Sochor H, et al. Determination of Glufosinate Ammonium and Its Metabolite (AE F064619 and AE F061517) Residues in Water by Gas Chromatography with Tandem Mass Spectrometry after Ion Exchange Cleanup and Derivatization [J]. Journal of Agricultural and Food Chemistry, 2000(48): 5184-5189.
[10]Motojyuku M, Saito T, Akiend, et al. Determination of Glyphosate, Glyphosate Metabolites, and Glufosinate in Human Serum by Gas Chromatography-mass Spectrometry [J]. Journal of Chromatography B, 2008(875): 509-514.
[11] QianK,HeS,Tang T,et al. A rapid liquid chromatography method for determination of glufosinate residue in maize after derivatisation(Article) [J]. Food Chemistry, 2011, 127(2): 722-726.
[12]GoncharovaE.N.,Statkus M.A.,Tsizin G.I., et al.HPLC Determination of Glyphosate, Aminomethylphosphonic Acid, and Glufosinate Using a Hypercarb Porous Graphite Adsorbent(Article)[J].Moscow University Chemistry Bulletin,2018,73(6):265-271.
[13]Tsao, Yun-Chen;Lai, Yung-Chun;Liu,etal.Simultaneous Determination and Quantitation of Paraquat, Diquat, Glufosinate and Glyphosate in Postmortem Blood and Urine by LC-MS-MS[J].J. Anal. Toxicol,2016,40(6):427-436.
[14]何書海,曹小聪,吴海军,等.直接进样超高效液相色谱-三重四极杆质谱法快速测定环境水样中草甘膦、氨甲基膦酸、草铵膦及乙烯利残留[J]. 色谱,2019, 37(11):1179-1184.
[15]陶雪梅,朱红霞,高丽红,等.柱后加碱-高效阴离子交换色谱-脉冲安培检测法测定农田土中草铵膦、氨甲基膦酸和草甘膦残留[J]. 色谱,2019,37(9):1004-1010.
[16]曹丽伟, 梁丝柳,谭小芳, 等. 毛细管电泳-激光诱导荧光法测定草甘膦、草胺膦及氨甲基膦酸[J]. 色谱, 2012, 30(12): 1295-1300.
[17]Goodwina L, Startinb J R, Keelya B J, et al. Analysis of glyphosate and glufosinate by capillary electrophoresis–mass spectrometry utilising a sheathlessmicroelectrospray interface[J].Journal of Chromatography A, 2003(1004): 107-119.
[18]张燕, 舒平, 陆敏,等.分散固相萃取/衍生化-高效液相色谱-串联质谱法同时测定水和食品中草甘膦、草铵膦和氨甲基膦酸残留[J].食品安全质量检测学报,2017,8(4):1423-1428.
[19]王姗姗,俞瑞鲜,王菲迪,等.柱前衍生结合高效液相色谱-荧光法测定水中草铵膦[J].浙江农业科学,2018,59(7):1242-1245.
[20]杨华梅,杭莉.柱前衍生高效液相色谱法测定饮用水中草甘膦、草铵膦和氨甲基膦酸[J].卫生研究,2015,44(4):671-674.
[21]李小娟,孟品佳,王燕燕.毛细管电泳-间接紫外法测定饮用水中草甘膦、草铵膦及其代谢产物[J].理化检验-化学分册,2015,51(3):307-311.
[22]林永辉,刘正才,杨方,等.柱前衍生化液相色谱-串联质谱法测定茶叶中草铵膦的残留量[J].色谱,2012,30(12):1260-1264.
[23]冯月超,马立利,贾丽,等.多壁碳纳米管分散固相萃取-液质联用技术测定茶叶中草甘膦、草铵膦、氨甲基膦酸残留量[J]. 食品安全质量检测学报,2014,5(4):1147-1153.
[24]诸力,陈红平,周苏娟,等.超高效液相色谱-串联质谱法测定不同茶叶中草甘膦、氨甲基膦酸及草铵膦的残留[J]. 分析化学,2015,43(2):271-276.
[25]陈磊.HPLC-MS/MS 同时检测乌龙茶中草铵膦、草甘膦和氨甲基膦酸残留[J]. 茶叶科学技术,2014,1(1):21-27.
[26]杨梅,孙思,刘文锋,等.超高效液相色谱-串联质谱法测定茶叶中草甘膦和草铵膦的残留量[J]. 食品科学,2019,40(10):337-343.
[27]吴晓刚,陈孝权,肖海军,等.柱前衍生-超高效液相色谱-串联质谱法同时检测茶叶中草甘膦和草铵膦的残留量[J].色谱,2015,33(10):1090-1096.
[28]杨宇锋,陈玉浩,蓝康华,等.超高效液相色谱串联质谱法测定茶叶中的草铵膦、草甘膦及其代谢物[J].广东化工,2018,45(10):231-233.
[29]李优,盛永刚,伊雄海,等.固相萃取/液相色谱-串联质谱法测定果蔬中草铵膦的残留量[J].分析测试学报,2015,34(9):993-998.
[30]张月,吕岱竹,韩丙军,等,超高效液相色谱-串联质谱法测定咖啡鲜果中草铵膦及其代谢产物残留[J].农药学学报,2014,16(6):734-739.
[31]简秋,胡德禹,张钰萍,等.草铵膦在土壤中的残留检测方法及消解动态[J].农药,2015,54(3):201-203.
[32]劉铮铮,李立,王静,等.高效液相色谱-柱前衍生法测定水中有机磷除草剂[J].中国环境监测,2009,25(5):35-38.
[33] 王勇.离子色谱法检验血液中的草铵膦[C].第21届全国色谱学术报告会及仪器展览会. 中国化学会会议论文集,兰州:中国化学会,2017:242.
[34] Suzuki,S.Yamamoto, T.;Kobayashi, Y,etal.Determination of aminomethylphosphonic acid, glufosinate and glyphosate in environmental water using ion chromatography with pulsed amperometric detection(Article)[J].Bunseki Kagaku, 2019, 68(3): 179-187.
[35]林森煜,黄嘉乐,李秀英,等.离子色谱法测定食品中草铵膦、草甘膦和氨甲基膦酸的残留[J].食品安全质量检测学报,2016,7(5):1887-1893.
[36]施雅.UPLC-MS /MS 法测定四种果蔬中草铵膦残留量[J].山东化工,2019,48(13):100-102.
[37]王思威,曾广丰,刘艳萍,等.基于高效液相色谱-三重四极杆质谱技术测定荔枝和香蕉中的草铵膦及3种代谢物[J].色谱,2019,37(1):93-99.
[38]Yoshioka N,Asano M,Kuse A,et al.Rapid determination of glyphosate, glufosinate, bialaphos, and their major metabolites in serum by liquid chromatography-tandem mass spectrometry using hydrophilic interaction chromatography[J]. J.Chromatogr.A,2011,1218( 23) : 3675-3680.
[39]Banez M, Pozo O J,Sancho J, et al. Residue Determination of Glyphosate, Glufosinate and Aminomethylphosphonic Acid in Water and Soil Samples by Liquid Chromatography Coupled to Electrospray Tandem Mass Spectrometry [J]. Journal of Chromatography A, 2005(1081): 145-155.
[40]Matos P, Peixoto F,Carrola J, et al. Biochemical and Histological Hepatic Changes of Nile Tilapia Oreochromis Niloticus Exposed to Carbaryl [J]. Pesticide Biochemistry and Physiology, 2007, 89(1): 73-80.
[41] Zhao PY, Fan SF, Yu CS, et al. Multiplug filtration clean-up with multiwalled carbon nanotubes in the analysis of pesticide residues using LC-ESI-MS/MS[J]. J Sep Sci, 2013, 36(20):3379-3386.
[42 ]Zhao PY, Wang L, Luo JH, et al. Determination of pesticide residues in complex matrices using multi-walled carbon nanotubes as reversed-dispersive solid-phase extraction sorbent[J]. J Sep Sci, 2012, 35(1): 153-158.
[43]石立红,次素英,蔡翠玉,等.柱前衍生化HPLC法测定草铵膦铵盐含量[J].农药科学与管理,2013,34(8):51-54.
[44]ChamkasemN, Harmon T. Direct determination of glyphosate, glufosinate, and AMPA in soybean and corn by liquid chromatography/tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2016, 408(18): 4995-5004.
(责任编辑李媛媛)

