JAMA Neurol:不明原因栓塞性卒中的机制与抗栓治疗
杨中华
重要性 经标准评估后,1/3的缺血性卒中患者仍无法找到确切的病因。在2014年Hart等把这类卒中称为不明原因栓塞性卒中(embolic strokes of undetermined source,ESUS),认为抗凝治疗对这类患者可能有效。但最近的2项随机临床试验并不支持这个假说,因此人们对ESUS的概念提出了疑问。
观点 这篇文章提出ESUS仍然是一个有用的概念,如果根据ESUS患者对抗凝治疗是否有反应将患者分成两个亚组,可以提高ESUS的临床治疗效果。最近研究表明一些ESUS病例是由亚临床心房颤动(atrial fibrillation,AF)、房性心脏病、未被发现的心肌梗死(myocardial infarction,MI)、卵圆孔未闭(patent foramen ovale,PFO)或癌症引起的;而另一些病例则是由非狭窄性大动脉粥样硬化、主动脉粥样硬化或非动脉粥样硬化性血管病变引起的。证据显示第一组患者抗凝治疗优于抗血小板治疗,但在第二组患者则不然,提示需要个体化治疗。
结论和相关性 虽然当前的ESUS概念尚不能指导治疗,但更好地理解ESUS和研发针对其特定机制的治疗方法可能有助于降低卒中负担。
卒中占全世界死因的10%,并会导致大量患者长期残疾。大部分卒中为缺血性卒中,高达1/3的缺血性卒中经标准评估后仍无法找到病因。几十年来,这些卒中被称为隐源性卒中(cryptogenic stroke);2014年,Hart等提出了ESUS的概念,用于代替隐源性卒中。这些研究者解释说,大部分隐源性卒中具有远端栓塞源的临床和影像学表现。ESUS的概念一直是血管神经病学科学进步的概念性推动力。自2014年以来,已发表的200多项研究阐述了ESUS各种可能的潜在机制、自然史以及预防卒中复发的最佳治疗策略。作为这些努力的一部分,最近发表的2项随机临床试验显示抗凝治疗在预防ESUS后卒中复发方面并没有总体益处。这些结果降低了人们对ESUS概念寄予的期望——ESUS可能作为一个整体可采取统一的治疗措施。然而,符合ESUS定义的卒中仍然存在巨大的挑战,提示需要进一步探索它们的病理生理机制和管理措施。本文回顾了最近的一些证据,这些研究强调了以前未被重视的ESUS机制的多样性(图1),并概述了根据患者个体特征采取精准治疗的潜在益处。
1 ESUS概念的提出
ESUS概念的中心观点是大部分隐源性卒中为栓塞性的,在理论上这些患者很可能从抗凝治疗中获益。Hart等假设血栓栓塞的隐匿来源主要包括各种心脏异常、通过PFO的静脉血栓及非狭窄性动脉粥样硬化斑块。他们认为所有这些来源的栓塞大多由血栓组成,因此抗凝治疗应比抗血小板治疗更好地预防卒中复发。基于这个构想,2项大型随机临床试验——NAVIGATE ESUS和RE-SPECT ESUS试验分别验证了非维生素K拮抗剂口服抗凝药物vs阿司匹林对于近期ESUS的疗效。如果疗效得到验证,将不再需要进行大量检查来确定这些缺血事件的原因,大部分ESUS患者将会给予相同的治疗方案比如非维生素k口服拮抗剂抗凝药。不幸的是NAVIGATE ESUS和RESPECT ESUS试验均未能证明抗凝治疗能够减少卒中复发。这些试验结果不禁让人提出这样的疑问:ESUS概念有什么意义,以及不明来源栓塞性卒中采取抗凝治疗有没有疗效。在这篇文章中,作者认为ESUS仍然是一个有用的概念,根据患者对抗凝治疗是否有反应把患者分为两个亚组,这可能会提高其临床治疗效果(图2)。
2 可能对抗凝治疗有反应的隐匿性栓塞机制
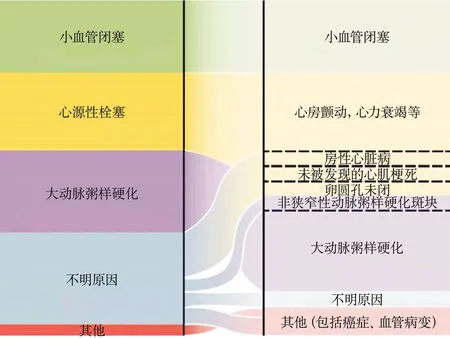
图1 缺血性卒中的病因机制和基于新证据的再分类
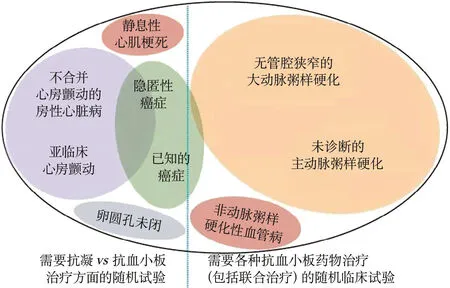
图2 不明原因缺血性卒中的隐匿性病因、病因之间的重叠,以及其对抗凝药物的预期反应
2.1 亚临床心房颤动 亚临床AF是ESUS最重要的隐源性机制之一。AF是常见的心律失常类型,可以表现为阵发性和无症状性,卒中后对患者进行评估检查时常常恢复至窦性心律,因此临床医师常把这类卒中列为ESUS。由于这个原因,过去几十年进行了大量持续心律监测的研究。这些研究显示对近期卒中患者进行延长时间的心律监测,AF检出率高达10%~20%,这个比例高于临床随访的比例。并且随着监测时间的延长,AF检出率增加,持续监测3年后的检出率接近30%。基于这些研究,最近的指南对出院后心律监测做出了中等程度的推荐。
ESUS后检测到的AF是否为前一次卒中的病因尚不清楚。例如,卒中后AF可能是由于中枢自主通路受损所致。然而,许多ESUS后检测到的AF很可能与前一次卒中有关。缺血性卒中特别是隐源性卒中住院后新诊断的AF比例高于出血性卒中或其他非卒中患者住院后新诊断的AF比例,这提示AF和卒中之间存在一定程度的致病联系。对于ESUS后检测到的亚临床AF患者,其卒中二级预防采用抗凝治疗是否优于抗血小板治疗尚不清楚。由于在CRYSTALAF和EMBRACE试验中,大约90%的医师对这类患者采取了抗凝治疗,因此这两项研究的数据无法验证这一假设。人们希望NOAH和ARTESIA试验能为这个问题提供更多解释,这两项试验比较了不合并卒中的亚临床AF患者使用抗凝治疗vs抗血小板治疗的疗效。
关于卒中与亚临床AF之间的关系,还有其他几个问题。首先,即使经过长时间的心律监测,70%的ESUS患者仍未检测到AF,这是怎么回事?显然,亚临床AF并不能解释大部分ESUS病例。其次,仅仅持续几分钟的亚临床AF为何增加几个月后的卒中风险?对于许多患者,AF是在卒中后首次发生的。这些发现削弱了AF和卒中之间直接的因果关系,以至于有人提出了这样的假说:在不合并心律失常的情况下,潜在的心房疾病可能是卒中的病因。
2.2 房性心脏病 心房正常的患者很少发生AF,AF通常发生在心房基质(atrial substrate)异常的患者中。在AF发生之前,心房基质异常如房性心脏病(atrial cardiopathy)、心房心肌病(atrial cardiomyopathy)、心房肌病(atrial myopathy),均可能是血栓栓塞的疫源地。为了验证这一假说,多项研究发现在没有AF的情况下,左心房功能不全的标志物和缺血性卒中之间存在相关性;房性心脏病的标志物与栓塞性卒中强烈相关。对于不合并AF的卒中患者,尽管并未证明抗凝治疗预防卒中复发优于抗血小板治疗,但事后分析发现N末端B型利钠肽原(N-terminal proB-typenatriuretic peptide,NT-proBNP)升高或左心房扩大的患者亚组能够从抗凝治疗中获益。这些发现提示不合并AF的房性心脏病可能是ESUS的潜在发病机制,这些ESUS患者采取抗凝治疗可能优于标准的抗血小板治疗。正在进行中的 ARCADIA试验正在验证这一假说。
2.3 未被发现的心肌梗死 除了尚未被公认的心房异常以外,受损的心室组织也可能是血栓栓塞的病源。一般认为,1个月内的MI会增加卒中风险。然而,最近的证据显示MI是一项更为广泛的卒中危险因素。首先,MI 1个月后卒中风险仍然较高,卒中风险至少持续到MI后3个月。其次,未被发现的MI占所有MI的1/3,也可能是卒中的危险因素。与临床诊断的MI相似,未被发现的MI也会形成心肌瘢痕,这会诱发血栓形成,最终导致心源性脑栓塞(图3D)。未被发现的MI标志物更常见于ESUS患者,而不是非心源性卒中患者,这个现象支持上述假说。鉴于COMPASS试验的发现,临床诊断的冠心病患者采用抗凝治疗比单独抗血小板治疗能更有效地降低缺血性卒中风险,因此,这一类心脏病患者可能适于抗凝治疗。需要进一步的研究来确定对于ESUS合并未被发现的MI或陈旧性MI患者,单独抗凝治疗或联合抗血小板治疗是否比单独抗血小板治疗更加有效。
2.4 卵圆孔未闭 除了获得性心脏危险因素,如房性心脏病和未被发现的MI,大量证据显示PFO(先天性危险因素)可以引起ESUS。关于PFO和卒中之间的关系,过去30年中研究报道了相互矛盾的结果。在病例对照研究中发现二者之间有很强的相关性,但在队列研究中却未发现二者之间存在明显的关系。在主要的卒中病因分类系统中,包括在Hart等提出的ESUS概念中,PFO并未被列为确定性卒中病因机制。但是,一项纳入了5项随机临床试验的Meta分析显示经皮PFO封堵术能够降低合并PFO隐源性卒中年轻患者的卒中复发。这些针对PFO治疗的获益支持了一直以来的假说,即PFO可能是卒中的致病机制。PFO相关卒中的机制为静脉中的栓子通过PFO进入动脉系统,这提示抗凝治疗能够预防PFO相关卒中。几项随机临床试验的汇总分析支持抗凝治疗对合并PFO的隐源性卒中的保护作用,虽然最近发表的RESPECT ESUS试验并未发现抗凝治疗对这组患者的益处。因而,需要进一步研究来确定抗凝治疗对特定亚组患者的疗效,如合并较大PFO的年轻患者。
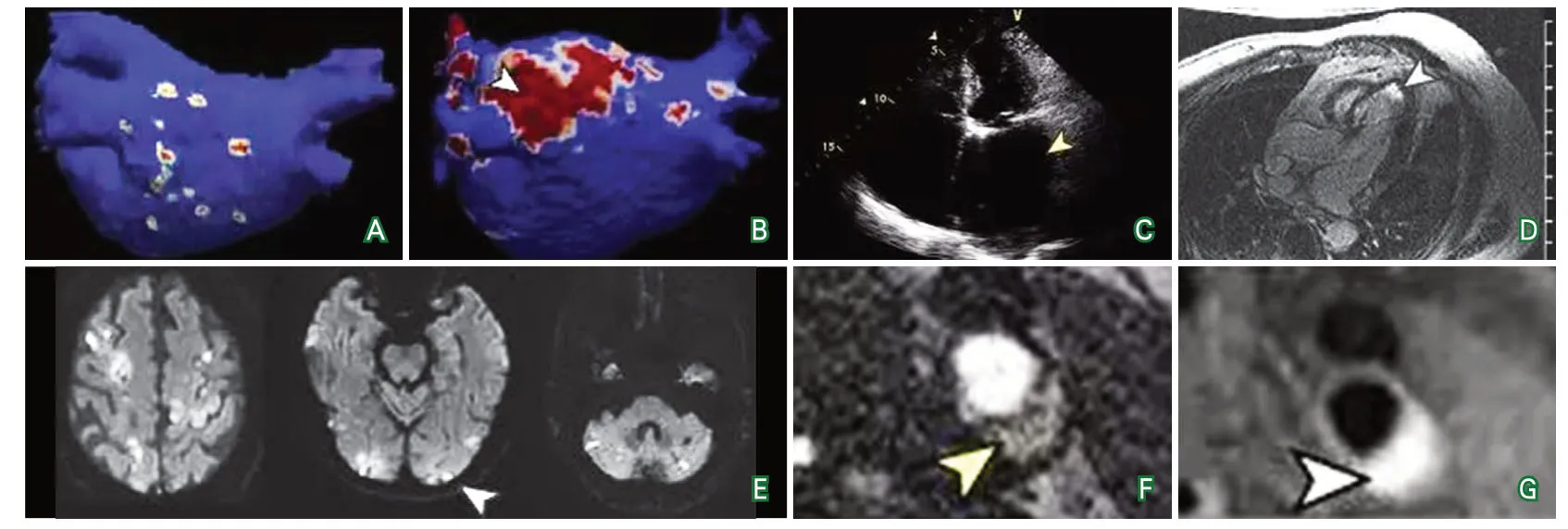
图3 ESUS的影像学表现
2.5 癌症 除了心脏病以外,全身疾病也可能是ESUS被低估的病因机制。常见的例子就是癌症,大约40%的人一生中都会受到癌症的影响。癌症会增加卒中的风险,即使在癌症被发现之前也是如此。在一项基于人群的大型队列中,发现在癌症诊断前5个月时缺血性卒中的风险开始增加,提示某些隐源性卒中可能是由隐匿性癌症引起的。癌症通过几种机制增加了卒中的风险,包括高凝状态、癌症治疗过程中医源性不良作用以及诊断相关的因素,如减少抗栓药物的使用。在这些危险因素中,高凝状态可能是最重要的因素,因为在癌症确诊后不久卒中的风险是最高的,这时癌症介导的高凝状态通常达到了最高点,并且卒中与具有高凝状态的癌症类型相关性最强,其次是静脉血栓栓塞。大约50%的癌症相关卒中被认为是ESUS,多数患者显示累及多个血管分布区(图3E)。
经颅多普勒超声和尸体解剖研究表明非细菌性血栓性心内膜炎是许多卒中患者的病因,但是在真实世界中非细菌性血栓性心内膜炎极少被证实,因此这些患者通常被归类为ESUS。除了非细菌性血栓性心内膜炎以外,癌症患者其他的隐匿性卒中机制包括矛盾性栓塞、肿瘤栓塞,脑血管内凝血导致的原位脑动脉血栓形成。除了瘤栓以外,针对癌症特异性机制的卒中优先选择抗凝治疗可能是有效的。然而,由于肿瘤的破坏作用、频繁的侵袭性手术和化疗引起的血小板减少,癌症患者易于发生全身和颅内出血,这些患者抗凝治疗的风险高于普通的ESUS患者。因此,需要随机临床试验验证合并癌症的ESUS患者采取抗凝治疗的价值,TEACH预试验结果为这些试验的可行性提供了证据。
3 可能对抗凝治疗无反应的隐匿性栓塞机制
3.1 非狭窄性大动脉粥样硬化 前一部分讨论的是预期对抗凝治疗有反应的ESUS机制。NAVIGATE ESUS和RE-SPECT ESUS试验的中性结果表明,要么是亚临床AF、房性心脏病、未被发现的MI、PFO和癌症等病因机制对抗凝治疗无效,要么是抗凝治疗在上述亚组的有效性被ESUS人群中其他机制亚组的无效所抵消。最近的数据提示相当比例的ESUS可能是大动脉粥样硬化性疾病的结果,由于无明显的动脉管腔狭窄而未被重视。多项研究发现对于隐源性卒中患者,同侧非狭窄动脉粥样硬化斑块的检出率高于对侧。传统上,颅内和颈部大动脉动脉粥样硬化是通过动脉血管造影来定义的,主要的卒中病因学分类系统是根据是否存在≥50%的动脉管腔狭窄来定义大动脉起源的卒中。不过,最近的影像学检查比如血管壁MRI能够更加详细地识别血管壁和斑块的特征,揭示了动脉粥样硬化的其他特征(图3F和图3G)。CT和MRI能够检测到一些高危特征,如软斑或斑块内出血,许多ESUS可能是由这些高危、非狭窄性斑块破裂所致。
除了颈动脉和颅内动脉非狭窄斑块外,主动脉粥样硬化和卒中也存在关联。由于很少进行经食道超声心动图检查,因此主动脉粥样硬化所致的卒中通常会被归类为ESUS。最初提出ESUS概念的作者早就认识到了这些机制,并认为动脉粥样硬化斑块表面富含凝血酶的凝血块对抗凝治疗应该是有反应的。当然,他们承认“ESUS栓子源可能对抗凝治疗有不同的反应”。NAVIGATE ESUS试验的亚组分析表明这种异质性是存在的,例如,左心房直径>4.6 cm的受试者(大约占10%)使用利伐沙班有获益。NAVIGATE ESUS试验没有发现利伐沙班抗凝治疗的总体获益,提示在上述亚组的抗凝获益被其他亚组稀释了,罪魁祸首最可能是大动脉粥样硬化组。由于几项随机临床试验发现,对于大动脉粥样硬化性狭窄或主动脉粥样硬化患者,抗凝治疗相比抗血小板治疗并未进一步降低卒中复发风险,因此并不期望这一ESUS亚组人群使用抗凝治疗相比抗血小板治疗有更好的疗效。
3.2 非动脉粥样硬化性血管病 尽管动脉粥样硬化是卒中的最常见病因,但其他的病理生理过程也会导致脑血管病。众所周知,头颈部动脉夹层会导致下游动脉栓塞或低灌注性卒中,特别是年轻患者。非侵入性血管影像可以检测到动脉夹层;但局部夹层,特别是非狭窄性或累及颅内中等动脉的夹层,可能会被漏诊。
近期的颈部外伤或呼吸系统感染可能会引发动脉夹层,这些可以作为夹层诊断的有用线索。CADISS试验显示症状性颈动脉和椎动脉夹层患者给予抗血小板药物和抗凝药物预防卒中的效果是相似的。
感染和炎性血管病也是ESUS的重要考虑因素,特别是存在全身体征或多个血管分布区受累时。水痘-带状疱疹血管病是一种日益被认识的卒中机制,也与颞动脉炎的发生有关。全身性或原发性中枢神经系统血管炎是一种罕见的血管病,一般累及中小型动脉,并且需要进行脑活检才能确定诊断,因此在ESUS患者中这些病因可能会被低估。直接免疫抑制和(或)抗病毒治疗是否能够改善这些非动脉粥样硬化血管病变的自然史,还有待考证。无论感染性还是炎症性血管病都不会从抗凝治疗中获益,并且易出血性血管病患者抗凝治疗是有害的,如β-淀粉样蛋白相关性血管炎。基于这些考量,对于累及颈部和颅内动脉的ESUS患者,抗凝治疗很可能不优于抗血小板治疗。
4 卒中机制的相互作用
卒中的发病机制并不是孤立发生的。许多共有的危险因素,共存多于单独偶发。在一些病例中,这些共存机制可能会相互增强,具有协同作用,从而引发血栓栓塞。
4.1 心房颤动、房性心脏病和癌症 心房机械性功能障碍、引起血液淤滞的心房扩大以及心房纤维化打破促凝抗凝活性正常平衡等,这些心房异常皆易发AF和血栓栓塞。同时,活动性恶性肿瘤状态会引起高凝状态。房性心脏病促成了动脉血液缓慢流动,癌症引发全身高凝状态,这两种情况具有协同作用,二者联合会极大增加心房血栓栓塞的风险。
4.2 动脉粥样硬化和癌症 通过增强全身炎症反应,癌症促进动脉粥样硬化斑块形成和破裂。放疗是许多癌症的标准治疗方案,也容易导致动脉粥样硬化形成和增加卒中风险,特别是放疗的部位位于心脏或头、颈和纵隔的大动脉。放疗引发的血管损伤通常在放疗几年后才出现,是儿童和青年癌症幸存者最关心的问题。在一项对霍奇金淋巴瘤存活者的研究中,颈部和纵隔的放疗使脑血管事件的长期风险增加了一倍多。
5 结论和展望
Hart等在2014年发表的文章中提出了一个简明的ESUS定义,为卒中病因机制的标准化诊断提供了便利。尽管该定义尚无法指导治疗,但它是进一步诊断的基础,有利于帮助临床医师采取更加有效、精准的治疗策略来预防卒中。当然,还需进行大量的工作。虽然必须谨慎地看待亚组分析的结果,但是NAVIGATE ESUS和RE-SPECT ESUS试验亚组分析的结果对于初步验证当前的假说是非常重要的,并且有利于根据对抗凝治疗的反应性提出新的假说。期待出现更多关于PFO特定亚组人群获益于抗凝治疗的证据。ARCADIA试验将有望阐明抗凝治疗是否能够降低房性心脏病患者的卒中复发风险。正在进行中的ATTICUS试验评价了抗凝治疗对合并各种心脏异常ESUS患者的疗效,这些心脏异常包括左心房扩大、PFO或高风险AF(根据CHA2DS2-VASc评分定义)。ARTESIA和NOAH试验将为亚临床AF患者抗凝治疗的获益提供重要信息。基于TEACH预试验的结果,一项Ⅱ期或Ⅲ期临床试验将会评价抗凝vs抗血小板治疗对合并活动性恶性肿瘤ESUS患者的疗效。与此同时,早期探索性研究可更好地理解未被发现的MI和卒中之间的关系,并确立高危非狭窄性斑块的最佳标志物。这些工作将为以后的临床试验奠定基础,比如合并未被发现MI的ESUS患者的抗凝治疗试验,以及高危斑块患者积极抗动脉粥样硬化治疗试验。尽管最近的ESUS试验结果令人失望,但机械取栓治疗急性缺血性卒中的成功提示应避免虚无主义,进一步改进患者的筛选标准,并采取个体化的治疗措施。继续努力理解ESUS,并针对特定机制研发新的治疗方法,这将会进一步降低卒中负担。
文中涉及的研究:
ARCADIA:房性心脏病与隐源性卒中后抗栓药物预防试验
ARTESIA:在合并仪器检测到的亚临床心房颤动患者应用阿哌沙班减少血栓栓塞事件试验
ATTICUS:阿哌沙班治疗不明原因栓塞性卒中试验
CADISS:症状性颈动脉和椎动脉夹层患者卒中预防研究
COMPASS:冠心病或周围动脉疾病患者应用利伐沙班预防主要心血管事件试验
CRYSTAL-AF:隐源性卒中后持续心电监测评估心房颤动试验
EMBRACE:缺血性脑血管病事件后连续30天心电监测记录心房颤动试验
NAVIGATE ESUS:利伐沙班vs阿司匹林预防近期不明原因栓塞性卒中患者的卒中复发及全身栓塞试验
NOAH:房性心脏事件高发患者应用非维生素K拮抗剂口服抗凝药试验
RE-SPECT ESUS:达比加群酯预防不明原因栓塞性卒中患者的卒中复发试验
TEACH:合并癌症和卒中的患者应用依诺肝素vs阿司匹林治疗的预试验
文献出处:KAMEL H,MERKLER A E,IADECOLA C,et al.Tailoring the approach to embolic stroke of undetermined source: a review[J].JAMA Neurol,2019,76(7):855-861.

