响应面优化碱性蛋白酶法提取藜麦淀粉工艺
孔露,孔茂竹,余佳熹,吕远平
(四川大学轻纺与食品学院,四川成都610065)
藜麦(Chenopodium quinoa willd),又被称为南美藜、藜谷等,原产地为南美洲,是藜科藜属的一年生草本植物,能在寒冷、干旱、瘠薄和盐碱等条件下生长[1]。我国于上个世纪90 年代成功引进藜麦,在内蒙古、拉萨、甘肃、青海等地繁育并且广泛种植[2]。藜麦中的营养成分极为丰富,氨基酸的种类和比例均衡,并且富含膳食纤维、矿物质和维生素等营养物质[3]。此外,藜麦还含有多酚、黄酮、皂苷、生物碱等生物活性成分[4]。藜麦中淀粉含量约为49%~60%[5],藜麦淀粉的粒径很小,不同品种的藜麦淀粉粒径略有不同,但总体大小约为1 μm~2 μm[6]。小颗粒的藜麦淀粉应用广泛,在生物可降解材料领域、脂肪替代物、载体材料和化妆品粉扑中均有较好的发展前景[7]。
目前关于藜麦淀粉提取方法的研究主要有稀碱法[8-9]、中性蛋白酶法[10]、复合酶法[6]等。藜麦中蛋白质含量高达12.9%~16.5%[11],并且淀粉和蛋白质容易形成致密结构[12],同时淀粉颗粒与蛋白质存在静电作用、疏水作用、二硫键、氢键等[13],影响淀粉的提取。碱性蛋白酶提取的淀粉表面具有光滑完整的结构,采用碱性蛋白酶法提取的淀粉并未对淀粉颗粒的大小与结构产生不良影响[14-15]。本试验采用碱性蛋白酶法提取藜麦淀粉,通过Box-Behnken 试验设计及响应面对此工艺条件进行优化,以确定提取藜麦淀粉的最佳工艺参数,为进一步研究藜麦淀粉性质提供参考。
1 材料与方法
1.1 材料与试剂
藜麦:青海绿洲种业有限公司;碱性蛋白酶(酶活100 000 U/g):浙江绿之源食品生物科技有限公司;无水乙醚(500 mL)、盐酸(500 mL)、氢氧化钠(500 g)、氢氧化钾(500 g)、硫酸(500 mL)、乙醇(500 mL)、葡萄糖(500 g)、蒽酮(5 g)、甲基红(25 g)、溴甲酚绿(25 g)、硼酸(500 g)、硒粉(25 g):分析纯,成都科龙化工试剂厂。
1.2 仪器与设备
台式低速离心机(TD-420 型):四川蜀科仪器有限公司;马弗炉(SX2-4-12 型):郑州恩格电子科技有限公司;凯氏定氮仪(KDN-C 型)、粗脂肪测定仪(SZF-06型):上海新家仪器有限公司;pH 计(PHS-3C 型):上海仪电科学仪器股份有限公司;紫外分光光度计(UV-1800BPC 型):上海美谱达仪器有限公司;电热恒温鼓风干燥箱(GZX-GF101-Z-BS 型):上海跃进医疗器械有限公司;电热恒温水浴锅(HWS-26 型):上海齐倾科学仪器有限公司;中草药粉碎机(FW 型):天津市泰斯特仪器有限公司;分析天平(SQP 型):北京赛多利斯科学仪器有限公司。
1.3 试验方法
1.3.1 藜麦淀粉的提取
藜麦原料用中草药粉碎机破碎,破碎后过80 目筛,除去麸皮等大颗粒物质。取过筛后的藜麦粉,索氏抽提法除去脂肪,抽提温度为60 ℃,乙醚回流6 次/h,抽提6 h 后取出藜麦粉,再用85%的乙醇除去可溶性糖。取脱脂脱糖后的藜麦粉,加入一定比例的碱性蛋白酶,按照1 ∶12(g/mL)的料液比加入调节至好的一定pH 值的浓度为0.1%的NaOH 溶液。将藜麦浆液放置于一定温度的恒温水浴锅中进行酶解一段时间,将酶解后的藜麦浆液于25 ℃下进行离心(4 000 r/min)10 min,弃去上清液,用蒸馏水洗涤沉淀,再次于25 ℃下离心(4 000 r/min)10 min,重复3 次。将沉淀物于烘箱中以温度40 ℃以下进行干燥,得到藜麦粗淀粉提取物。
1.3.2 主要成分测定
水分含量的测定:参考国标GB 5009.3-2016《食品安全国家标准食品中水分的测定》;脂肪含量的测定:参考GB 5009.6-2016《食品安全国家标准食品中粗脂肪的测定》;淀粉含量的测定:参考蒽酮比色法[16];蛋白质含量的测定:参考国标GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》;灰分的测定:参考国标GB 5009.4-2016《食品安全国家标准食品中灰分的测定》;粗纤维的测定:参考国标GB/T 5515-2008《食品安全国家标准粮食中粗纤维测定》。
1.3.3 蒽酮比色法测定淀粉含量
1.3.3.1 葡萄糖标准曲线的制作
配制不同浓度的葡萄糖(0 %~0.8 %)标准溶液,取1 mL 溶液分别加入蒽酮试剂4 mL,在室温(25 ℃)下静置10 min 后,于620 nm 波长下比色。以吸光值为纵坐标,标准葡萄糖浓度(μg/mL)含量为横坐标,做出标准曲线。标准曲线见图1。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
1.3.3.2 提取淀粉吸光度测定
称取1.000 0 g 左右的淀粉粗提物,放入50 mL 的三角瓶中,再加入沸水25 mL,在沸水中水浴10 min。冷却后过滤稀释,稀释至一定比例,吸取1 mL 稀释液,加入蒽酮试剂4 mL,于室温(25 ℃)下静置10 min 后,在620 nm 波长下测定样品的吸光度。利用标准曲线计算出葡萄糖的含量,以一定系数(0.9)折换成淀粉含量,计算淀粉提取率。
1.3.3.3 提取率的计算
提取率的计算公式如下所示:

1.3.4 工艺优化试验说明
1.3.4.1 单因素试验
以酶添加量、pH 值、酶解时间、酶解温度为影响因子设计单因素试验。
1)酶添加量对藜麦淀粉提取率的影响
固定酶解pH 9.00,酶解温度40 ℃,酶解时间120 min,料液比 1 ∶12(g/mL),选取不同酶添加量(0%、0.20%、0.40%、0.60%、0.80%、1.00%、1.20%、1.40%)进行单因素试验。
2)pH 值对藜麦淀粉提取率的影响
固定酶添加量0.60%,酶解温度40 ℃,酶解时间120 min,料液比 1 ∶12(g/mL),选取不同 pH 值(7.00、8.00、9.00、10.00、11.00、12.00)进行单因素试验。
3)酶解时间对藜麦淀粉提取率的影响
固定酶添加量0.60%,酶解pH 9.00,酶解温度40 ℃,料液比 1 ∶12(g/mL),选取不同酶解时间(20、40、60、80、100、120、140、160、180 min)进行单因素试验。
4)酶解温度对藜麦淀粉提取率的影响
固定酶添加量0.60%,酶解pH 9.00,酶解时间120 min,料液比 1 ∶12(g/mL),选取不同酶解温度(20、30、40、50、60 ℃)进行单因素试验。
1.3.4.2 响应面工艺参数
在单因素试验的基础上确定藜麦淀粉的最佳提取因素范围,利用Box-Behnken 试验设计原理设计响应面试验,以藜麦淀粉得率为评价指标,响应面试验因素与水平见表1。

表1 响应面试验因素与水平Table 1 Factors and levels used in single factor design
1.4 数据处理
采用Origin 8.5 对单因素试验数据进行处理,采用响应面设计软件Design Expert 8.0.6 进行响应面分析。
2 结果与分析
2.1 藜麦原粉主要成分
藜麦原粉的主要成分见表2。

表2 藜麦原粉的主要成分Table 2 The main indexes of Chenopodium quinoa powder%
由表2 可知,藜麦原粉中淀粉含量最高,蛋白质含量次之,高含量的蛋白质不仅能与淀粉形成致密的结构,影响淀粉的提取,还会影响提取淀粉的纯度,因此,碱性蛋白酶可以除去藜麦淀粉中的蛋白质,保证藜麦淀粉的纯度。
2.2 单因素试验
2.2.1 酶添加量对淀粉提取率的影响
酶添加量对淀粉提取率的影响见图2。

图2 酶添加量对淀粉提取率的影响Fig.2 Effect of the amount of enzyme addition on the starch extraction rate
由图2 可知,当酶添加量为0.60%时,藜麦淀粉的提取率达到最高值。这是由于随着酶浓度的不断升高,酶与底物的作用与接触面积持续增加,导致酶解反应速率增大。当酶添加量大于0.60%时,提取率下降,是因为当酶的浓度达到一定值时,酶的含量持续增加导致底物分解,底物浓度相对较低,酶与底物触面积减少,并且与底物结构相同的分子结合酶的活性中心,对碱性蛋白酶产生抑制作用,导致淀粉提取率降低[17]。
2.2.2 pH 值对淀粉提取率的影响
pH 值对淀粉提取率的影响见图3。

图3 pH 值对淀粉提取率的影响Fig.3 Effect of pH value on the starch extraction rate
由图3 可知,曲线在pH 值为9 时出现最高转折点,这可能是由于在该pH 值下的碱性蛋白酶的酶活力最高,酶解作用最强,同时在碱和酶的作用下,藜麦蛋白中一些特定的氨基酸基团暴露在外面,有利于碱性蛋白酶的内外切同时作用[18]。当pH 值大于10 时,提取率呈明显下降趋势,可能是由于碱性太强导致蛋白酶变性,酶失去活力,无法与底物作用,导致提取率降低。
2.2.3 酶解时间对淀粉提取率的影响
酶解时间对淀粉提取率的影响见图4。
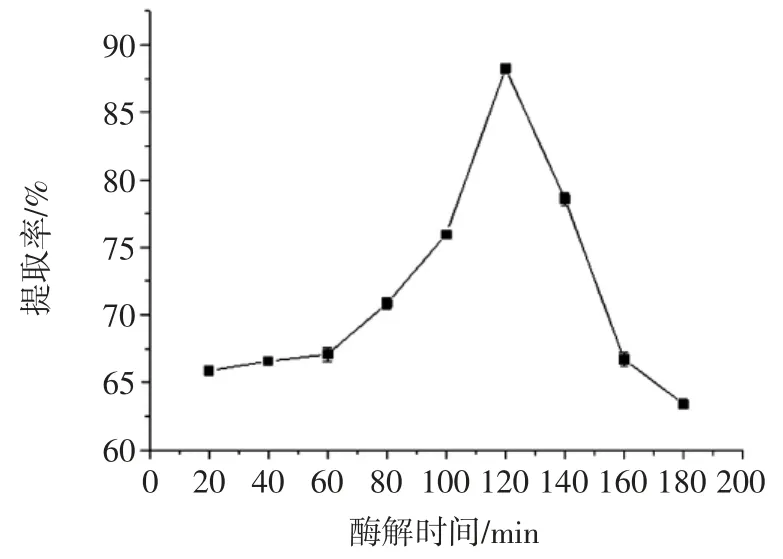
图4 酶解时间对淀粉提取率的影响Fig.4 Effect of enzymolysis time on the starch extraction rate
由图4 可以看出,适宜提取时间为120 min。当酶解时间小于120 min 时,碱性蛋白酶与底物作用时间较短,酶解不充分导致提取率不高。120 min 时酶解反应基本完成,继续增加时间对提取率贡献不大,底物被分解完全。提取率明显降低可能是因为碱性蛋白酶将与淀粉分子结合的蛋白质除去后,淀粉更容易被水解,提取时间过长导致淀粉进一步水解为可溶性单糖,单糖在后续离心洗涤中被除去。
2.2.4 酶解温度对淀粉提取率的影响
酶解温度对淀粉提取率的影响见图5。
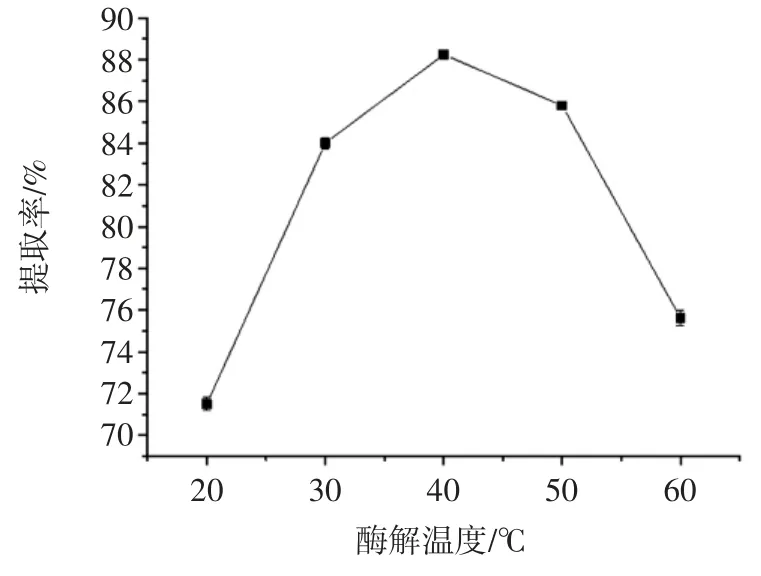
图5 酶解温度对淀粉提取率的影响Fig.5 Effect of enzymolysis temperature on the starch extraction rate
由图5 可知,40 ℃时藜麦淀粉提取率最高。温度对酶活力的影响非常大,从20 ℃到40 ℃,提取率呈上升趋势,温度升高使酶促反应反应速度加快。当温度上升到40 ℃时,酶促反应速度达最大值。这是由于当酶在其最适温度范围内,酶活性最强并且与底物持续作用,酶促反应速度达到最大值,藜麦淀粉提取率最高。但如果超过40 ℃继续升温,高温使酶促反应速度下降,这是由于反应温度过高使得蛋白酶变性,酶活力降低,导致提取率下降。
2.3 响应面分析
2.3.1 Box-Behnken 设计及提取结果
根据单因素试验的结果,固定料液比1∶12(g/mL),选取酶添加量、pH 值、酶解时间、酶解温度进行四因素三水平响应面优化试验。利用Design-Expert.8.0 软件的Box-Behnken 中心组合试验设计方案,试验方案及结果见表3。
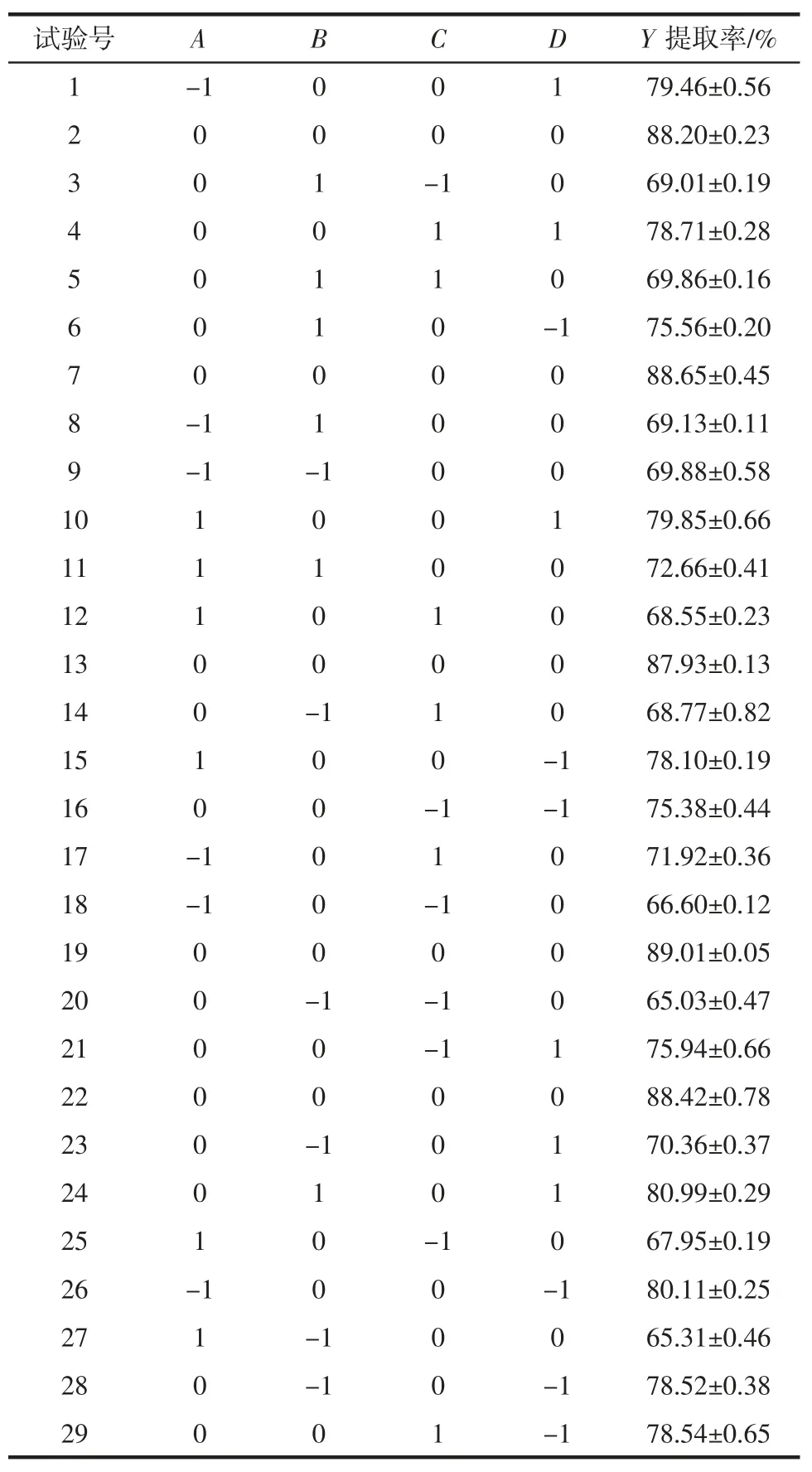
表3 Box-Behnken 设计及提取结果Table 3 Box-Behnken design and extraction results
2.3.2 回归模型的建立和显著性分析
利用Design-Expert 8.0 软件对表3 数据进行多元回归拟合,获得各个因素与淀粉提取率之间的二次多项回归方程为:Y=88.44-0.39A+1.61B+1.37C-0.075D+2.02AB-1.18AC+0.60AD-0.72BC+3.40BD-0.098CD-8.71A2-10.51B2-10.36C2-0.96D2。
该模型的有效性和显著性分析见表4。
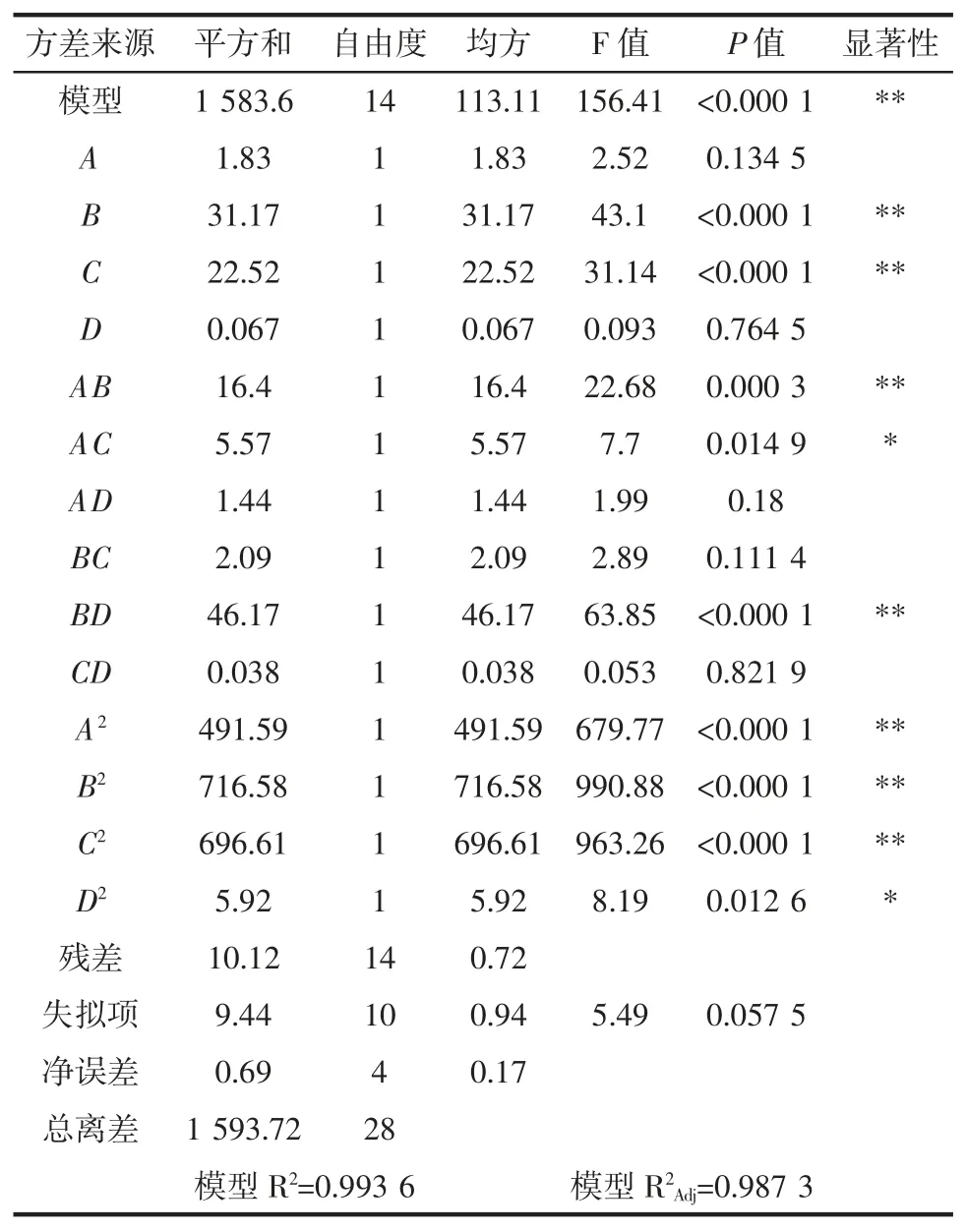
表4 回归模型的方差分析Table 4 Variance analysis of regression model
由表4 可知,P 值<0.000 1,故回归模型极显著,失拟项>0.05,失拟项不显著,说明回归模型与实际情况很好地进行了吻合,试验误差小,可以用此模型对藜麦淀粉的提取率进行分析和预测。模型中一次项B、C极显著,A、D 不显著。交互项 AB、BD 极显著,AC 显著,AD、BC、CD 不显著。二次项 A2、B2、C2极显著,D2显著。
根据回归模型的方差分析结果可知,交互项AB、BD 极显著,AC 显著,为了更直观地反映出各个交互项对藜麦淀粉提取率的影响,分别绘制出相应的三维响应面分析图和等高线图,各因素的交互作用见图6、图 7 和图 8。
三维响应面分析图和等高线图可以直观地反映出各个因素对藜麦淀粉提取率的影响。曲面越陡峭,说明该因素对提取得率的影响越大,交互作用越显著。等高线形状为椭圆表示两因素间的交互作用显著[19]。从图6 中可以看出pH 值对应的曲面较陡,说明pH 值对藜麦淀粉提取率的影响较大,等高线图为椭圆形说明pH 值和酶添加量的交互作用显著。
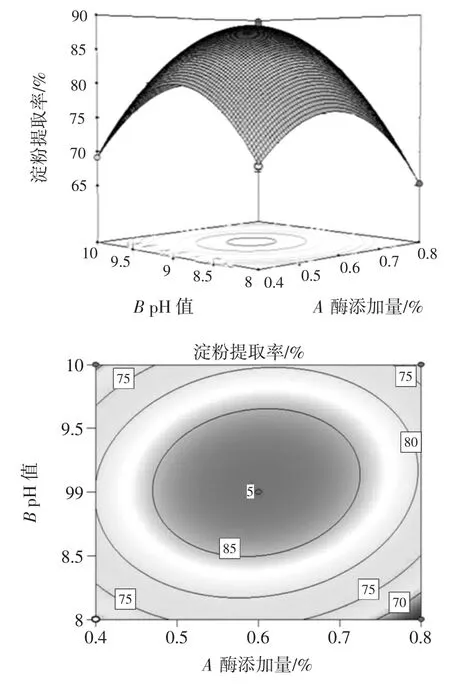
图6 AB 交互作用对藜麦淀粉提取率影响的响应面图和等高线图Fig.6 Response surface plots and contour plots of AB interaction on the extraction rate of Chenopodium quinoa starch

图7 AC 交互作用对藜麦淀粉提取率影响的响应面图和等高线图Fig.7 Response surface plots and contour plots of AC interaction on the extraction rate of Chenopodium quinoa starch

图8 BD 交互作用对藜麦淀粉提取率影响的响应面图和等高线图Fig.8 Response surface plots and contour plots of BD interaction on the extraction rate of Chenopodium quinoa starch
图7 中酶添加量对提取率的影响比酶解温度更大,从等高线图可以看出酶解温度和酶添加量交互显著。
图8 中pH 值对提取率的影响比酶解温度大,等高线图说明pH 值和酶解温度有显著的交互作用。
2.3.3 验证试验
由Design-Expert 8.0 软件分析可知,最大响应值对应的因素条件为酶添加量为0.598%,pH 值为9.09,酶解时间为122 min,酶解温度为40.60 ℃。在最佳提取工艺条件下,藜麦淀粉提取率的预测值为89.26%。为了验证回归模型预测值的准确性,对响应面分析得到的最佳工艺条件进行验证试验,经过3 次平均试验,得出藜麦淀粉的主要成分见表5。

表5 藜麦淀粉的主要成分Table 5 The mainl indexes of Chenopodium quinoa starch%
由表5 可以看出藜麦淀粉的水分含量、脂肪含量、粗纤维含量与灰分含量比起藜麦原粉均有所下降,这是由于在淀粉提取过程中进一步被除去。藜麦淀粉实际提取率为(89.09±0.15)%,与理论预期值的相对误差为0.19%,两者相比无显著性差异,并且蛋白质的残留量为1%,说明经碱性蛋白酶处理的藜麦淀粉蛋白质含量降低,可以将藜麦淀粉应用于蛋白含量低的变性淀粉中或者用于制备藜麦淀粉-硬脂酸复合物[20]。
3 结论
本研究采用碱性蛋白酶提取青海高原藜麦淀粉,经响应面优化后的最佳工艺条件为:酶添加量0.598%,pH 值 9.09,酶解时间 122 min,酶解温度 40.60 ℃。在此条件下,对藜麦淀粉进行提取并测定蛋白质残留率。结果表明藜麦淀粉提取率为(89.09±0.15)%,蛋白质残留率为(1.02±0.46)%,经提取后的藜麦淀粉其水分含量、脂肪含量、粗纤维含量与灰分含量比起藜麦原粉均有所降低。验证试验值与预测试验值相对误差为0.19%,说明可以用此回归模型对藜麦淀粉提取率进行分析与预测。

