高效液相色谱法测定肉桂醛生物转化体系中10种苯基香料
黄秋容,粟桂娇,梁敏,王一凡,于唱,马丽,*
(1.广西大学化学化工学院,广西南宁530004;2.广西大学生命科学与技术学院,广西南宁530004)
肉桂醛是我国重要林产资源——肉桂油的主要成分(约占75%~90%)[1-2]。目前我国产的肉桂油主要是以初级香料原料出口到国外[3],价格低廉,导致桂油相关产业的经济效益和社会效益低下。利用肉桂醛开发高附加值的系列新产品可带动肉桂油相关产业的技术升级,意义重大。利用微生物转化制备的香精香料可视为“天然品”[4-5],附加值大大提高,是国内外研究的热点[6-7]。目前能运用微生物发酵工程制备的天然香料主要有天然乙偶姻[8]、天然香兰素[9]和天然苯乙醇[10]等。关于以肉桂醛为底物通过微生物转化合成天然苯基香精香料的研究较少。为了提高桂油相关产业的经济效益,利用生物转化技术将肉桂醛进一步转化成更高价值的天然苯基香精香料是一个重要途径。实现这一目标的关键在于筛选出耐受、高效转化肉桂醛的菌株。由于微生物种类的多样性,筛菌工作量十分庞大而且微生物转化肉桂醛体系成分十分复杂,如图1所示。Pennacchio 等[11]利用大肠杆菌选择性加氢还原肉桂醛合成肉桂醇;Velasco 等[12]利用真菌Aspergillus sp.生物转化反式肉桂醛,代谢产物主要有肉桂醇、3-苯丙醇、苄醇、1-苯乙醇和 2-苯乙醇;刘斌[13]、张笮晦[14]分别利用从肉桂皮和土壤中分离得到的细菌生物转化肉桂醛合成肉桂醇。为了快速筛选出高效转化肉桂醛的目的菌株并确定其生物转化产物,需要建立一种同时测定肉桂醛生物转化体系中可能产物的分析方法。
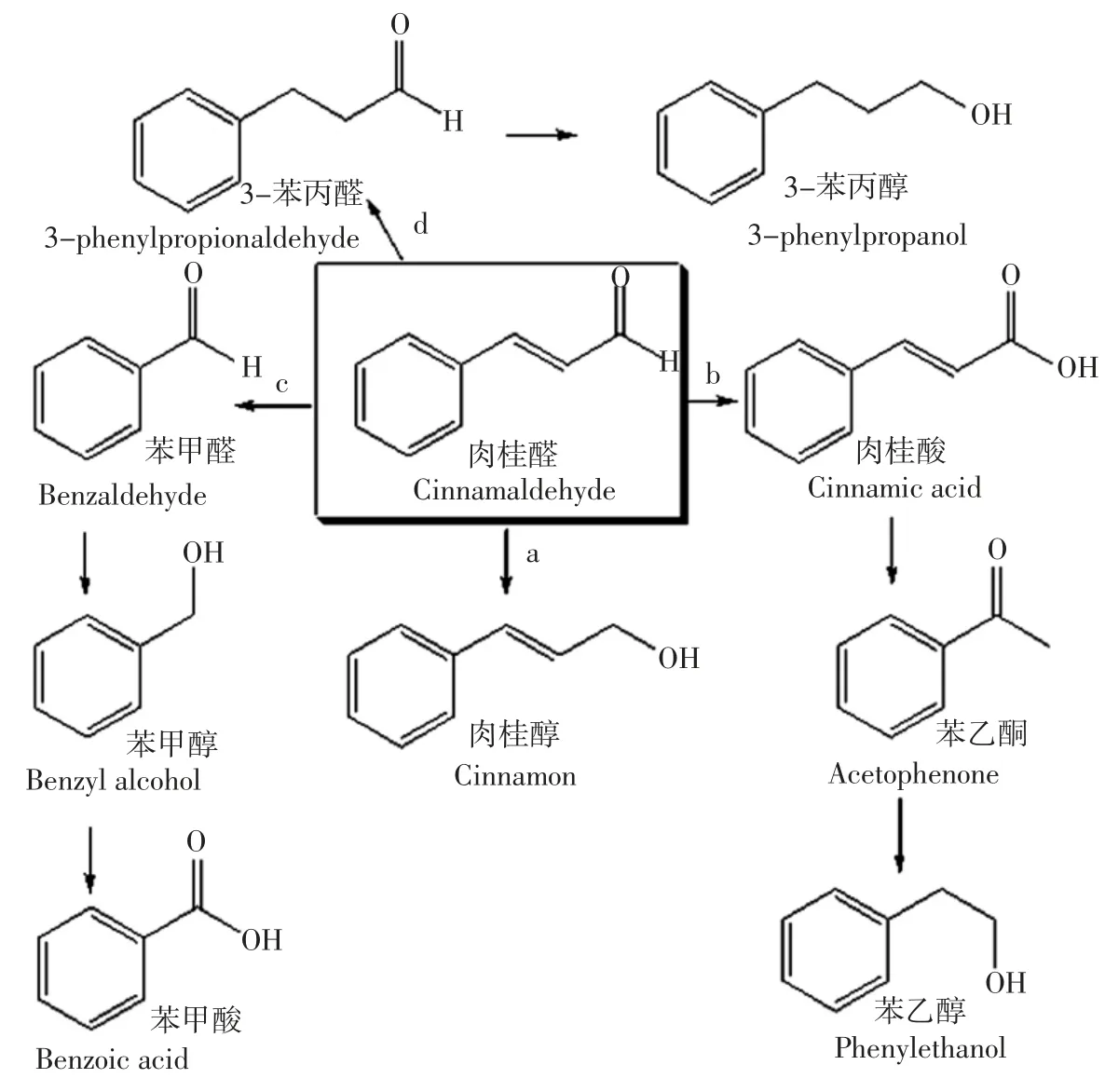
图1 肉桂醛生物转化体系成分关系流程图Fig.1 The flow chart of composition relationships of cinnamaldehyde biotransformation system
目前关于肉桂醛生物转化体系中各物质的分析方法主要有气相色谱法[15-18]、高效液相色谱法[19-22]和紫外-可见分光光度法[23-24]等。这些方法大多只能测定其中的3 种~5 种化合物,能同时检测10 个组分的分析方法未见报道。因此,亟待建立一种同时测定肉桂醛生物转化体系中10 种天然苯基香精香料的分析方法,不仅可用于微生物转化肉桂醛合成天然苯基香料的生物反应体系的成分分析,还能用于高效转化肉桂醛合成高价值天然苯基香精香料菌株的快速筛选。
1 材料与方法
1.1 仪器与试剂
Waters e2695(Separations Module)高效液相色谱仪(配 2489 UV-VIS 检测器)、SunFireTMC18色谱柱(250 mm×4.6 mm,5 μm):美国 Waters 公司;Microfuge 22R 台式微量离心机:德国Beckman Coulter 公司;BSA224S 电子天平:赛多利斯科学仪器(北京)有限公司;;Agilent 8453E 紫外可见分光光度计:美国安捷伦公司;SB25-12YDTD 超声波清洗机:宁波新芝生物科技股份有限公司。
肉桂醛(AR,98 %)、肉桂醇(AR,98 %)、苯甲醛(AR,>98.5%)、苯甲酸(AR,>99%):上海麦克林生化科技有限公司;肉桂酸(AR,98%):上海毕得医药科技有限公司;苯甲醇(AR,99%):阿达玛斯试剂有限公司;苯乙醇(AR,97%):美国 Acros Organics 公司;苯乙酮(GC,>99.0%):上海阿拉丁科技股份有限公司;3-苯丙醇(AR,98%):上海源叶生物科技有限公司;3-苯丙醛(AR,95%):国药集团化学试剂有限公司。甲醇、乙腈(均为色谱级):德国默克公司;冰醋酸(色谱级):天津市科密欧化学试剂有限公司;磷酸(AR,>85%):成都金山化学试剂有限公司。试验所用水均为超纯水。
1.2 标准溶液的配制
混合标准储备液(1.000 g/L):分别准确称取10 种香精香料标准品适量,用无水乙醇溶解配成2.000 g/L的单组分标准储备液;然后分别移取适量体积的各单组分标准储备液于棕色容量瓶,用无水乙醇/基质溶液(体积比1 ∶1)定容得到1.000 g/L 的混合标准储备液。
混合标准工作液:准确吸取适量的混合标准储备液经无水乙醇稀释后得到质量浓度范围为2.00 mg/L~318.60 mg/L 的一系列混合标准工作液。
1.3 样品的制备
将肉桂醛生物转化液加入等体积的无水乙醇,振荡摇匀,静置5 min 后用移液枪吸取2 mL 液体于2 mL EP 管,离心(12 000 r/min,5 min,25 ℃),准确吸取 1 mL上清液于10 mL 棕色容量瓶,用无水乙醇定容后,再用一次性无菌注射器吸取1 mL 样液过0.22 μm 有机滤膜待测。
1.4 色谱条件
色谱柱:SunFireTMC18色谱柱(250 mm×4.6 mm,5 μm);柱温:(30±5)℃;流动相为甲醇 ∶乙腈 ∶水 ∶冰醋酸=28.4 ∶18 ∶53.6 ∶0.04(体积比);等梯度洗脱,流速:1.0 mL/min;检测器:UV-VIS 紫外检测器,检测波长:204 nm;进样量:10 μL。
2 结果与讨论
2.1 样品提取方式的选择
考察了超声提取、振荡提取2 种常见提取方式对微生物转化肉桂醛体系中各组分的提取效率的影响。取同一批次的转化液共6 份,加等量无水乙醇后,加入一定量的混合标准工作液,取其中3 份振荡提取3 min;另外3 份超声提取3 min(超声频率40 Hz,功率30%,温度25 ℃),静置5 min 后用移液枪吸取2 mL液体于 2 mL EP 管,离心(12 000 r/min,5 min,25 ℃),准确吸取1 mL 上清液于10 mL 棕色容量瓶,用无水乙醇定容,过膜,经高效液相色谱法(high performance liquid chromatography,HPLC)分析后,计算加标回收率。结果表明,超声提取和振荡提取两种提取方式对微生物转化肉桂醛体系中各物质的提取效率无明显差异。为试验方便,选择振荡提取方式。
2.2 色谱条件的优化
2.2.1 检测波长的选择
分别取“1.2”节所配置的单组分标准储备液适量,用无水乙醇稀释成质量浓度为10 mg/L 的10 种物质单标液,以无水乙醇为空白液,通过紫外分光光度计于200 nm~400 nm 波长范围内进行全波长扫描,得各组分紫外吸收光谱图,见图2。
如图2 所示,微生物转化肉桂醛体系中的10 种目标待测物的最大紫外吸收峰在204 nm~272 nm 之间。为兼顾各化合物的检测灵敏度,本试验选择204 nm 作为检测波长。
2.2.2 流动相的选择

图2 10 组分紫外光谱图Fig.2 UV spectra of ten components
流动相组成和配比是高效液相色谱分离的重要影响因素之一。考察了甲醇、乙腈和纯水对生物转化肉桂醛体系中10 种物质的色谱分离效果。结果发现,3 种试剂无论是单独或者两两组合用作流动相均不能将体系中的10 种物质完全有效分离;当流动相为甲醇 ∶乙腈 ∶水=28.4 ∶18 ∶53.6(体积比)时,各组分能实现有效分离。
在探究流动相比例的过程中,较高浓度时肉桂酸峰型较宽且出现拖尾现象,这可能是肉桂酸分子离子化造成的。加酸可抑制酸的电离。试验比较了在纯水中加入0.04%磷酸和0.04%冰醋酸对改善肉桂酸峰型的效果。结果表明,在纯水中加入0.04%的冰醋酸后,肉桂酸检测灵敏度提高,峰型变窄,拖尾现象减轻,且对其他组分无影响。因此,最终选择流动相为甲醇 ∶乙腈 ∶水 ∶冰醋酸=28.4 ∶18 ∶53.6 ∶0.04(体积比)。此条件下10 种目标待测物在20 min 内全部出峰,且分离效果良好,标准图谱见图3。

图3 10 组分混标液(100 mg/L)HPLC 色谱图Fig.3 HPLC chromatogram of ten components mixed standard solution
2.3 分析方法评价
2.3.1 基质效应
基质效应(matrix effects,ME)是指除目标测定物以外的其余组分对测定结果影响,即基质对分析方法准确性的干扰,主要表现为基质增强和基质抑制[25-27]。微生物转化肉桂醛体系中的10 种物质均为带苯环的芳香族化合物,几乎不溶于水,易溶于乙醇等有机溶剂。微生物转化肉桂醛转化液有培养基、底物及转化产物等物质,属于非均向、多组分混合体系。参照“1.3”方法,用培养基溶液代替转化液进行预处理,制备空白基质溶液。分别在纯溶剂和空白基质溶液加入一定量的混合标准储备液,配制浓度相同的两种检测液,同等色谱条件下检测,根据两种检测液色谱响应值考察微生物转化肉桂醛体系的基质效应,计算公式[28-30]如下:

式中:Mi为基质溶液中目标测定物的基质效应;Ami为基质溶液中目标测定物的色谱峰面积;Asi为纯溶剂中目标测定物的色谱峰面积。当|Mi|≤20%时,可忽略而无需采取补偿措施;20%≤|Mi|≤50%为中等基质效应;|Mi|>50%为强基质效应,需采取措施补偿基质效应。微生物转化肉桂醛体系中各组分的基质效应见表1。

表1 微生物转化肉桂醛体系中各组分的基质效应Table 1 Matrix effect of components in microbial transformation of cinnamaldehyde system
由表1 可知,苯乙醇、肉桂醇、肉桂醛和肉桂酸基质效应小于20%;苯甲醛、苯甲酸基质效应大于50%,其他组分均为中等基质效应。采用基质匹配标准溶液作标准曲线可抵消基质效应对测定的影响,所以本试验采用无水乙醇/基质溶液来配制混合标准工作液制作标准曲线。
2.3.2 线性范围与检出限
在质量浓度为2.00 mg/L~318.60 mg/L 的10 种标准物质的混合标准工作液,在优化的条件下进行检测,以各目标测定物的峰面积(y)为纵坐标,标准溶液质量浓度为横坐标(x,mg/L),外标法定量,得到各目标测定物的线性回归方程、相关系数、线性范围及检出限。以信噪比(S/N)=3 计算仪器检出限(LOD,mg/L),各数据见列表2。
2.3.3 加标回收率试验与精密度试验
取已知含量的样品溶液,加入低、中、高3 组浓度梯度的标准品溶液,每组试验在优化条件下平行测6 次,计算回收率和相对标准偏差,结果见表3。

表2 10 种香精香料的线性回归方程、相关系数及检出限Table 2 Linear relationship,correlation coefficient and limit of detection of ten flavors

表3 10 种香精香料的加标回收率和相对标准偏差(n=6)Table 3 Recovery rate and relative standard deviation of ten flavors(n=6)

续表3 10 种香精香料的加标回收率和相对标准偏差(n=6)Continue table 3 Recovery rate and relative standard deviation of ten flavors(n=6)
结果表明,微生物转化肉桂醛体系中各目标化合物的回收率为92.13 %~102.90 %,RSD 为0.62 %~4.01%。说明该方法准确度高,精密度好,满足微生物转化肉桂醛体系中各目标化合物的测定要求。
2.4 样品的测定
随机选取5 组不同批次的转化液,按“1.3”中方法处理,在优化的色谱条件下进行测定,观察各物质峰型、保留时间,计算相对平均偏差(n=5)。测定结果表明,不同批次转化液中各物质峰型对称,无叠峰、拖尾现象,保留时间基本一致,RSD 均小于5%,说明该分析方法对肉桂醛生物转化体系中各物质具有良好的定性定量效果。
2.5 方法的应用
为了验证方法的实用性,用从肉桂新鲜枝叶中筛选分离得到的内生菌来转化肉桂醛,转化液用该分析方法进行高效液相色谱分析,筛选出若干能高效转化肉桂醛为肉桂醇的菌株,其转化液色谱图如图4。

图4 转化液HPLC 色谱图Fig.4 HPLC chromatogram of a conversion solution
底物肉桂醛峰消失,新出现的峰比照10 组分混标样谱图为肉桂醇物质峰。峰型对称,保留时间稳定,表明该分析方法适用于生物转化肉桂醛体系中产物的定性定量。
3 结论
本文建立一种同时测定肉桂醛生物转化体系中10 种香精香料的高效液相色谱分析方法。10 种物质在20 min 内全部出峰,且峰型良好,各目标测定物在2.00 mg/L~318.60 mg/L 范围内线性关系良好(0.998 7≤R2≤0.999 6),方法检出限(LOD,S/N=3)为 0.36 mg/L~1.16 mg/L,在低、中、高3 个加标水平下的平均回收率为92.13 %~102.90 %,RSD 为0.62 %~4.01 %。该方法具有方便快速、灵敏度高、准确性高的特点,满足肉桂醛生物转化体系中的成分测定要求,特别适用于以肉桂醛为底物生物合成各种香精香料的筛菌工作。

