襄麦冬黄酮提取及其体外活性研究
申梦娜,陈哲,杨润,李佳佳,石桂芳,宋凯,吕虎晋,余海忠,王海燕
(湖北文理学院食品科学技术学院·化学工程学院鄂西北传统发酵食品研究所,湖北襄阳441053)
麦冬为百合科沿阶草属多年生常绿草本植物,其根比一般植物的根要粗大一些,根的形状为中间肥大而两端细小,通常说的麦冬是指麦冬较粗的块根部位。麦冬中含有许多活性成分,如黄酮、多糖和皂苷等,具有降低血糖[1-2]、血脂[3]水平、延缓衰老[4]、延长生命[5]、防止中性粒细胞呼吸发生暴发、保护心脑血管[6]、改善记忆障碍[7]、提高小鼠的免疫能力、抗氧化[8-9]等作用。襄麦冬即湖北麦冬,为百合科山麦冬属植物,主要产地为湖北襄阳市欧庙镇,是襄阳特有的品种。本课题组前期对襄麦冬多糖的提取工艺[10]及其体外抗氧化活性、襄麦冬皂苷的抑菌活性[11]、襄麦冬黄酮的抑菌(大肠杆菌和邦戈尔沙门氏菌)活性[12]进行了研究。本文采用索氏提取器提取襄麦冬黄酮,然后对其抗氧化活性,包括还原力、羟自由基清除率、超氧阴离子自由基清除率、DPPH 自由基清除率进行研究,同时采用滤纸片法和二倍稀释质量法测量金黄色葡萄球菌和枯草芽孢杆菌抑菌圈的大小和最低抑菌浓度,对襄麦冬黄酮的抑菌活性进行研究,以期为襄麦冬黄酮的保健价值及医用价值的开发提供理论支持。
1 材料与设备
1.1 材料与试剂
襄麦冬:采自襄阳市欧庙镇;金黄色葡萄球菌:湖北文理学院食品科学技术学院·化学工程学院孙永林老师惠赠;枯草芽孢杆菌:上海鲁微有限公司。
芦丁:上海展云化工有限公司;维生素C:国药集团化学试剂有限公司;铁氰化钾:洛阳市化学试剂厂;硫酸亚铁、过氧化氢:西陇化工股份有限公司;水杨酸:天津北联精细化学品开发有限公司;Tris-HCl:上海展云化工有限公司;邻苯三酚:成都科龙化工试剂厂;DPPH:上海源叶生物有限公司。以上试剂均为分析纯。
1.2 试验设备
LD-Y300A 粉碎机:上海顶帅电器有限公司;AL204电子分析天平:梅特勒-托利多仪器(上海)有限公司;BSXT-02 索氏提取器:上海乔枫实业有限公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;LKH-250OF 生化培养箱:上海一恒科学仪器有限公司;V-1800 型可见分光光度计:上海美谱达仪器有限公司;HH-4 数显恒温水浴锅:江苏荣华仪器制造有限公司。
2 方法
2.1 襄麦冬的预处理
将新鲜的麦冬块根洗净,放入烘箱里50 ℃烘干到可打粉程度,再放入粉碎机中粉碎,将襄麦冬粉过60目筛,收集过筛后的襄麦冬粉末保鲜保存备用。
2.2 襄麦冬黄酮的提取
用分析天平准确称取20 g 的襄麦冬粉末,用纱布将麦冬粉末包好放到索氏提取器中,利用最佳提取条件:80%的乙醇在80 ℃下、麦冬粉末与乙醇的料液比为 1 ∶20(g/mL),回流提取 5 h[13]。提取液回收乙醇,然后将乙醇麦冬黄酮混合液放在旋转蒸发仪中浓缩到合适浓度,收集保存备用。
2.3 襄麦冬黄酮浓度的测定
2.3.1 襄麦冬黄酮的标准曲线
参照文献[14]方法,以溶液的吸光度为纵坐标,芦丁标准液质量浓度为横坐标,绘制标准曲线。
2.3.2 襄麦冬黄酮浓度的测定
吸取1 mL 的襄麦冬总黄酮提取液于10 mL 容量瓶中,加入0.3 mL 的质量分数5%亚硝酸钠溶液,混匀后静置6 min,加入0.3 mL 的10%硝酸铝溶液,混匀后静置6 min,加入4 mL 的4%氢氧化钠溶液,用去离子水定容到10 mL,混匀后静置15 min[15]。用紫外分光光度计在510 nm 波长处测定襄麦冬总黄酮提取液的吸光值。
2.4 襄麦冬还原力的测定
2.4.1 普鲁士蓝法测定襄麦冬黄酮的还原力
用无水乙醇将襄麦冬总黄酮提取液和维生素C的醇溶液稀释10 倍,用移液枪分别吸取稀释后的待测液 0.1、0.2、0.3、0.4、0.5 mL 于 10 mL 的棕色容量瓶中,加入10 mg/mL 的铁氰化钾溶液1.0mL,pH=6.5 的磷酸盐缓冲溶液1.0 mL,混匀后置于50 ℃水浴加热20 min,加入100 mg/mL 的三氯乙酸溶液1.0 mL,混匀后静置10 min,加入1 mg/mL 的三氯化铁溶液1.0 mL,加入去离子水1.0 mL,用无水乙醇定容至10 mL,静置10 min,用紫外分光光度计在波长700 nm 处测定溶液的吸光度[16]。重复测量3 次,取平均值。
2.4.2 水杨酸法测定襄麦冬黄酮对羟自由基的清除率
取6 支试管,分别编号1~6,用移液枪向6 支试管中各加入2.0 mL 2.0 mmol/L 硫酸亚铁溶液和2.0 mL 1.0 mmol/L 的过氧化氢溶液,混合均匀,各加入6.0 mmol/L 水杨酸3.0 mL,置于37 ℃水浴加热15 min后取1 号试管溶液在510 nm 波长处测定其吸光度A0。2~6 号试管中分别加入待测样品 0.2、0.4、0.6、0.8、1.0 mL,离子水 0.8、0.6、0.4、0.2、0.0 mL,混匀后 37 ℃水浴继续加热15 min 后分别测定溶液的吸光值Ax[17]。按照上述试验步骤,用2.0 mL 的去离子水取代过氧化氢溶液作空白对照组试验,测其溶液吸光度Ax0。按照以上步骤重复测量3 次,取平均值。羟自由基清除率计算公式为:
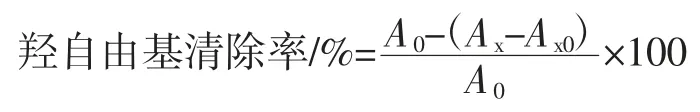
2.4.3 邻苯三酚测超氧阴离子自由基清除率
取 5 支 10 mL 离心管别编号 1~5,加入pH=8.2 的50 mmol/L 的Tris-HC1 缓冲液4.5 mL,以及待测样品0.2、0.4、0.6、0.8、1.0 mL,然后依次向 1~5 试管中加入去离子水 0.8、0.6、0.4、0.2 、0.0 mL,混匀,25 ℃保温20 min,取出后立即向试管中加入在25 ℃水中温育过的3 mmol/L 的邻苯三酚溶液0.3 mL(邻苯三酚溶液用10 mmol/L 的HCL 溶液配制)。混合均匀后立即用分光光度计在波长325 nm 处测定溶液的吸光度。取出后再次摇匀静置4 min 后再次在波长325 nm 处测其吸光值[18]。计算4 min 内溶液吸光值的增加值ΔAX。与此类似,以1 mL 蒸馏水取代1 mL 的待测样品与去离子水体积,测得4 min 内溶液吸光度的增加值ΔA0。

2.4.4 襄麦冬黄酮对DPPH 自由基的清除率的测定
取5 个10 mL 的容量瓶,用移液枪吸稀释后的待测样品液 0.2、0.4、0.6、0.8、1.0 mL 于容量瓶中,用无水乙醇将样品液稀释至刻度线,向10 mL 的比色管中加入DPPH 溶液2 mL,然后再向比色管中加入各浓度待测样品液2 mL,混匀后25 ℃避光静置30 min,在波长517 nm 处用分光光度计测量溶液的吸光值Ai;用2 mL的无水乙醇代替待测样品液与2 mL 的DPPH 溶液混合均匀静置30 min 后,在波长517 nm 处用分光光度计测量溶液的吸光值A0;用2 mL 无水乙醇代替DPPH溶液与2 mL 的各浓度待测样品液混合均匀静置30 min 后,在波长517 nm 处用分光光度计测量溶液的吸光值Aj[19]。每一组吸光值按上述步骤平行测定3次,取其平均值。清除率按公式计算为:
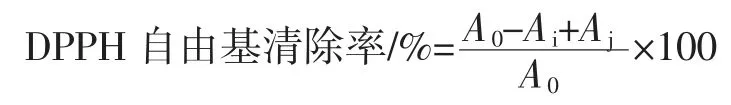
2.4.5 含菌平板的制备
将培养基、1 mL 枪头、培养皿、试管和生理盐水放入高压蒸汽灭菌锅中,温度设置为121 ℃,时间设定为24 min,待灭菌结束后,将所有灭菌好的物品放入烘箱中备用。然后将所用菌种用划线法接于培养基中,放入生化培养箱内37 ℃培养24 h。然后将已灭菌的9 支试管放入试管架中,分别将9 支试管进行编号1~9,将1 号试管中加入10 mL 的生理盐水,其他8 支试管中加入9mL 生理盐水,然后用接种环挑起所用菌种的一个菌落,将其加入1 号试管中,并将其设定为菌悬液的初始浓度,以1 号为起始点采用十倍系列稀释得到 2 号~9 号菌悬液。选择 1、2、3 号试管菌悬液制作含菌平板。
2.4.6 襄麦冬黄酮抑菌试验
将干燥的直径为10 mm 滤纸片分别放入不同浓度的黄酮提取液中放置2 h,取出晾干后放入超净工作台中,用紫外光照射10 min~15 min,贴在含菌培养基上,37 ℃培养24 h,用游标卡尺测量没有长菌圆圈的直径[12,20-21]即得抑菌圈大小。
取4 支试管分别编号为1~4,将已提取出的9.3 mg/mL 黄酮提取液采用二倍稀释法稀释成3.5、1.75、0.875 mg/mL 的黄酮提取液。分别向 1~4 号试管中加入浓度为 7.0、3.5、1.75、0.875 mg/mL 的黄酮提取液1 mL。吸取1 mL 的液体培养基于1~4 号试管中,加入1 号菌悬液0.1 mL,37 ℃培养24 h。从培养好的1~4 号试管中吸取0.3 mL 于平板中,然后用涂布勾将加入的液体涂满培养基表面,37 ℃培养24 h,观察培养基表面是否有菌落生长,比较菌落数量的多少[22-24],确定最低抑菌浓度。
2.5 数据处理
采用Origin 8 作图;采用SPSS16.0 对数据进行统计分析。
3 试验结果
3.1 黄酮提取液浓度测定结果
芦丁标准曲线图如图1 所示。
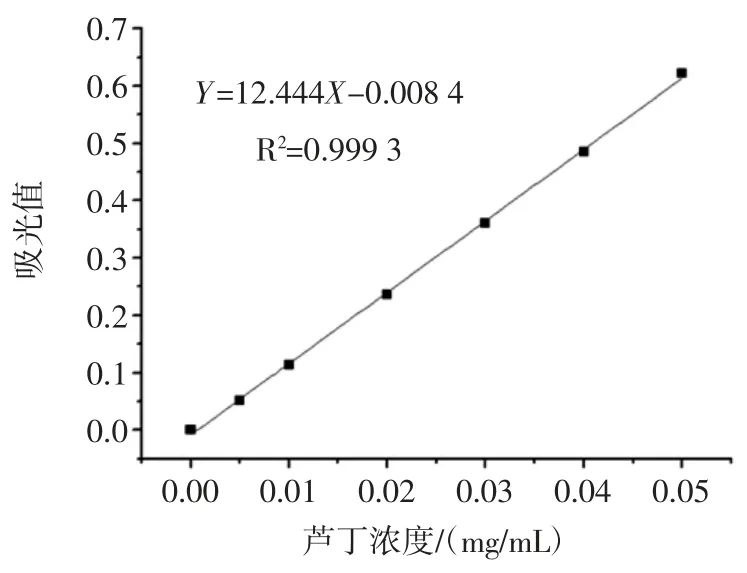
图1 芦丁标准液的标准曲线Fig.1 Standard curve of rutin standard liquid
标准曲线方程为Y=12.444X-0.008 4,R2=0.999 3>0.999,证明芦丁标准液在所测范围内线性关系良好。将所测出的襄麦冬黄酮溶液的吸光值代入标准曲线方程得出襄麦冬黄酮浓度。
3.2 还原力的测定结果
襄麦冬黄酮和维生素C 的还原力测定结果如图2所示。
由图2 可知,通过吸光度比较还原力的大小,随着总麦冬黄酮和维生素C 量的增加还原力逐渐增强。通过拟合曲线方程得出吸光度取值一半时,麦冬黄酮的IC50=2.038 μg/mL;维生素 C 的 IC50=1.868 1 μg/mL。得出还原力大小:维生素C 还原力>麦冬黄酮还原力。
3.3 羟自由基清除率测定结果
襄麦冬黄酮和维生素C 对羟自由基的清除作用如图3 所示。
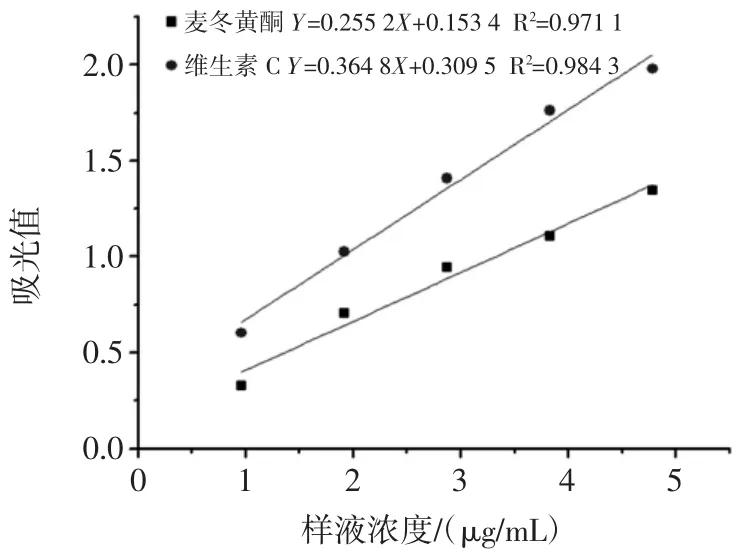
图2 襄麦冬黄酮和维生素C 的还原力Fig.2 The reduction force of flavonoids and vitamin C in the case
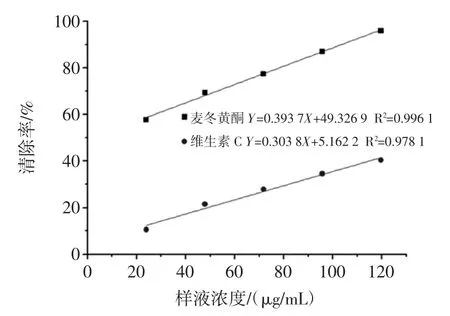
图3 襄麦冬黄酮和维生素C 对羟自由基清除率Fig.3 The hydroxyl radical clearance rate of the flavonoids and vitamin C
由图3 可知,随着总麦冬黄酮和维生素C 量的增加,羟自由基清除率逐渐增强。通过拟合曲线方程得出麦冬黄酮的IC50=1.709 7 μg/mL;维生素C 的IC50=147.589 9 μg/mL。得出羟自由基清除率大小:襄麦冬黄酮羟自由基清除率>维生素C 羟自由基清除率。
3.4 超氧阴离子自由基清除率测定结果
襄麦冬黄酮和维生素C 对超氧阴离子自由基的清除作用如图4 所示。
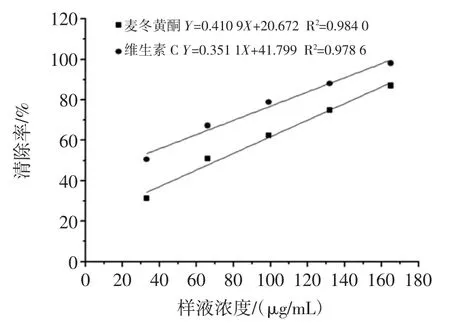
图4 襄麦冬黄酮和维生素C 对超氧阴离子自由基清除率Fig.4 The removal rate of superoxide anion free radical by flavonoids and vitamin C
由图4 可知,随着总麦冬黄酮和维生素C 量的增加,超氧阴离子自由基清除率逐渐增强。通过拟合曲线方程得出麦冬黄酮的IC50=71.375 μg/mL;维生素C的IC50=23.415 μg/mL。得出清除率大小:维生素C 超氧阴离子自由基清除率>襄麦冬黄酮超氧阴离子自由基清除率。
3.5 DPPH自由基清除率测定结果
襄麦冬黄酮和维生素C 对DPPH 自由基的清除作用如图5 所示。
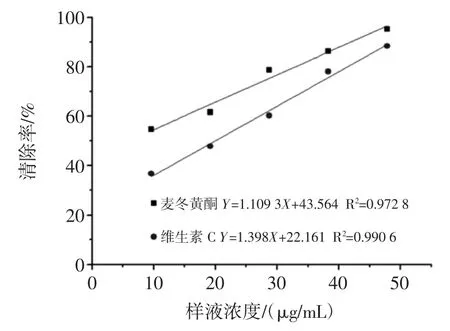
图5 襄麦冬黄酮和维生素C 对DPPH 自由基清除率Fig.5 The DPPH free radical clearance rate of the flavonoids and vitamin C
由图5 可知,随着襄麦冬黄酮和维生素C 量的增加,DPPH 自由基清除率逐渐增强。通过拟合曲线方程得出麦冬黄酮的IC50=5.801 9 μg/mL;维生素C 的IC50=19.913 4 μg/mL。得出DPPH 自由基清除率大小:襄麦冬黄酮对DPPH 自由基清除率>维生素C 对DPPH 自由基清除率。
3.6 襄麦冬黄酮抑菌圈大小测定
索氏提取的黄酮提取液初始浓度为7.0 mg/mL,将7.0 mg/mL 的黄酮提取液稀释成浓度为 6.0、5.0、4.0、3.0、2.0、1.0 mg/mL 的黄酮提取液,采用滤纸片法得到的结果见表1(抑菌直径不明显的未显示)。
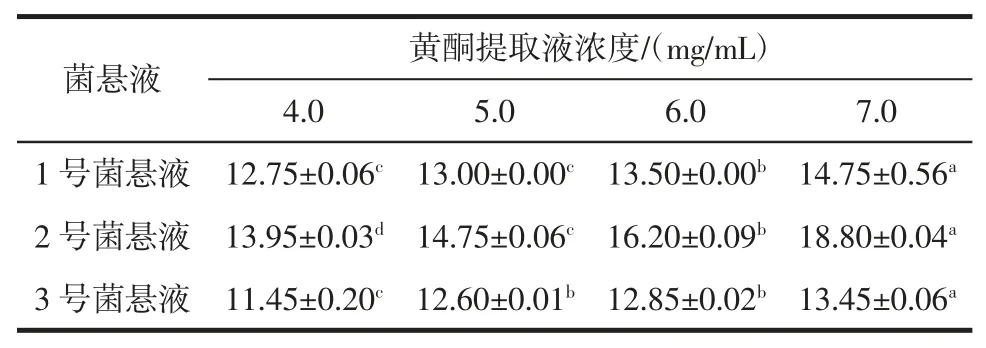
表1 襄麦冬黄酮对金黄色葡萄球菌的抑菌效果Table 1 Antibacterial effect of flavonoid from Liriope spicata on staphylococcus aureus
根据表1 可知,当襄麦冬黄酮提取物在7.0 mg/mL时,对金黄色葡萄球菌的抑制作用很显著,最大抑菌直径可达18.80 mm,随着襄麦冬黄酮提取物的浓度增加,抑菌活性也随之增强。
将浓度为4.0 mg/mL 的黄酮提取液进行梯度稀释得到不同浓度的黄酮溶液,采用滤纸片法得到的结果见表2。
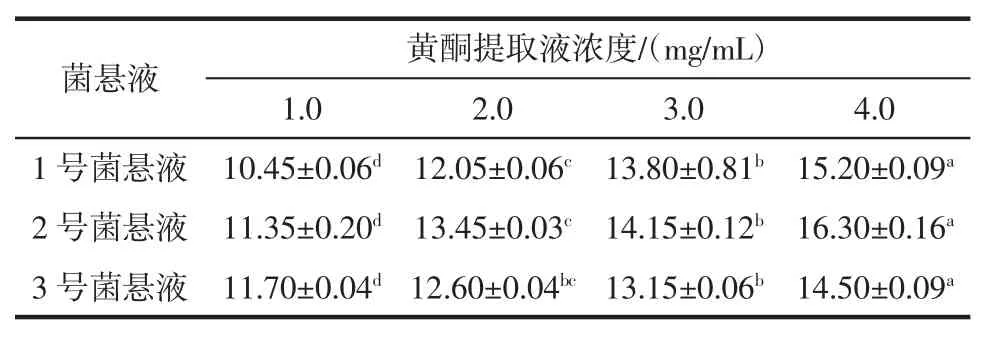
表2 襄麦冬黄酮对枯草芽孢杆菌的抑菌效果Table 2 Antibacterial effect of flavonoid from Liriope spicata on bacillus subtilis
根据表2 可知,当襄麦冬黄酮提取物在4.0 mg/mL和3.0 mg/mL 时,对枯草芽孢杆菌的抑制作用很显著,最大抑菌直径可达16.30 mm,随着襄麦冬黄酮提取物的浓度增加,抑菌活性也随之增强。
3.7 襄麦冬黄酮最低抑菌浓度
在对黄酮提取物的最小抑菌浓度测定是根据将已接好的细菌放入药液中培养24 h 后,接于平板中培养24 后观察细菌在平板中的生长状况,结果见表3。

表3 襄麦冬黄酮的最低抑菌浓度Table 3 The minimum inhibitory concentration of flavonoid from Liriope spicata
由表3 可知,金黄色葡萄球菌在 3.5、1.75、0.875 mg/mL 时,平板中都存在菌落,并且在1.75、0.875 mg/mL 时菌落数较多。但是在7.0 mg/mL 时,平板中无菌落出现。由此可知黄酮提取物对金黄色葡萄球菌的最低抑菌浓度为7.0 mg/mL。同时枯草芽孢杆菌在 3.5、1.75、0.875 mg/mL 时,平板中都存在菌落,并且在1.75、0.875 mg/mL 时菌落数较多。但是在7.0 mg/mL时,平板中无菌落出现。由此可知黄酮提取物对枯草芽孢杆菌的最低抑菌浓度为7.0 mg/mL。
4 结论
本试验通过索氏回流提取法来提取襄麦冬总黄酮,通过与相同浓度的维生素C 溶液的抗氧化性做对比分析,结果发现维生素C 的还原力比襄麦冬总黄酮的强,而襄麦冬总黄酮对羟自由基的清除效果比维生素C 强,当浓度为119.63 μg/mL 时,襄麦冬总黄酮对羟自由基的清除率可高达96.10%,表现出优良的羟自由基清除性能。维生素C 对超氧阴离子自由基的清除能力大于襄麦冬总黄酮,在浓度为33 μg/mL~165 μg/mL 范围内,维生素C 和总黄酮提取液的还原力都随着浓度的增加而增加。襄麦冬总黄酮对DPPH 自由基的清除能力比维生素C 强,当浓度为47.85 μg/mL时,襄麦冬总黄酮对DPPH 自由基的清除率可高达95.39%。在抑菌活性研究中发现,襄麦冬黄酮对枯草芽孢杆菌的抑菌作用比金黄色葡萄球菌敏感,而对金黄色葡萄球菌和枯草芽孢杆菌的最小抑菌浓度均为7 mg/mL。综上所述,襄麦冬黄酮具有一定的抗氧化活性以及抑菌活性,可为襄麦冬活性成分进一步开发利用提供重要参考。

