苦瓜枯萎病原菌的绿色荧光蛋白基因标记
陈燕萍 刘欣 肖荣凤 朱育菁 林永胜 刘波

摘要:【目的】苦瓜枯萎病是由尖孢镰刀菌苦瓜专化型(Fusarium oxysporum f.sp.momodicae)侵染引起的一种重要土传病害。为有效防控该病害,对其病原菌进行绿色荧光蛋白基凶(gfp)标记,为研究病原菌在苦瓜植株体内的侵染特性提供可视化跟踪检测手段。【方法】采用农杆菌介导的遗传转化方法对苦瓜枯萎病原菌强致病性野生型菌株FJAT-3018进行绿色荧光蛋白基凶(gfp)标记,通过对转化子的菌落形态观察、生长速率和致病性测定,筛选出遗传稳定的转化子。【结果】野生型菌株FJAT-3018的转化效率约为14.5个转化子/106个孢子。经10次继代培养,筛选获得的转化子在菌落形态、生长速率和致病性方面与野生型菌株FJAT-3018无明显差异,gfp基凶在转化子的菌丝体和分生孢子中均能强表达;通过激光共聚焦显微镜扫描跟踪发现,转化子能够在苦瓜植株根部和茎部侵染与定殖。【结论】绿色荧光蛋白基因已成功转入到苦瓜野生型菌株FJAT-3018中,其转化子具有良好的遗传稳定性且致病力不受影响。
关键词:苦瓜;枯萎病;绿色荧光蛋白;基因标记
中图分类号:S436.8
文献标志码:A
文章编号:1008-0384(2020)11-1228-06
0引言
【研究意义】苦瓜枯萎病是由尖孢镰刀菌苦瓜专化型(Fusarium oxysporum f.sp.Momodicae)侵染引起的一种毁灭性土传病害,该病害在苦瓜整个生育期均可发生,并导致植株萎蔫死亡,造成产量损失,严重制约了苦瓜产业的发展[1-2]。为有效防控该病害,亟需了解该病原菌对苦瓜的侵染特性。因此,建立一种可视化的跟踪标记手段,有助于深入研究该病原菌的侵染过程和指导该病害防控。【前人研究进展】绿色荧光蛋白标记基因(gfp)可为研究病原菌在植株体内的侵染蔓延提供可视化跟踪技术[3]。它具有荧光性质稳定、直观、操作方便和不需要添加外源底物就可以在活细胞中直接检测等优点,已被广泛应用于真菌分子生物学研究[4-5]。适用于镰刀菌属真菌的gfp基因转化方法有多种,如PEG介导法、农杆菌介导法和基因枪介导法等[6-8]。其中农杆菌介导的转化方法是直接以真菌孢子或菌丝为受体,较PEG介导法和基因枪介导法的操作更简单,可减少转化过程中其他因素的影响,且转化效率和遗传稳定性也更高[9]。【本研究切入点】目前,国内外学者已利用gfp基因成功标记了番茄、香蕉、甜瓜和玉米等寄主作物尖孢镰刀菌[10-14],但未见苦瓜枯萎病原菌的gfp基因标记的研究报道。【拟解决的关键问题】为有效防控该病害,采用农杆菌介导的遗传转化方法对苦瓜枯萎病原菌强致病性野生型菌株FJAT-3018进行绿色荧光蛋白基因(gfp)标记,并比较转化前后菌株的菌落形态、生长速率和致病性差异,筛选m遗传稳定标记的转化子,有助于通过可视化跟踪观察深入研究该病原菌的侵染过程和指导该病害防控。
1材料与方法
1.1试验材料
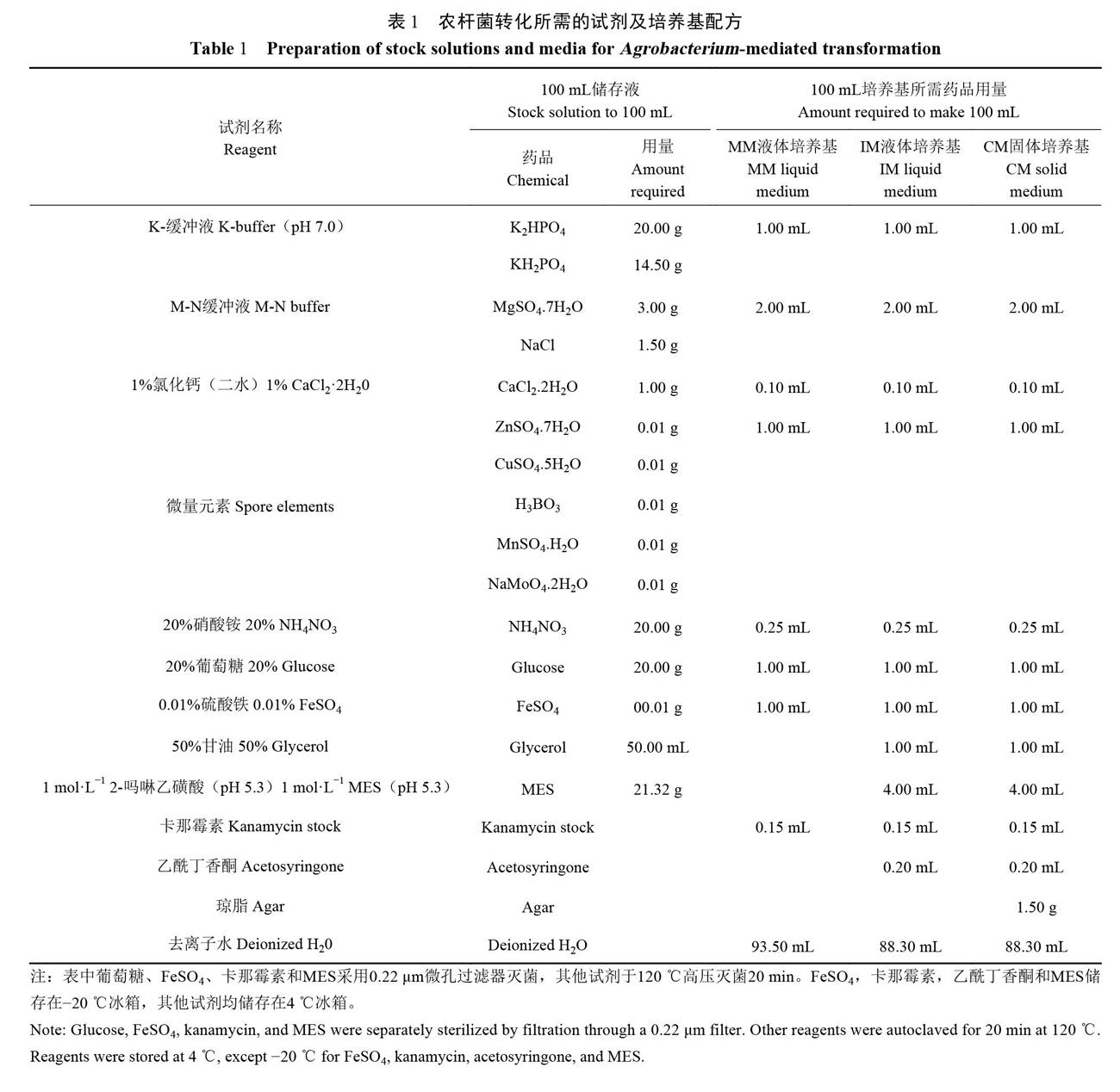
苦瓜枯萎病原菌强致病菌株FJAT-3018属于尖孢镰刀菌苦瓜专化型(Fusarium oxysporum f.sp.Momodicae),由本研究室保存;供试苦瓜感病品种(新翠)植株购自厦门如意种苗高科技股份有限公司;农杆菌AGL-1菌株由中国农业大学惠赠,载体pCAMBIA1300-ptrpC-hph-gfp由福建省农业科学院作物研究所提供;潮霉素B、卡那霉素、特美汀等抗生素均购白美国Sigma公司;PDB培养基(200g马铃薯,15g葡萄糖,加水定容至1000 mL);PDA固体培养基(200g马铃薯,15g葡萄糖,15g琼脂粉,加水定容至1000mL),筛选培养基(含终浓度为100μg·mL-1潮霉素B和200μg·mL-1特美汀的PDA固体培养基);农杆菌介导转化所需的试剂及3种培养基配方(基础培养基、诱导培养基和共培养培养基)参考文献[15],具体配方见表1。混合纤维微孔滤膜(購白上海生工).0.22μm微孔过滤器(Millipore)。
1.2苦瓜枯萎病菌的绿色荧光蛋白基因转化
采用农杆菌介导法进行苦瓜枯萎病菌的gfp基因转化,转化方法参照文献[15],略做改动。具体步骤如下:(1)苦瓜枯萎病原菌菌株FJAT-3018于含200μg·mL-1硫酸链霉素的PDA固体培养基纯化培养7d,在培养皿中加入适量无菌水,用无菌涂布棒刮洗菌落表面洗出分生孢子,孢子悬浮液用双层无菌擦镜纸过滤,并用诱导培养基调整分生孢子浓度为1×106个·mL-1备用。(2)将已转入pCAMBIA1300-ptrpC-hph-gfp载体的农杆菌AGL-1用基础培养基(MM培养基)于28℃、250r·min-1摇床培养48h,后用诱导培养基(IM培养基)调整菌液浓度为OD600=0.15,继续摇床培养约6h至菌液OD600约为0.60。(3)将灭菌的混合纤维微孔滤膜放置在共培养培养基(CM培养基)上,并取已制备好的FJAT-3018孢子悬浮液和农杆菌液各100μL混匀后于混合纤维微孔滤膜上均匀涂布,10个重复,并于25℃暗培养48h。(4)共培养48h后,将混合纤维微孔滤膜用无菌刀片划成小块分散摆放到筛选培养基(含终浓度为150μg·mL-1潮霉素B和200μg·mL-1特美汀的PDA培养基)上,于28℃暗培养72h。(5)筛选培养基平板放置在BD-BGC1蓝光切胶仪中,挑取发出明亮绿色荧光菌落边缘的菌丝体于筛选培养基上复筛,继续用蓝光切胶仪挑选出发出明亮绿色荧光的平板,并通过单孢分离法获得相对应转化子。
1.3转化子的遗传稳定性检测
单孢分离纯化获得的强绿色荧光表达的不同转化子在PDA培养基上,28℃培养6d后,选取菌落边缘菌丝转接到新的PDA培养基上继续培养,重复以上方法连续培养10代,观察各转化子的菌落形态变化,测量菌落生长速度,以野生型菌株FJAT-3018为对照。挑取荧光强且遗传稳定的转化子于-80℃甘油冷冻保存,同时挑取代表性转化子的菌丝体制成玻片,置于荧光显微镜下观察菌丝和孢子的荧光强度。
1.4转化子对苦瓜植株的致病性测定
选取2株代表性转化子和野生型菌株FJAT-3018分别于PDB培养基中培养7d,双层纱布过滤后分别调整孢子悬浮液浓度为106个·mL-1备用。取株高为10~15cm的苦瓜实生苗用栽培基质种植于盆钵中,7d后用转化子孢子悬浮液伤根浇灌接种,每株浇灌50mL,以野生型菌株FJAT-3018和清水处理为对照,每处理组分别接种30株苦瓜苗,于(28±2)℃的培养箱中培养。逐日观察苦瓜苗的发病情况,通过发病速度和发病率比较转化子与野生型菌株的致病力差异。苦瓜苗2片及以上叶片表现萎蔫症状即计为发病株,发病率=(各处理组发病株数/总株数)×100%。同时,在接种后7d和14d拔取发病植株分段切片检测,植株从盆钵中拔出后用流水将根及茎部表皮杂质冲洗干净,采用徒手切片法,切取根部及茎部组织薄片,放置于载玻片上,利用激光共聚焦显微镜(Leica SP8)于波长500~525nm下观察病原菌在植株根部与茎部的侵染情况。
2结果与分析
2.1苦瓜枯萎病菌的绿色荧光蛋白基因转化
利用农杆菌介导法进行菌株FJAT-3018的gfp基因转化,结果表明,共培养后的10张混合纤维微孔滤膜在筛选培养基上共长出145个发绿色荧光的菌落,遗传转化效率约为14.5个转化子/106个孢子。发光菌落复筛后,经单孢分离和荧光强度检测挑取15个绿色荧光基因强表达的转化子(编号为FJAT-31284~FJAT-31298)进行保存。
2.2转化子的遗传稳定性检测
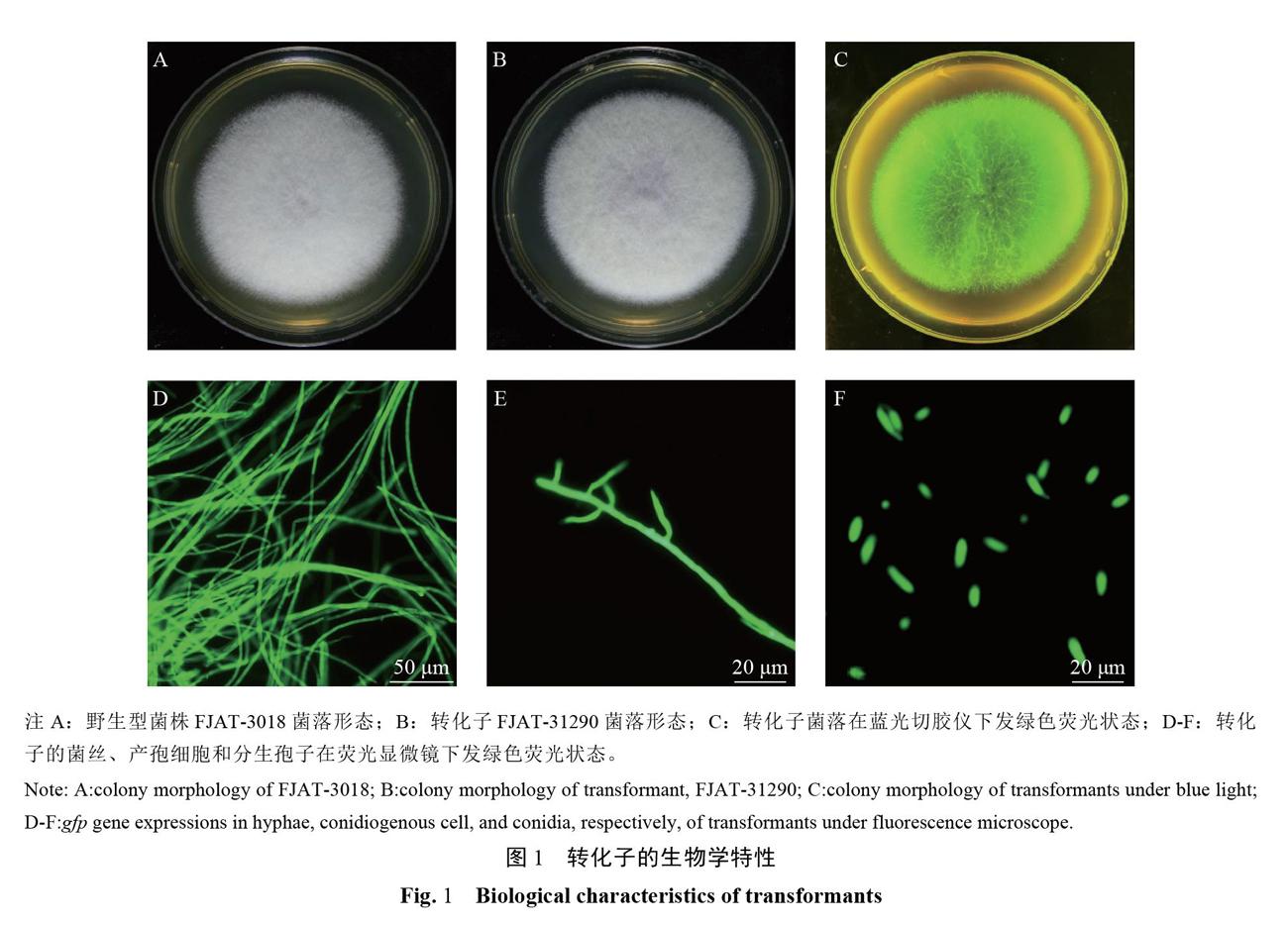
15个转化子在无潮霉素选择压力的PDA培养基上分别继代培养10次后,菌落形态、色泽与野生型较一致(图1-A、B)。各转化子在蓝光切胶仪中菌落呈现明亮的绿色(图1-C)。转化子的菌丝、产孢器和分生孢子在显微镜下与野生型菌株一致,且在荧光显微镜下发出明亮的绿色荧光(图1-D~F)。培养7d时的平均生长速率为(6.6±0.6)cm,与野生型菌株FJAT-3018的生长速率(6.5±0.5)cm差异不显著。通过菌落形态、生长速率和绿色荧光检测,说明gfp基因已成功转入到菌株FJAT-3018中,且各转化子具有良好的遗传稳定性。
2.3转化子对苦瓜植株的致病性测定
接种野生菌株FJAT-3018和转化子FJAT-31284、FJAT-31290的苦瓜植株,在接种约7d时,不同处理的植株叶片均开始出现轻微萎蔫症状;接种10d左右,植株大部分叶片出现萎蔫症状;接种14d后,植株完全萎蔫死亡;但清水处理的植株无萎蔫症状,正常生长(图2)。发病率统计结果表明,接种野生菌株FJAT-3018和转化子FJAT-31284、FJAT-31290的植株发病率均为100%,清水对照发病率为0。重新分离接种病原菌FJAT-3018和转化子FJAT-31284、FJAT-31290的回接发病植株,均获得与接种时相同的病原物;清水对照未分离到培养物。进一步利用激光共聚焦显微镜观察转化子FJAT-31284和FJAT-31290在苦瓜植株體内的侵染情况,结果表明,接种两个转化子7d时,植株的少许根部出现褐变,此时均可观察到呈现绿色荧光的菌丝体在根部组织细胞间隙侵染蔓延,但在茎部组织尚未检测到绿色荧光的菌丝体(图3-A、B);接种转化子14d时,大部分根部组织褐变,距离茎基部1-2cm处的茎组织切片后,均可观察到大量呈现绿色荧光的菌丝体在茎部组织细胞间隙侵染蔓延(图3-C、D)。通过致病力测定和侵染观察,说明供试的2个转化子对苦瓜植株的致病力与野生型菌株较一致,且两个转化子均能在植株体内侵染蔓延并呈现明亮的绿色荧光。
3讨论与结论
采用农杆菌介导的绿色荧光蛋白基因转化已在淡紫拟青霉Paecilomvces lilacinus、小麦赤霉菌F.graminearum和稻瘟病菌Magnaporthe grisea等多种作物真菌上应用[14,16-17]。但农杆菌转化的效率会受到多种因素的影响,如农杆菌菌株类型、转化受体菌株类型、乙酰丁香酮浓度等因素[18]。任俊杰等[19]转化西瓜枯萎病菌的效率为1177个转化子/106个孢子;刘朋娟等[20]转化稻瘟病菌的效率为约300个转化子/106个孢子;本研究转化苦瓜枯萎病菌的效率约为14.5个转化子/106个孢子。虽然本研究的转化效率略低,但是所获得转化子在菌落形态、生长速率和致病力等方面与野生型菌株FJAT-3018相比无明显差异,且均能稳定表达绿色荧光蛋白基因,该结果与姚锦爱等[17]、任俊杰等[19]和郭强等[21]的研究结果一致。绿色荧光蛋白基因标记是研究病原菌与寄主植物互作的良好可视化工具[3]。Zvirin等[22]和李春强等[23]分别利用gfp基因标记的甜瓜尖孢镰刀菌和西瓜尖孢镰刀菌菌株,研究了病原菌在寄主植株的侵染定殖,结果表明在激光共聚焦显微镜下,能清晰地观察到发荧光的病原菌菌丝体在植株体内侵染蔓延。本研究也利用激光共聚焦显微镜观察了2个转化子FJAT-31284和FJAT-31290在苦瓜植株体内的侵染定殖,也表明转化后的菌株均能在植株体内侵染蔓延且稳定表达。绿色荧光蛋白基因已成功转入到苦瓜野生型菌株FJAT-3018中,其转化子具有良好的遗传稳定性且致病力不受影响。后续将利用成功标记gfp基因且遗传性状稳定的转化子进行示踪观察,为研究病原菌在苦瓜植株体内的侵染特性提供可视化跟踪检测手段。
参考文献:
[1]SUN S K,HUANG J w A new Fusarium wilt of bitter gourd inTaiwan[J].Plant Disease,1983,67(2):226-227.
[2]关峰,万新建,张景云,等.苦瓜枯萎病研究进展[J].中国瓜菜,2018. 31(5):1-4.
GUAN F,WAN X J,ZHANG J Y,et al.Research progress onFusarium wilt of bitter gourd[J].China Cucurbits and Vegetables,2018,31(5):1-4.(in Chinese)
[3]SARROCCO S, FALASCHI N, VERGARA M,et al. Use of Fusariumoxysporum f. sp dianthii transformed with marker geneS tO follOwcolonization of camation roots[J]. Journal of Plant Pathology,2007,89(1):47-54.
[4]黄亚丽,潘玮.根癌农杆菌介导丝状真菌遗传转化的研究进展[J].生物技术通报,2007(3):111-114.
HUANG Y L,PAN W. TranSfomatiOn in Filamentous fungi mediatedby Agrobacterium tumefaciens[J].Biotechnology,2007(3):111-114.(inChinese)
[5]徐进,莫明和,张克勤.绿色荧光蛋白(GFP)在真菌研究中的应用[J].生物技术,2004,14(6):74-77.
XU J,MO M H,ZHANG K Q.The application of gene fluorescentprotein(GFP)in Fungi[J].Biotechnology,2004,14(6):74-77.(in Chinese)
[6]肖荣凤,朱育菁,李燕丹,等.西瓜尖孢镰刀菌FOV-135的绿色荧光蛋白基因转化[J].福建农业学报,2009,24(6):521-524.
XIAO R F,ZHU Y J,LI Y D,et al.Green fluoresCent protein genetranSfomatiOn On Fusarium oxysporum f.sp.niveum straiin,FOV-135[J]. Fujian Journal of Agricultural Science,2009,24(6):521-524.(in Chinese)
[7]张鸿,林志坚,林赵淼,等.T-DNA随机插入法获得甘薯蔓割病菌非致病生防菌株[J].中国生物防治学报,2016,32(5):610-618.
ZHANG H, LIN Z J,LIN Z M. et al.Obtaining nonpathogenicbiological control strains against sweetpotato Fusarium wilt byAgrobacterium-mediated transformation [J]. Chinese Journal ofBiological Control,2016,32(5):610-618.(in Chinese)
[8]孙科.基因枪法介导的抗赤霉病防卫基因转化小麦的研究[D].武汉:华中农业大学,2013.
SUN K. Studies on the transformation of wheat with defense genesresistant to FHB by microprojectile bombardment[D]. Wuhan: Huazhong Agricultural University,2013.(in Chinese)
[9]張俊华,刘烨,韩雨桐,等.农杆菌介导稻瘟病菌绿色荧光蛋白(GFP)遗传转化研究[J].东北农业大学学报,2014,45(11):1-7.
ZHANG J H, LIU Y, HAN Y T,et al.GFP genetic transformation ofMagnaporthe grisea mediated by Agrobacterium tumefaciens [J].Journal of Northeast Agricultural University,2014,45(11):1-7.(in Chinese)
[10]NAHALKOVA J, FATEHI J. Red fluorescent protein (DsRed2) as anovel reporter in Fusarium oxysporumf. sp. lycopersici [J]. FEMSMicrobiology Letters,2003,225(2):305-309.
[11]VISSER M.,GORDON T R. WINGFIELD B D. et al. Transformationof Fusarium oxysporum f. sp. cubense causal agent of Fuasrium wiltof banana,with the green fluorescent protein (GFP) gene [J].Australasian Plant Pathology, 2004,33(1):69-75.
[12]张欣.香蕉枯萎病菌遗传多态性及绿色荧光蛋白基因转化的研究[D].儋州:华南热带农业大学,2007.
[13]NONOMURA T, TAJIMA H. KITAGAWA Y. et al.Distinguishablestaining with neutral red for GFP-marked and GFP-nonmarkedFusarium oxysporum strains simultaneously colonizing rootsurfaces [J]. Journal of General Plant Pathology,2003,69(1):45-48.
[14]WU L,CONNER R L,WANG X M, et al. Variation in growth,colonization of maize, and metabolic parameters of GFP-and DsRed-Labeled Fusarium verticillioides strains [J]. Phytopathology, 2016,106(8):890-899.
[15]KHANG C H,PARK S Y. RHO H S,et al.Filamentous fungi(Magnaporthe grisea and Fusarium oxysporum)[M]//AgrobacteriumProtocols Volume 2. Totowa. NJ:Humana Press, 2006:403-420.
[16]张旭,Theo van de Lee,陆维忠,等.小麦赤霉菌绿色荧光蛋白标记突变体的侵染研究[J].中国农业科学,2008,41(10):3077-3082.
ZHANG X,THEO V D L,LU W Z,et al.Infection of Fusariumgraminearum on wheat spikes with green fluorescence protein-taggedrevertants [J]. Scientia Agricultura Sinica,2008,41(10):3077-3082.(in Chinese)
[17]姚锦爱,张鸿,黄鹏,等.建兰茎腐病原菌尖孢镰刀菌F-02的绿色荧光蛋白基因标记[J].福建农业学报,2019,34(1):70-75.
YAO J A,ZHANG H,HUANG P,et al. Green fluorescent proteingenetic marker of Fusarium oxysporum F-02 of stem rot disease onCymbidium ensifolium [J].Fujian Journal of Agricultural Sciences,2019,34(1):70-75.(in Chinese)
[18]张俊华,牟明,常浩,等.根癌农杆菌介导gfp基因转化水稻纹枯病菌及其对病原菌稳定性和致病力的影响[J].东北农业科学,2016,41(6):67-74.
ZHANG J H,MU M,CHANG H,et a1.Agrobacterium Tumefaciens-mediated transformation of gfp gene and its effects on stability andpathogenicity for Rhizoctonia solani[J]. Journal of NortheastAgricultural Aciences,2016,41(6):67-74.(in Chinese)
[19]任俊杰,王丽霞,高洪波,等.农杆菌介导的西瓜枯萎病菌遗传转化[J].植物保护,2015,41(1):93-97.
REN J J,WANG L X,GAO H B,et al. Agrobacterium tumefaciens-mediated transformation of Fusarium oxysporum f.sp niveum[J].Plant Protection,41(1):93-97.(in Chinese)
[20]刘朋娟,王政逸,王秋华,等,农杆菌介导的稻瘟病菌转化及致病缺陷突变体筛选[J].中国水稻科学,2006,20(3):231-237.
LIU P J,WANG Z Y,WANG Q H,et a1.Agrobacterium tume faciens-mediated transformation of Magnaporthe
andidentification of pathogenicity defective mutant[J].Chinese Journalof RICE sCIENCE,2006,20(3):231-237.(in Chinese)
[21]郭强,王鑫,徐世强,等.农杆菌介导甘蔗梢腐病病原菌YN41的遗传转化[J].基因组学与应用生物学,2016, 35(5):1189-1194.
GUO Q,WANG X,XU S Q,et al.Agrobacterium tumefaciens-mediated transformation of sugarcane pokkah boeng pathogenYN41[J]. Genomics and Applied Biology, 2016,35(5):1189-1194. (in Chinese)
[22]ZVIRIN T,HERMAN R,BROTMAN Y,et al. Differentialcolonization and defence responses of resistant and susceptible melonlines infected by Fusarium oxysporum race 1-2[J]. Plant pathology,2010(59):576-585.
[23]李春强,梁慧施,夏亦荠,等.GFP标记的尖孢镰刀菌西瓜专化型侵染西瓜过程观察[J].热带作物学报,2011,32(10):1935-1939.
LI C Q,LIANG H S H,XIAY J, et al.Observation of the infectionprocess of watermelon by Fusarium oxysporum f. sp. niveum using theGFP marker [J]. Chinese Journal of Tropical Crops, 2011,32(10):1935-1939.(in Chinese)
(责任编辑:林海清)
陈燕萍,刘欣,肖荣凤,等.苦瓜枯萎病原菌的绿色荧光蛋白基因标记[J].福建农业学报,2020,35(11):1228-1233.
CHEN Y P,LIU X. XIAO R F,et al. Transformation of Green Fluorescent Protein of Fusarium oxysporum Isolated from Diseased Bitter Gourd [J].Fujian Journal ofAgricultural Sciences,2020,35(11):1228-1233
收稿日期:2020-09-14初稿:2020-10-14修改稿
作者簡介:陈燕萍(1985-),女,硕士,助理研究员,主要从事生物技术及生物防治(E-mail:chenyanping071@sina.com)
*通信作者:刘波(1957-),男,博士,研究员,主要从事微生物生物技术与农业生物药物研究(E-mail:fzliubo@163.com)
基金项目:福建省科技计划公益类专项(2018Rl017-9):福建省农业科学院科技创新团队建设项目(STIT2017-2-8)

