地衣芽胞杆菌α-淀粉酶耐热耐酸突变体的酶学性质
刘雪莲,申培立,牛丹丹,金鹏,田康明,王正祥*
1(天津科技大学 化工与材料学院,天津, 300457)2(天津科技大学 生物工程学院,天津, 300457)
地衣芽胞杆菌α-淀粉酶(Bacilluslicheniformisα-amylase, BLA,EC 3.2.1.1),是我国淀粉液化酶中最具代表性的高温α-淀粉酶,可在高温(105~107℃)下作用于淀粉乳,随机切割淀粉分子内部α-1,4糖苷键生成短链糊精、麦芽寡糖和少量葡萄糖,广泛应用于淀粉糖、酒精、味精、有机酸、医药、纺织和造纸等行业,是研究最早、最重要的工业酶制剂之一,占淀粉酶系市场份额的30%左右[1-3]。
在BLA的研究与开发进程中,我国学者前期重点研究了BLA的编码基因特征、表达方式、酶学性质的分子进化、高效表达与发酵生产工艺技术的优化等[4-6],有力地推动了我国高温α-淀粉酶的工业化生产技术的进步,特别是BLA的工业发酵水平得到显著提升[7]。但是,淀粉液化生产实践要求BLA能够具有更好的耐热性和在酸性条件下更高的活性,如淀粉喷射液化温度能够达到110℃以上,液化能够在pH 5.0或更低的pH值下进行。围绕这一生产实践要求,国内外学者进行了大量的有益研究。其中代表性的研究成果包括:(1)运用定点突变或易错PCR技术,获得BLA的耐酸、耐热或比酶活提高的突变体[8];(2)通过微生物分离与筛选,获得耐酸、耐热或比酶活提高的天然BLA分子[9];(2)通过DNA体外随机重排技术(DNA shuffling)或结构域替换,优化α-淀粉酶的应用酶学属性[10]。
本实验室前期通过DNA体外随机重排技术获得以BLA为基础的高温α-淀粉酶突变体库,在此基础上,本研究从突变体库中遴选出一耐热和耐酸性能显著改善的BLA突变体,并就其酶学性质进行较全面的分析。研究结果将有助于后续高温α-淀粉酶高产新菌种的构建与工业应用。
1 材料与方法
1.1 菌株与质粒
表达BLA突变体的重组大肠杆菌,采用EscherichiacoliJM109为宿主细胞、pHY-WZX为表达质粒[11]进行构建,由本实验室前期构建与保藏。地衣芽胞杆菌(Bacilluslicheniformis)CBBD302用于突变酶的制备,为本实验室前期构建与保藏[7]。
1.2 酶与试剂
高温α-淀粉酶(40 000 U/mL),由地衣芽胞杆菌生产,山东隆科特酶制剂公司;限制性内切酶、蛋白分子质量标准、BSA等,宝生物工程(大连)有限公司;质粒提取试剂盒,Omega Bio-tec;胰蛋白胨、酵母浸粉,英国OXOID公司;硫酸卡那霉素购自,生工生物工程有限公司,可溶性淀粉,国药集团化学试剂有限公司。其他试剂均为国产分析纯。
1.3 培养基
淀粉培养基(g/L):胰蛋白胨10,酵母抽提物5,NaCl 5,可溶性淀粉10,加入2%的琼脂为固体培养基。必要时,培养基中添加终质量浓度50 μg/mL硫酸卡那霉素。
发酵培养基(g/L):乳糖20,棉子粉20,CaCl20.3,(NH4)2SO43,K2HPO420,KH2PO410;pH 7.2。
1.4 遗传转化
大肠杆菌质粒DNA的提取、酶切、转化及转化子筛选等,均采用实验室常规方法[12],使用试剂盒时按照试剂盒说明书进行。地衣芽胞杆菌遗传转化与筛选,按照文献[11]描述的方法进行。
1.5 酶液制备、纯化与鉴定
挑取3~4个单菌落于50 mL液体培养基中,在37℃、220 r/min条件下培养15~16 h至对数生长期,按照10%的接种量转接发酵培养基,在37℃、220 r/min条件下培养5 d,离心收集上清即为粗酶液。将粗酶液经用饱和度为30%~50%(4 ℃)(NH4)2SO4分级沉淀,再经凝胶层析柱Superdex-G75纯化,通过酶活测定和SDS-PAGE方法分析纯化情况,其中SDS-PAGE使用12%分离胶和5%浓缩胶。蛋白浓度测定采用Bradford法进行[13]。
1.6 酶活测定
高温α-淀粉酶的酶活测定,按照GB/T 24401—2009方法进行。酶活单位(U)定义为:1 g固体酶粉(或1 mL液体酶),于70 ℃、pH 6的条件下,1 min液化1 mg可溶性淀粉,即为1个酶活力单位,以U/g(或U/mL)表示[14]。
1.7 酶学性质分析
1.7.1 最适温度及热稳定性
在pH 6.0下,分别测定酶样在50、60、70、80、90和100℃下的酶活,以最高酶活力为100%,计算其他温度下的相对酶活,确定最适反应温度。将酶样分别在75、80、85和90 ℃下热处理60 min,每隔10 min取样,按上述酶活测定方法测定残余酶活,以未经处理的酶样酶活为100%,确定酶的热稳定性。
1.7.2 最适pH及pH稳定性
在最适反应温度下,用pH 4.0~8.0的缓冲液适当稀释酶液,测定对应pH条件下的酶活,以最高酶活为100%,计算其他pH条件下的相对酶活,确定最适反应pH。将酶样加入不同pH(pH 4~8)缓冲液中室温(25℃)放置1 h,然后按上述酶活测定方法测定残余酶活,以未经处理的酶样酶活为100%,确定其pH稳定性。
1.7.3 金属离子及相关化学试剂对酶活的影响
配制不同金属离子溶液(Na+、K+、Li+、Ni+、Mg2+、Ca2+、Mn2+、Ba2+、Co2+、Fe2+、Zn2+、Cu2+、Fe3+、Al3+、Sr2+)和化学试剂(EDTA、SDS),将酶液与金属离子溶液和化学试剂等体积混合,使酶液中各金属离子浓度为1、5 mmol/L;4 ℃放置过夜(16 h)后,按上述酶活测定方法测定样本酶活,以添加等体积缓冲液的酶样酶活为100%,确定不同金属离子及化学试剂对酶活的影响。
1.8 酶动力学参数测定
分别以6、8、12、14、16、20 g/L的淀粉溶液为底物,按照GB/T 24401—2009方法,在最适反应条件下测定酶活,采用双倒数法作图(Lineweaver-Burk法)并进行酶反应动力学参数计算。
2 结果与分析
2.1 高温α-淀粉酶V-2的制备与纯化
对BLA为基础的高温α-淀粉酶突变库进行筛选,获得在高温酸性条件下酶活较高的突变体V-2;进一步纯化对应菌株中的质粒DNA,转化入地衣芽胞杆菌,获得转化子H-311(数据未呈现)。经摇瓶发酵120 h,离心收集上清酶液,再经(NH4)2SO4分级盐析和凝胶过滤色谱进行纯化,结果如图1所示。纯化后的突变体V-2的比酶活为1 630 U/mg,在SDS-PAGE上呈现为单条蛋白条带,分子质量约为56 ku,达到后续酶学性质分析要求的纯度。就比酶活而言,突变体V-2较BLA提高约0.6倍[7]。
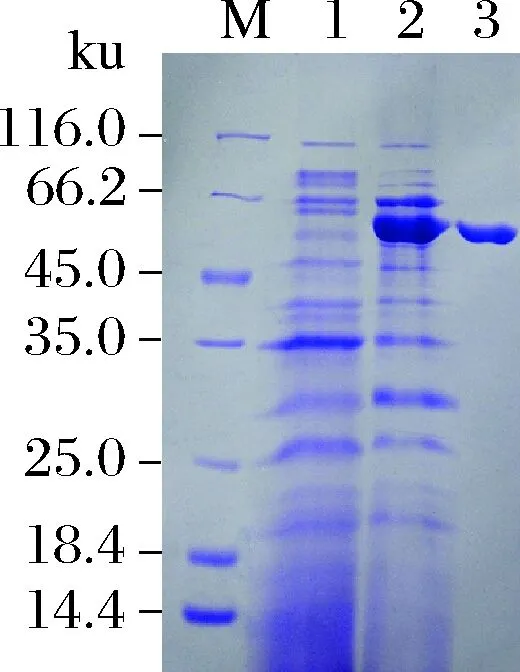
M-蛋白质标准样品;1-对照;2-粗酶液;3-纯化后的V-2
2.2 高温α-淀粉酶V-2的酶学性质
2.2.1 最适作用温度
在pH 6.0的条件下,测定50~100℃高温α-淀粉酶V-2的酶活,得到温度对酶活力影响曲线,如图2所示。突变体V-2的最适作用温度为80℃,较BLA提高了10℃;当反应温度由80℃上升到90℃时,BLA酶活力大幅降低,而在同样条件下突变体V-2仍表现出近71%的最高酶活;在煮沸(100 ℃)条件下,突变体V-2仍具有30%以上的酶活力,而BLA仅存17%的酶活力。可见,相较于BLA,突变体V-2可以在更高的温度范围内有效水解淀粉分子。
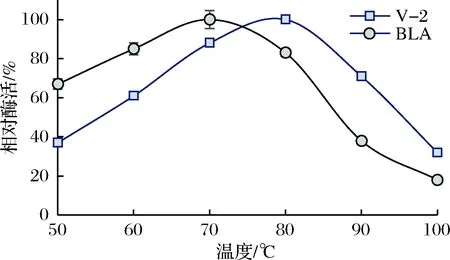
图2 温度对突变体V-2酶活力的影响
2.2.2 最适作用pH
在最适温度下测定在pH 4.0~8.0高温α-淀粉酶V-2酶活,获得了不同pH对酶活力的影响曲线(图3)。可知,突变体V-2的最适作用pH为pH 5.5,较BLA的最适作用pH降低了0.5~1.0个pH值;突变体V-2在pH 6.5及以上的酶活则明显低于BLA。可见,突变体V-2更适合在酸性条件下发挥淀粉液化作用。
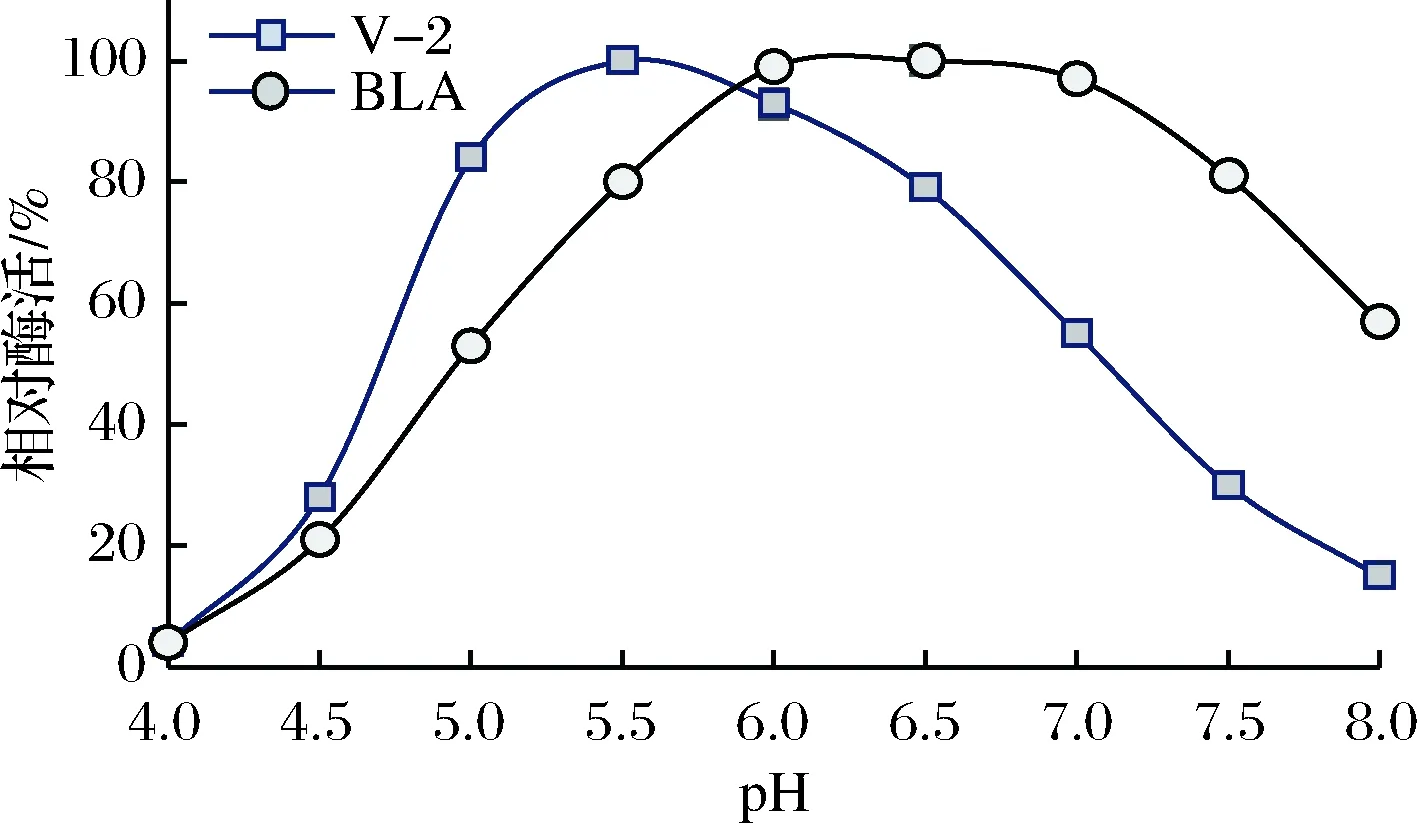
图3 pH对突变体V-2酶活力的影响
2.2.3 热稳定性
将酶液在不同温度(75、80、85和90℃)下保温60 min,定时取样分析剩余酶活,获得图4所示的酶热稳定性曲线。突变体V-2在75和80℃条件下稳定性良好,在85或90℃孵育1 h后仍分别保留80%和31%的酶活力;其热稳定性显著优于BLA(BLA在75、80和85℃下保温1 h后,酶活分别保留89%、74%和26%;在90℃条件下处理30 min,酶活力几近丧失)。可以看出,突变体V-2的热稳定性较BLA显著提升。
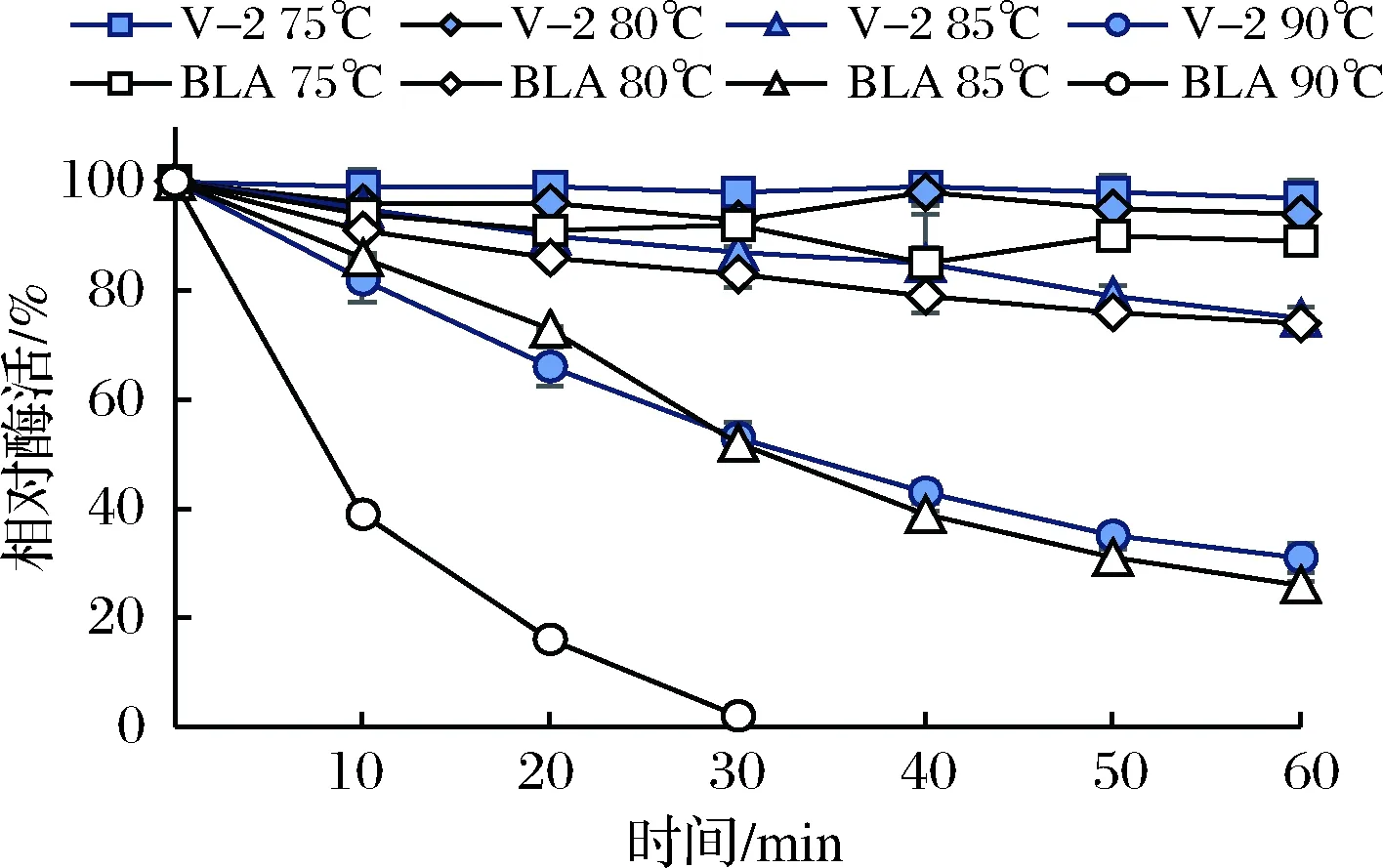
图4 突变体V-2的热稳定性
2.2.4 pH稳定性
将酶液在不同pH缓冲液中室温放置1 h后测其剩余酶活,结果如图5所示。突变体V-2在所测试的pH缓冲液(pH 4.0~8.0)中,皆具有良好的稳定性;在pH 4.0下的稳定性显著优于BLA(BLA在pH 4.0条件下放置1 h,酶活仅剩31%)。
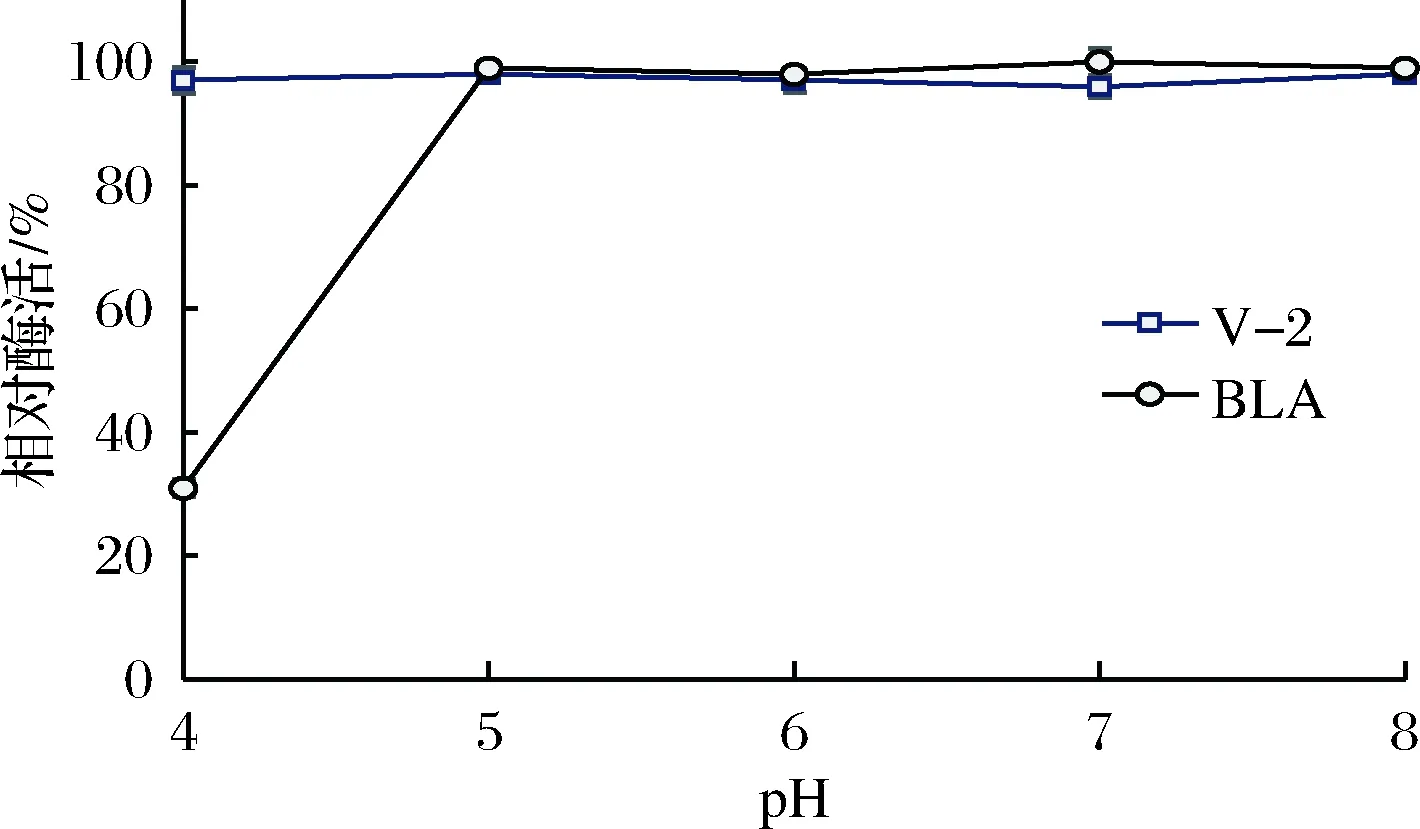
图5 突变体V-2的pH稳定性
2.2.5 金属离子和化学试剂对酶活的影响
将酶液与不同金属离子或化学试剂等体积混合,使酶液中金属离子浓度为1 mmol/L和5 mmol/L,研究其对酶活的影响,结果如表1所示。与BLA不同,所测试的15种常见金属离子和2种化学试剂对突变体V-2的酶活力皆无明显促进作用。Cu2+、Fe2+、Fe3+和Al3+对突变体V-2有明显的抑制作用,但在相同浓度下,其抑制作用低于对BLA的抑制作用。此外,EDTA显著抑制BLA酶活,突变体V-2对EDTA的敏感性明显低于BLA。

表1 金属离子和化学试剂对酶活力的影响
2.3 高温α-淀粉酶V-2动力学特征
以不同质量浓度(6~20 g/L)的可溶性淀粉为底物,在酶最适温度和最适pH下测定突变体V-2酶活,采用Lineweaver-Burk双倒数法作图,以底物浓度的倒数1/[S]为横坐标,酶活的倒数1/[V]为纵坐标,求得突变体酶动力学相关特征参数(表2)。突变体V-2的Km值和Vmax值分别为34 mg/mL和151.5 mg/(mL·min),与BLA差别不显著,但其催化水解淀粉的效率显著提升,较BLA提高了约33倍(表2)。

表2 突变体V-2的酶学动力学参数
3 结论
高温α-淀粉酶是淀粉加工与转化中不可或缺的核心淀粉酶制剂,其高效工业应用价值除了通过高效表达获得低成本制造的酶制剂外,进一步提升应用属性是决定其工业应用价值的关键。本文从前期建立的以地衣芽胞杆菌α-淀粉酶为基础的突变体库中鉴定出的高温α-淀粉酶突变体V-2,其最适作用温度较BLA提高了10℃,最适作用pH降低了0.5~1.0个pH值,并且此突变体可以在更高的温度和更低的pH下表现出更好的酶活力。这一研究结果可为后续此突变体的高效表达奠定坚实的理论基础和材料支撑。

