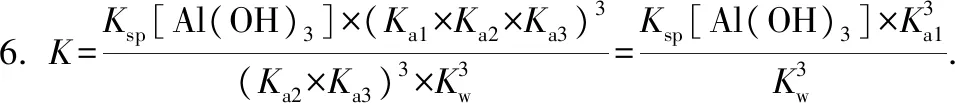由基本常数Ksp、Ka、Kb、Kw求反应平衡常数K 的方法
王星元(特级教师)
已知基本常数:难溶电解质的Ksp、弱电解质的电离平衡常数(弱酸的Ka及弱碱的Kb)、水的Kw,如何求整个化学反应的平衡常数K?对于简单的化学反应来说,常用变换相关物质基本常数幂与相关离子浓度幂乘除的方法,找出K与相关物质基本常数幂的关系,然后求解.但对于复杂的化学反应来说,用变换法找出上述关系相当困难.现总结归纳出简单的方法,则很容易得出K与相关物质基本常数的幂的关系.方法是:平衡常数K等于反应物中有基本常数物质常数幂的乘积与生成物中有基本常数物质常数幂的乘积的比值.即,
(二元弱酸H2A的常数为Ka1×Ka2; HA-的常数为Ka2.三元弱酸H3A依此类推等.)
现例析由基本常数求下列反应的平衡常数K.
1) Cu(OH)2(s)+2CH3COOH(aq)
Cu2+(aq)+2CH3COO-(aq)+2H2O(l)
分析反应物中难溶电解质为Cu(OH)2,常数为Ksp(化学计量数1为幂指数不写出,下同);弱电解质有CH3COOH,常数为Ka,化学计量数2为幂指数;生成物中弱电解质有H2O,常数为Kw,化学计量数2为幂指数.该反应的平衡常数

3) 3Mg(OH)2(s)+2H3PO4(aq)
Mg3(PO4)2(s)+6H2O(l)
分析反应物中难溶电解质为Mg(OH)2,常数为Ksp,化学计量数3为幂指数;难电离的物质为H3PO4,常数为(Ka1×Ka2×Ka3),化学计量数2为幂指数.生成物中难溶电解质为Mg3(PO4)2,常数为Ksp;弱电解质有H2O,常数为Kw,计量数6为幂指数.该反应的平衡常数
4) Cu2+(aq)+H2S(aq)CuS(s)+2H+(aq)
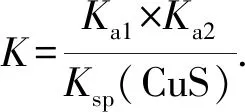
同理,可求出下列反应的平衡常数:
5) Cu2+(aq)+HS-(aq)CuS(s)+H+(aq)
6) 2AgCl(s)+S2-(aq)Ag2S(s)+2Cl-(aq)
CH3COOH(aq)+NH3·H2O(aq)
8) CuCl(s)+H2O(l)
CuOH(s)+Cl-(aq)+H+(aq)
注意: 反应物中有CO2参与的反应,实质上是CO2与H2O反应生成H2CO3参与的反应;生成物中的CO2,实质上是生成物H2CO3的分解产物.故反应物及生成物中的(CO2+H2O)均按H2CO3来计算.若反应物或生成物中只有CO2没有H2O(或H2O的计量数小于CO2),则在式子两边均加相应量的H2O,使有CO2的一方能组成(CO2+H2O),然后再计算;SO2,NH3等也要如此考虑.溶于水本身为酸的气体(如H2S等),无论在反应物或生成物中都按其酸来计算(此类情况计算的平衡常数是用H2CO3、H2S等溶液的浓度作为反应物、生成物浓度之一来表达、计算变换后实质反应的平衡常数).
9) CaCO3(s)+2CH3COOH(aq)
Ca2+(aq)+2CH3COO-(aq)+CO2(g)+H2O(l)
分析反应物中难溶电解质为CaCO3,常数为Ksp;难电离的物质是CH3COOH,常数为Ka,化学计量数2为幂指数.生成物中有(CO2+H2O),按H2CO3来计算,常数为Ka1×Ka2.该反应平衡常数为
10) CaCO3(s)+CO2(g)+H2O(l)

11) Ca2+(aq)+2OH-(aq)+CO2(g)
CaCO3(s)+H2O(l)
分析反应物中有CO2无H2O,方程式两边均需加1个H2O,反应转化为下列式子:
Ca2+(aq)+2OH-(aq)+CO2(g)+H2O(l)
CaCO3(s)+2H2O(l),
反应物中(CO2+H2O)按H2CO3来计算,常数为Ka1×Ka2.生成物中难溶电解质是CaCO3,常数为Ksp;弱电解质有H2O,常数为Kw,化学计量数2为幂指数.该反应平衡常数为
2Fe(OH)3(s)+3CO2(g)
分析生成物中有CO2没有H2O,方程式两边均加3个H2O(使生成物中CO2与H2O的化学计量数之比为1∶1),反应转化为下列式子:
反应物中弱电解质有H2O,常数为Kw,化学计量数6为幂指数.生成物(CO2+H2O)按H2CO3来计算,常数为Ka1×Ka2,化学计量数3为幂指数;生成物中难溶电解质是Fe(OH)3,常数为Ksp,化学计量数2为幂指数.该反应平衡常数
注意: 对难溶电解质中难电离的离子(如酸式酸根阴离子等),同样要计量其常数,不能遗忘.
13) Mg(OH)2(s)+H3PO4(aq)
MgHPO4(s)+2H2O(l)
链接练习
由基本常数求下列反应的平衡常数K.
1. Bi2S3(s)+3Cu2+(aq)3CuS(s)+2Bi3+(aq)
2. Fe3+(aq)+3H2O(l)
Fe(OH)3(s)+3H+(l)
Fe(OH)3(s)+3CO2(g)
4. 2Al3+(aq)+3S2-(aq)+6H2O(l)
2Al(OH)3(s)+3H2S(g)
Mg2+(aq)+2NH3·H2O(aq)
6. Al(OH)3(s)+3H3PO4(aq)
链接练习参考答案