金枪鱼粉的酶解工艺及其酶解产物功能活性研究
,*
(1.浙江万里学院生物与环境学院,浙江宁波 315100; 2.浙江医药高等专科学校制药工程学院,浙江宁波 315100)
金枪鱼(Tuna)作为深海“鱼中之王”,肉质蛋白质高、脂肪低,氨基酸组成与人体需求接近,富含二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)等不饱和脂肪酸[1],是一种营养食材。金枪鱼加工制作罐头和生鱼片过程中产生大量的边角料[2],由于受加工及保藏条件限制,金枪鱼边角料一般经简单的粗加工生产鱼粉被作为饲料、肥料出售。由于金枪鱼边角料中蛋白质含量高,如何将这些蛋白资源高值化利用,对于金枪鱼产业的发展具有重要意义。
将金枪鱼边角料烘干打成粉俗称金枪鱼粉,采用酸水解、碱水解、酶解或者是菌酶协同处理方法,可以得到金枪鱼的水解多肽和氨基酸。由于酶解法具有反应条件温和、破坏原有营养物质少、无污染、酶解蛋白水溶性好等特点,越来越多地被应用于水产蛋白粉的研究中[3]。Hsu[4-5]采用木瓜蛋白酶(PA)和蛋白酶XXIII(PR)水解金枪鱼黑肌肉副产物,纯化蛋白水解产物,评价了其抗氧化性和对乳腺癌细胞MCF-7的抗增殖活性,结果表明,分子量为390~1400 Da的肽组分具有抗氧化和抗增殖活性,并测定了从PA和PR水解产物中分离出的两个抗增殖肽的氨基酸序列,分别是Leu-Pro-His-Val-Leu-Thr-Pro-Glu-Gly-Ala-Thr(1206 Da)和Pro-Thr-Ala-Gly-Gly-Val-Tyr-Met-Val-Thr(1124 Da),它们显示了对MCF-7细胞体外的剂量依赖性抑制作用,IC50值分别为8.1和8.8 μmol·L-1,表明金枪鱼黑肌肉副产品中的抗氧化和抗增殖酶解物可能是食品和营养应用中的有用成分。
金枪鱼副产物来源、酶制剂选择以及酶解工艺不同都影响着酶解效果。如陈启航等[6]对金枪鱼蒸煮液进行酶解的最佳酶制剂为木瓜蛋白酶,在56 ℃、添加量300 U/g条件下酶解4 h,此时水解度为27.44%±0.04%。王雨生等[7]为了从金枪鱼皮制备胶原蛋白肽,从木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、风味蛋白酶中筛选出金枪鱼皮酶解的最佳蛋白酶是中性蛋白酶,酶添加量1000 U/g金枪鱼皮、酶解4 h,肽得率29.03%。文献报道[8]利用胰蛋白酶对金枪鱼暗色肉酶解制备的酶解液中必需氨基酸含量占总氨基酸含量的42.38%,可作食品营养补充剂。金枪鱼副产物的相关酶解产物在饲料、医药领域的应用研究均有报道[9-10]。
为了提高金枪鱼粉附加值,本研究以金枪鱼粉为原料,以水解度(Degree of hydrolysis,DH)为指标,通过适宜于金枪鱼粉的酶制剂优选,筛选出合适又经济的金枪鱼粉水解蛋白酶,以单因素实验和响应面试验确定金枪鱼粉酶解蛋白肽的制备新工艺。在此基础上,对金枪鱼酶解物进行抗氧化性、对酪氨酸酶抑制性、以及抑菌性等功能性实验,以期为金枪鱼粉的高效酶解产业化开发和其综合应用提供参考。
1 材料与方法
1.1 材料与仪器
金枪鱼粉 金枪暗色肉边角料5 ℃烘干,粉碎过30目筛备用,蛋白质含量为61.56%,宁波丰肽生物科技有限公司提供,冰箱-18~0 ℃保存;胰蛋白酶 0.4万U·g-1,国药集团;中性蛋白酶 80万U·g-1,江苏锐阳生物科技公司;碱性蛋白酶 20万U·g-1,宁波丰肽生物科技有限公司;风味蛋白酶 3万U·g-1,宁波丰肽生物科技有限公司;大肠杆菌 浙江万里学院微生物实验室提供;甲醛-水溶液(37%~40%)、硫酸铜、硫酸钾、硫酸、盐酸、氢氧化钠 分析纯,国药集团。
BP121S精密天平 上天精密仪器有限公司;6~16 k低速大容量冷冻离心机 Sigma公司;PH-100A pH计 邦西仪器科技有限公司;SH220N石墨消解仪 上海卓好实验室设备有限公司;K9860全自动凯氏定氮仪 济南海能仪器股份有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限公司。
1.2 实验方法
1.2.1 金枪鱼粉的酶解工艺

取一定量的金枪鱼粉于适量的纯化水中,搅拌均匀后,用6 mol·L-1NaOH溶液调整混合液的pH,再加入适量的酶制剂,恒温搅拌酶解。酶解结束后于100 ℃灭酶15 min,以4000 r·min-1离心酶解混合液10 min,得到酶解液。
1.2.2 金枪鱼粉酶解的酶制剂筛选与单因素实验
1.2.2.1 酶制剂筛选 取金枪鱼粉5 g,按1∶5料液比加蒸馏水,按2500 U·g-1(鱼粉)分别添加风味蛋白酶、胰蛋白酶、碱性蛋白酶、中性蛋白酶,酶解6 h(酶解液pH和温度选择为各商品酶的最适条件)。以水解度为指标比较各蛋白酶对金枪鱼粉的酶解效果。
1.2.2.2 料液比对水解度的影响 取5 g金枪鱼粉5份,按料液比为1∶3、1∶5、1∶7、1∶9 (g/mL)加水搅匀,用6 mol·L-1NaOH调pH至10,按2500 U·g-1加入碱性蛋白酶,在55 ℃酶解6 h。其余操作按“1.2.1”项。取酶解液测定水解度。
1.2.2.3 加酶量对水解度的影响 取5 g金枪鱼粉5份,按料液比1∶5加水搅匀,加酶量为0.5×104、0.75×104、1×104、1.25×104、1.5×104U·g-1原料,其它酶解条件同“1.2.2.2”。
1.2.2.4 酶解液pH对水解度的影响 取5 g金枪鱼粉6份,按料液比1∶5加水搅匀,加入碱性蛋白酶10000 U·g-1原料,用6 mol·L-1NaOH分别调pH至7、8、9、10、11、12,在温度55 ℃酶解6 h,其它酶解条件同“1.2.2.2”。
1.2.2.5 酶解温度对水解度的影响 取5 g金枪鱼粉5份,按料液比1∶5加水搅匀,加入碱性蛋白酶10000 U·g-1原料,用6 mol·L-1NaOH分别调pH至10,在温度分别为45、50、55、60、65 ℃下酶解6 h,其它酶解条件同“1.2.2.2”。
1.2.2.6 酶解时间对水解度的影响 取5 g金枪鱼粉5份,按料液比1∶5加水搅匀,加入碱性蛋白酶10000 U·g-1原料,在温度55 ℃,pH为10.0的条件下分别酶解3、6、7.5、9、12 h。其它酶解条件同“1.2.2.2”。
1.2.3 金枪鱼粉酶解的响应面试验优化 在单因素实验基础上,以水解度为指标,根据Box-Behnken中心组合试验法进行3因数3水平试验设计,确定碱性蛋白酶解金枪鱼粉的最佳工艺条件,实验因素及水平见表1。
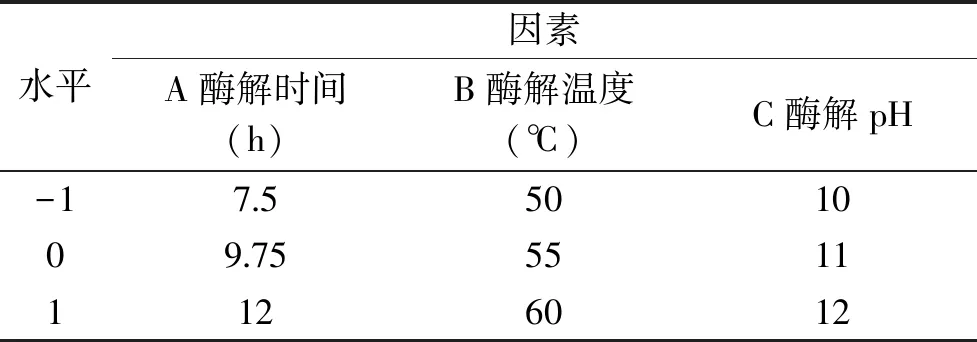
表1 响应面试验设计因素水平表Table 1 Factors and levels of response surface methodology
1.2.4 水解度测定 总氮含量N(g·100 mL-1)根据GB 5009.5-2010凯氏定氮法测定;氨基酸态氮含量n(g·100 mL-1)根据GB 5009.235-2016甲醛滴定法测定。水解度DH按下式计算[11]:
1.2.5 金枪鱼粉酶解液的功效性测定

表3 不同酶对金枪鱼粉水解度的影响Table 3 Effects of different kinds of proteases on hydrolysis degree of tuna powder
1.2.5.1 金枪鱼粉酶解液样品制备 按“1.2.3”项优化工艺条件制备,浓缩后得到氨基酸态氮含量为7.57 mg·mL-1的金枪鱼粉酶解液。
1.2.5.2 对羟自由基清除率测定 参照文献[11]。取9 mmol·L-1硫酸亚铁溶液1 mL、9 mmol·L-1水杨酸-乙醇溶液1 mL于试管中,分别加入稀释15、20、25、30、35倍的酶解液1 mL,最后加8.8 mmol·L-1过氧化氢溶液1 mL启动反应,37 ℃反应30 min,于510 nm测吸光度,记为Ax。以1 mL蒸馏水代替酶解液作空白,记为A0。以1 mL蒸馏水代替H2O2作酶解液本底,记为Ax0。
1.2.5.3 总还原力测定 参照文献[12]。在试管中分别加入0.2、0.4、0.6、0.8、1.0 mL酶解液样品,用蒸馏水稀释至1.0 mL,同时取1.0 mg·mL-1维生素C 0.2、0.4、0.6、0.8、1.0 mL并用蒸馏水稀释至1.0 mL为参照。分别加入0.2 mol·L-1、pH6.6的磷酸盐缓冲液(PBS)2.5 mL,再加入1%铁氰化钾2.5 mL,混匀,于50 ℃水浴20 min,加入10%三氯乙酸1 mL混匀,离心,取2.5 mL上清液,加蒸馏水2.5 mL和0.1%氯化铁0.5 mL,放置15 min后于700 nm处测吸光度。
1.2.5.4 对酪氨酸酶抑制率测定 参照唐煜括等[12]方法。量取0.2、0.4、0.6、0.8、1.0 mL样品,再用蒸馏水稀释至1.0 mL,备用,按表2将PBS缓冲液(pH6.6)、金枪鱼酶解液、5 mmol·L-1的L-酪氨酸溶液加好后于37 ℃保温10 min,再加入100 U·mL-1的酪氨酸酶混匀,于37 ℃保温30 min后立即测定475 nm吸光度。酶解液对酪氨酸酶抑制率如下计算:
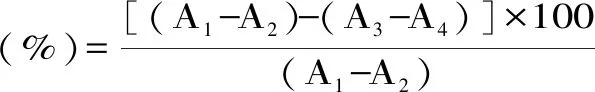

表2 金枪鱼酶解液对酪氨酸酶抑制率的反应液组成Table 2 Composition of reaction liquid of tuna lysate against tyrosinase
1.2.5.5 对大肠杆菌的抑制实验 参照王叶青等[13]方法。取用0.22 μm滤膜过滤除菌后的不同浓度1.52~121.6 μg·mL-1(以氨基态氮浓度计)的金枪鱼酶解液100 μL,加入到含有5 mL的LB培养基中,再分别加入50 μL活化好的大肠杆菌菌液(107~108CFU·mL-1),于37 ℃、150 r·min-1振荡培养24 h,测定540 nm处大肠杆菌培养液的吸光度AX,同时以100 μL无菌蒸馏水代替酶解液作对照A0,计算抑菌率(%)=(A0-AX)×100/A0。
1.3 数据处理
2 结果与分析
2.1 酶制剂筛选
由表3可知,四种蛋白酶对金枪鱼粉的水解度为:碱性蛋白酶>风味蛋白酶>中性蛋白酶>胰蛋白酶。由于添加酶制剂的量较低,总体水解度偏低。酶解效果以碱性蛋白酶与风味蛋白酶较好,水解度大于14%。碱性蛋白酶可作用于色氨酸、丙氨酸、苯丙氨酸、亮氨酸等形成的多种肽键,酶切位点较多,能较彻底地水解底物蛋白[14],且碱性蛋白酶性价比高,考虑工业化生产成本,选择碱性蛋白酶为金枪鱼粉的酶制剂。
2.2 酶解单因素实验结果
2.2.1 料液比对水解度的影响 由图1可知,随着料液比增加,水解度呈先增大再减小的变化趋势,在料液比为1∶5时,金枪鱼粉酶解液的水解度最大。这是因为料液比对体系的粘稠度有影响,当料液比较小时,酶解液粘度较大,不利于酶制剂和酶解产物的扩散;当料液比较高时,不利于酶与底物充分接触,也不利于酶解[15]。因此,选择料液比为1∶5。

图1 料液比对水解度影响Fig.1 Effects of material liquid ratio on hydrolysis degree
2.2.2 加酶量对水解度的影响 由图2可知,随着加酶量增加,水解度增大,当加酶量为10000 U·g-1原料时,蛋白水解度为25.15%±0.30%,之后酶量增加对水解度影响趋于平缓。增加酶制剂用量,可以提高底物与酶的接触率,加速酶解反应进程,提高水解度。随着酶解产物浓度的提高,产物与未作用的酶有可能形成复合物,阻碍底物与酶的作用,减缓水解进程[16],因此选用10000 U·g-1原料为最适加酶量。

图2 加酶量对水解度的影响Fig.2 Effects of enzyme dosage on the degree of hydrolysis
2.2.3 酶解液pH对水解度的影响 由图3可知,酶解效果受酶解液pH影响大,随pH的增大水解度增大,在pH为11时,水解度达到最大,当pH为12时,水解度急剧下降。这是因为强碱对碱性蛋白酶的空间结构有极大的破坏作用,使其失去相应的活性[17]所致。本实验选择酶解液pH为11。
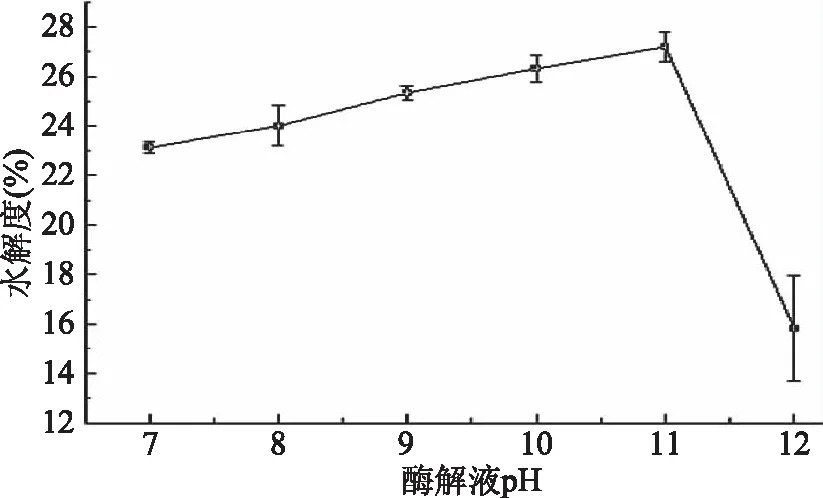
图3 酶解液pH对水解度的影响Fig.3 Effects of pH value on the degree of hydrolysis
2.2.4 酶解温度对水解度的影响 由图4可知,随着酶解温度的升高,酶活性增强,酶促反应加快,水解度增大。55 ℃时,水解度达最大值。继续升高温度,水解度反而下降。这是因为酶解温度过高会导致酶分子结构的次级键解体,酶蛋白变性,酶活力减弱[18]。因此,碱性蛋白酶酶解金枪鱼粉最适温度为55 ℃。

图4 酶解温度对水解度的影响Fig.4 Effects of hydrolysis temperature on the degree of hydrolysis
2.2.5 酶解时间对水解度的影响 由图5可知,随酶解时间增加,酶解液的水解度增大,当酶解时间达到9 h时,水解度变化趋缓。因为酶解刚开始时,底物和酶的质量浓度均比较高,接触面积较大,酶解速度较快,水解度增幅较大;随着反应进行,酶量减少,酶解液中游离肽不断积累,水解度趋缓。当酶解时间为7.5、9、12h时,对应的水解度分别是25.85%±0.28%、26.92%±0.42%、26.63%±0.11%,差异不大。所以后续进一步对酶解时间在7.5~12 h进行优化。
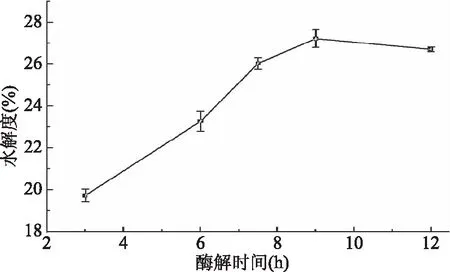
图5 酶解时间对水解度的影响Fig.5 Effects of reaction time on the degree of hydrolysis
2.3 Box-Behnken响应面优化结果
2.3.1 响应面试验设计与结果 根据单因素实验结果,选择酶解时间、酶解液pH与温度进行Box-Behnken响应面设计试验,以水解度为指标,结果见表4。
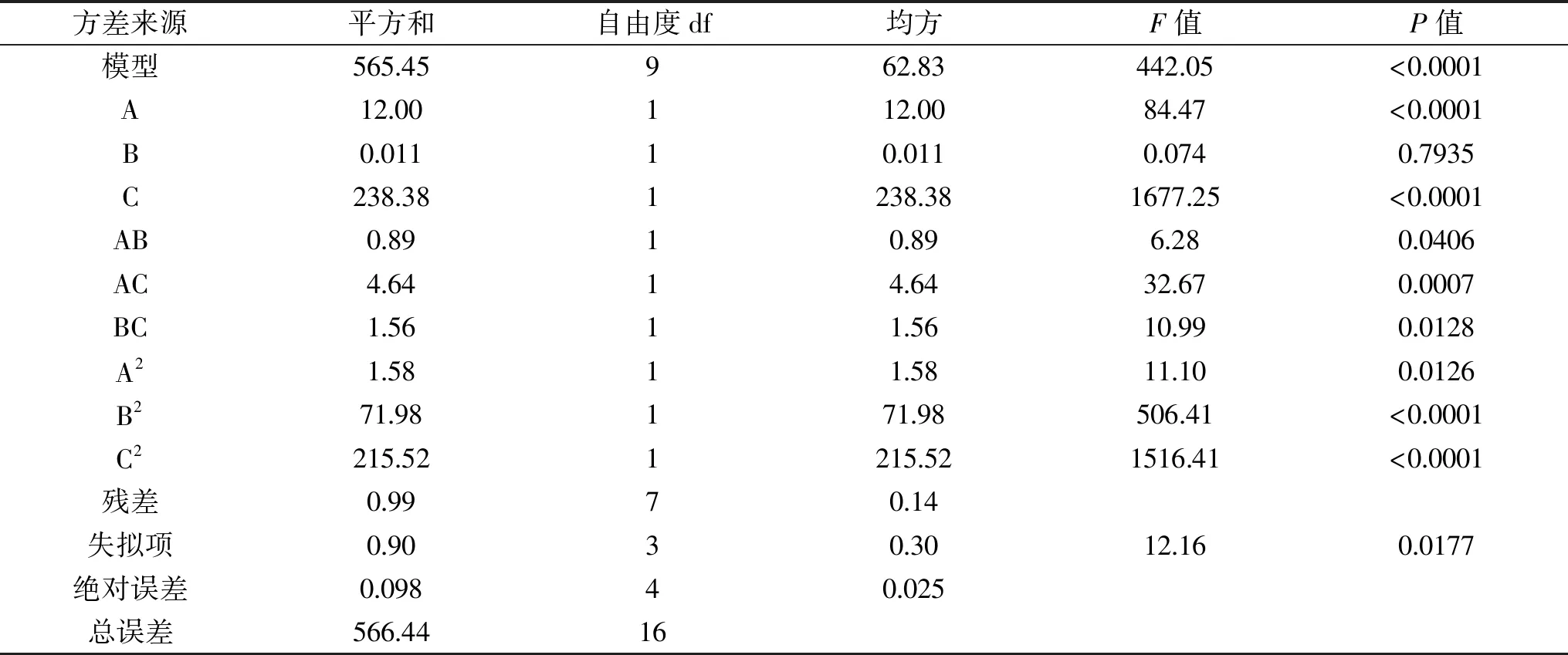
表5 回归模型的方差分析Table 5 Analysis of variance of regression model
注:P<0.05、P<0.01分别表示差异显著和极显著。

表4 响应面试验结果Table 4 Results of RSM test
2.3.2 数学模型的建立及显著性检验 利用Design Expert 8.0统计软件对表4的数据进行多元回归拟合,得到水解度的二次项回归模型方程为:
DH(%)=29.64-1.22A+0.036B-5.46C-0.47AB-1.08AC+0.63BC-0.61A2-4.13B2-7.15C2
表5为回归模型的方差分析,该模型的P值小于0.0001,表明二次回归模型极显著;失拟项P=0.017>0.01,说明该回归方程拟合度良好;模型的校正系数表明响应值的变化有97.44%是有所选因数引起的,说明该模型能正确反映水解度与时间、温度和pH之间的关系。

图6 酶解温度与pH的交互作用对金枪鱼粉水解度的影响Fig.6 Effect of temperature of enzymatic hydrolysis and pH on hydrolysis degree of tuna powder
酶解时间、酶解温度和酶解液pH的F值大小为:C>A>B,可知对于水解度DH影响因素强弱顺序为:酶解液pH>酶解时间>酶解温度。一次项A、C影响极显著(P<0.01),B影响不显著(P>0.05);二次项A2显著(P<0.05),B2、C2极显著(P<0.01);交互项中AC极显著(P<0.01),AB、BC显著(P<0.05),表明酶解温度、酶解时间、以及酶解液pH两两相互之间对酶解效率均有协同作用。各因子的交互作用对结果影响见图6~图8。由图6~图8可知,酶解液pH、酶解时间、酶解温度两两之间的交互作用显著。
2.3.3 验证试验 根据Design Expert 8.0软件分析得出,最佳工艺参数为:酶解时间8.13 h,酶解温度55.10 ℃,酶解液pH10.67,模型对水解度的理论预测值30.97%。考虑到试验的可行性,按照酶解时间8 h,酶解温度55 ℃,酶解液pH10.5进行5次验证试验。得到水解度为29.20%±0.08%,与理论值接近,相对误差为6.08%。

图7 酶解时间与温度的交互作用对金枪鱼粉水解度的影响Fig.7 Effect of enzymatic hydrolysis time and temperature on the hydrolysis degree of tuna powder

图8 酶解时间与pH的交互作用对金枪鱼粉水解度的影响Fig.8 Effects of enzymatic hydrolysis time and pH on hydrolysis degree of tuna powder
说明应用响应面法优化碱性蛋白酶水解金枪鱼粉的工艺参数是可行的,模型具有较好的可靠性。
2.4 金枪鱼酶解液的生物活性
2.4.1 金枪鱼酶解液对羟自由基清除结果 由图9可知,金枪鱼酶解液对羟自由基清除率随酶解液中氨基态氮浓度的增加而增强,当氨基态氮浓度为0.5047 mg·mL-1时,其清除率可达80%,且浓度再增加,其清除率趋于稳定。金枪鱼粉酶解产物主要含氨基酸、小分子多肽等,这些物质可与Fe2+结合阻断羟自由基生成,清除羟自由基。Hsu等[19]从金枪鱼煮汁中分离到富含Glu、Ala、Asp的抗氧化活性肽。
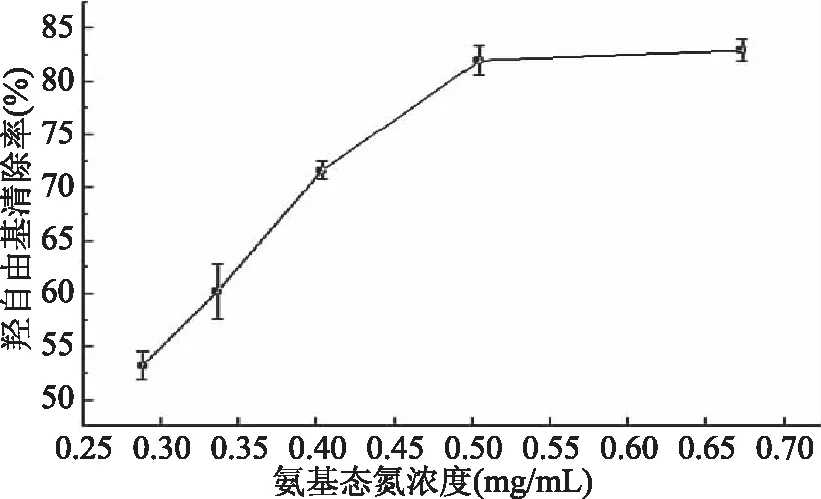
图9 金枪鱼酶解液对羟自由基的清除率Fig.9 Scavenging rate of the enzymatic hydrolysates of tuna to hydroxyl radical
2.4.2 酶解液总还原力 还原力可以判定酶解液是否为优良的电子供体,一般情况下,物质的还原力与抗氧化力呈正相关。由图10可知,随着金枪鱼粉酶解液中氨基态氮浓度增加,总还原力增强。当氨基态氮浓度为7.57 mg·mL-1时,其还原力与0.4 mg·mL-1维生素C接近。金枪鱼粉酶解液的还原力大小与其水解后多肽、氨基酸中羟基增加有关,这些基团有利于与Fe3+结合并将其还原为Fe2+[20]。

图10 金枪鱼粉酶解液与维生素C的总还原力对比Fig.10 Comparison of total reducing power between enzymatic hydrolysate of tuna powder and vitamin C
2.4.3 酶解液对酪氨酸酶的抑制作用 由图11可知,酶解液浓度对酪氨酸酶的抑制率呈线性关系,线性方程为y=9.749x+16.46(r=0.9617),当酶解液中氨基酸态氮含量为7.57 mg·mL-1时,对酪氨酸酶的抑制率达到了84.8%,其半数抑制率为IC50=3.44 mg·mL-1。酶解液中的小分子多肽可与酪氨酸酶结合,破坏酪氨酸酶的活性中心,导致酪氨酸酶失活[21]。

图11 金枪鱼酶解液对酪氨酸酶抑制作用Fig.11 Inhibition of tuna enzymolysis liquid on tyrosinase
2.4.4 酶解液的抑菌作用 由图12可知,加入酶解液的培养基,具有抑制大肠杆菌生长的作用,并且抑菌效果随氨基态氮浓度增加而升高。李慧等[22]的研究结果表明,从黄鳍金枪鱼皮酸化后的提取液中分离出分子量为3.4 kDa的多肽,对大肠杆菌表现出强效的抑制作用,且不具有溶血性,是研制药物、食品和饲料添加剂的潜在物质。本实验结果表明金枪鱼酶解液有抑菌作用,表明含有抗菌多肽。

图12 金枪鱼酶解液对大肠杆菌的抑制作用Fig.12 Inhibition of tuna enzymolysis liquid on E.coli
金枪鱼粉酶解液的功能性实验证明了酶解液具有较好的抗氧化性、酪氨酸酶抑制性和一定的抑菌性,这一结果与文献[23-24]的研究结果相似。这为其作为功能性食品、饲料添加剂提供了应用依据,也为后续分离纯化活性组分奠定了实验基础。
3 结论
本研究以金枪鱼鱼粉为原料,以水解度为评定指标,从胰蛋白酶、中性蛋白酶、碱性蛋白酶、风味蛋白酶中筛选出碱性蛋白酶为金枪鱼粉的最适酶,利用单因素实验和响应面法优化碱性蛋白酶酶解金枪鱼粉的工艺,得到最优酶解条件为:料液比1∶5 (g∶mL)、加酶量为1×104U·g-1金枪鱼粉、酶解温度55 ℃、酶解液pH为10.5、酶解时间8 h,此条件下水解度为29.20%±0.08%。
对金枪鱼鱼粉酶解液的功能性评价发现,酶解液具有较好的抗氧化性,对·OH自由基的清除率、对酪氨酸酶的抑制率均随氨基酸态氮浓度的增加而增大;当氨基态氮浓度为7.57 mg·mL-1时,其总还原力与0.4 mg·mL-1维生素C接近;酶解液对大肠杆菌的生长有一定抑制作用,在一定浓度范围内抑菌效果随氨基态氮浓度增加而升高。
后续将进一步对金枪鱼酶解液中多肽进行分离纯化研究,为从金枪鱼粉酶解液中寻找具有抗氧化功能活性的活性多肽提供物质基础。

