几种缓冲溶液简介及应用*
于梦雪,邹淑君
(黑龙江中医药大学 药学院,黑龙江 哈尔滨 150040)
关键字:缓冲溶液;磷酸盐;硼酸盐;Tris-HCl;HEPES
前言
许多实验操作、实际生产以及生物体内的生化反应等都需要在特定的pH 值范围内才能正常有效地进行,从而得出正确的结果和结论。在这些反应过程中酸碱缓冲溶液经常发挥着非常重要的作用。如人体血浆中存在NaHCO3-H2CO3、蛋白质钠盐-蛋白质、氧合血红蛋白钾盐-氧合血红蛋白等缓冲对构成血浆的酸碱缓冲系统,以维持正常人血浆的pH 值在7.35~7.45。若血浆pH 值低于7.35 或者高于7.45 则分别会引起酸中毒和碱中毒,危及生命。因此相关专业人员有必要对缓冲溶液的基本知识进行了解。
1 缓冲溶液概述
酸碱缓冲溶液是指能够抵抗外加少量强酸、强碱以及水的稀释作用,并维持溶液pH 值基本不变的溶液。常见的缓冲溶液需具备酸碱缓冲对,缓冲对可以是两种不同的物质,如HAc-NaAc 缓冲溶液中的HAc 和NaAc,也可以是一种物质里同时含有互为共轭酸碱的不同基团,如邻苯二甲酸氢钾中的羧基(-COOH)和羧酸根(-COO-)。当然,浓度很大的强酸、强碱溶液中即使不含有酸碱缓冲对也有一定的缓冲能力,因为外加少量的酸或碱对强酸、强碱的浓度变化影响很小,所以pH 值基本不变。
缓冲溶液的作用原理是通过互为酸碱缓冲对之间的酸碱平衡移动来抵御外加少量酸、碱以及稀释作用的。缓冲溶液自身pH 值可根据公式进行计算[1],缓冲溶液的缓冲能力可以用缓冲容量进行标度。但是,任何缓冲溶液的缓冲能力都是有限的,因为当大量的H+或OH-进入溶液时,缓冲溶液中的缓冲对将被大量消耗,抗碱、抗酸的作用也随之减弱直到消失。实际应用中各缓冲对组成的缓冲溶液都有最佳的缓冲范围。因此,要用好缓冲溶液,需对不同的缓冲溶液有具体的了解。以下介绍几种常见的缓冲溶液及用途,为大家深入理解缓冲溶液提供参考。
2 缓冲溶液实例
2.1 磷酸盐缓冲溶液
由于磷酸是三元酸,因此磷酸盐缓冲溶液的缓冲 对 可 以 为 H3PO4-H2PO4-、H2PO4--HPO42-或HPO42--PO43-。但生化实验中常用的磷酸盐缓冲溶液一般主要由H2PO4--HPO42-的钠盐或钾盐配制而成。溶液中主要以H2PO4-+H2O⇌HPO42-+H3O+平衡移动体系来维持溶液pH 值的稳定,pH 值范围一般为6.2~8.2。在生化相关实验中通常在其中加入NaCl 或者KCl 构成磷酸盐缓冲生理盐水(简称PBS)来使用。
因磷酸盐缓冲溶液的pH 值范围与一些生物活性物质存活的酸碱环境接近,所以在生化实验中应用较多,如可用来配置相关溶液、以及作为组织抗原修复实验[2]的修复液、药物释放的溶媒[3,4]等。另外,PBS 作为一种溶剂目前在冷冻保存中也较受欢迎,与其相关的实验研究也在不断的进行中[5]。
2.2 硼酸盐缓冲溶液
硼酸盐缓冲溶液中的硼酸盐常见为硼酸钠,简称硼砂,可以用Na2B4O5(OH)4·8H2O 表示,在水溶液中极易发生B4O5(OH)4-+5H2O⇌2H3BO3+2B(OH)4-水解反应生成互为缓冲对的H3BO3和B(OH)4-。常见的硼酸盐缓冲溶液有硼砂缓冲液、硼酸-硼砂缓冲液。在构成上又有硼酸-硼砂、硼酸-氢氧化钠、硼砂-氢氧化钠等多种形式[6]。不同形式构成的缓冲溶液会因物质组成以及浓度的不同导致H3BO3和B(OH)4-的来源、浓度及比例不同,从而导致pH值的范围有所不同。但它们从本质上都可归为通过H3BO3+H2O⇌B(OH)4-+H+的平衡移动来发挥缓冲作用。
硼砂缓冲溶液的配制是将一定质量的硼砂溶于蒸馏水中,再用盐酸调节pH 值至合适值,pH 值范围一般为8.0~9.0;也可用氢氧化钠调节pH 值,pH值范围一般为8.0~10.8[6]。而硼酸-硼砂缓冲溶液则一般由一定量的硼酸和硼砂溶于蒸馏水中配制而成,pH 值范围一般为6.5~8.9 左右[6]。当应用于生化实验时,需要加入一定量的NaCl 以维持溶液等渗。
因硼酸-硼砂缓冲液的pH 值范围与泪液接近,所以在一些眼药水的制备中常作为pH 值调节剂或渗透压调节剂,如普拉洛芬滴眼液[7]的配制。而硼砂缓冲液则可作为一些药物的释放介质,如其对合(氯)霉素有助溶作用。另外,硼酸盐缓冲液亦可以代替巴比妥缓冲液应用于基础纤维膜电泳教学实验中[8,9]。
2.3 三羟甲基氨基甲烷—盐酸缓冲溶液
三羟甲基氨基甲烷简称Tris,分子式为C4H11NO3,结构式见图1。分子中的氨基(—NH2)为碱性,因此Tris 是一种弱碱,常与盐酸构成缓冲溶液,简称Tris-HCl 缓冲液。该缓冲液一般由一定质量的Tris 溶于蒸馏水中,再用HCl 调节至适合的pH 值。在配制时还需加入NaCl 以维持溶液等渗。因Tris-HCl 缓冲液的pH 值受溶液浓度、温度影响较大,以及易与空气中的CO2反应,所以在使用时需现用现配制。
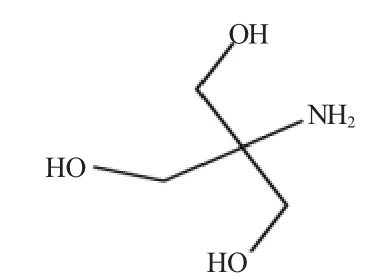
图1 三羟甲基氨基甲烷的结构式Fig.1 The constitutional formula of Tris
Tris-HCl 缓冲液的缓冲原理为:Tris 中的-NH2与HCl 结合生成Tris·HCl 盐。季铵基团Tris·H+与Tris 形成缓冲对,溶液中存在Tris·H++H2O⇌Tris+H3O+平衡关系,凭借该平衡移动来发挥缓冲作用。其缓冲范围一般为7.0~9.0[10]。
由于Tris 对生化过程干扰很小,不与钙、镁离子及重金属离子发生沉淀,所以在DNA、蛋白质等生物大分子实验中经常应用,Tris-HCl 缓冲溶液可以做DNA[11,12]、蛋白质[13]的溶解液或提取液,也是DNA 相关研究实验中的重要缓冲液[14,15],如DNA 的捕获与释放[16]、染色体的特异性标记[17]等方面。另外,在生物陶瓷材料研究方面,Tris-HCl 缓冲液还可以作为研究过程中一些特定的生物陶瓷体外浸泡液[18]。
2.4 4-羟乙基哌嗪乙磺酸缓冲溶液
4-羟乙基哌嗪乙磺酸(简称HEPES),分子式为C8H18N2O4S。分子结构中既含有酸性的磺酸基(-SO3H),又含有两个碱性叔胺氮,所以呈现两性,可用来配制两性离子缓冲液。该缓冲溶液一般由一定相对分子质量的HEPES 溶于蒸馏水中,再用氢氧化钠调节pH 至适当值。其pH 缓冲范围一般为6.8~8.2[19]。缓冲溶液的浓度以及外界温度对其pH值影响不大,因此能够较长时间维持稳定的pH 值。
因HEPES 分子中的-SO3H 呈现较强的酸性,易给出H+;两个叔胺氮各含有一个孤对电子,呈现碱性,可以接受H+生成季铵盐。所以磺酸基和叔胺在水溶液中互为缓冲对。而且,单个HEPES 分子中的叔胺和磺酸基也可传递H+生成内盐,即两性离子。在水溶液中,HEPES 分子、内盐以及磺酸基和叔胺各自产生的离子之间因H+或OH-的转移而能够相互转化建立平衡关系,凭借该平衡关系的移动来抵御外来酸碱的影响来调节溶液pH 值稳定,所以具有缓冲作用,其平衡转化关系见图2。

图2 HEPES 溶液中平衡转化关系Fig.2 The equilibrium transformation relation in HEPES buffer solution
因HEPES 缓冲溶液具有对细胞无毒性[20]、不易穿过生物膜、不参与细胞内生化过程等特点,所以在生化实验中具有广泛的应用,如可用于开放式细胞生长、细胞的长期观察、RNA 或DNA 提取试剂盒中。其次,相关研究表明以HEPES 溶液做缓冲液有利于多肽在金纳米粒子表面的偶联反应[21]。另外,HEPES 缓冲溶液对镁生物降解影响[22]的相关实验表明,HEPES 能提高镁的生物降解性以及抑制镁不溶盐层的形成。
前述不同缓冲溶液虽然有相似之处,同时也存在差异,如(1)缓冲溶液应用的酸碱度环境有差异:硼酸盐缓冲溶液和Tris-HCl 缓冲溶液较适合在碱性环境中使用,而磷酸盐缓冲溶液和HEPES 缓冲溶液则多数情况下适宜运用在pH 值为6.8~8.2 左右的弱酸性、弱碱性或接近中性的环境中;(2)缓冲溶液组成有差异:硼酸盐缓冲溶液、Tris-HCl 缓冲溶液及磷酸盐缓冲溶液一般是由两种物质配置而成,而HEPES 缓冲溶液则是由一种物质配制;(3)缓冲溶液发挥缓冲作用的原理有一定差异:硼酸盐缓冲溶液、Tris-HCl 缓冲溶液及磷酸盐缓冲溶液靠体系中缓冲对的电离或水解平衡移动来发挥缓冲作用,而HEPES 缓冲溶液则是靠体系中平衡转化关系来发挥缓冲作用;(4)缓冲溶液发挥作用的侧重方面不同:如同是在生物药相关方面的应用,磷酸盐缓冲溶液在固体药物释放研究中应用较多。而硼砂缓冲溶液多用于液体药物如滴眼液中。Tris-HCl 缓冲较多用于蛋白质、DNA 等生物大分子的实验研究中。而HEPES 更侧重应用于细胞水平的相关生化实验研究中;(5)缓冲溶液在稳定性方面各显利弊:如Tris-HCl 缓冲溶液pH 值受外界影响较大,一般现用现配。同时需要注意Tris 是一级脂肪胺,分子结构中的氨基易与醛类化合物发生缩合反应,是一些生化实验的抑制剂,其次硼酸盐缓冲液有一定毒性,不宜用做注射液或者口服液的缓冲液。虽然磷酸盐缓冲溶液稳定性很好,但磷酸根具有一定的络合能力会抑制一些与金属离子有关的生化反应。HEPES 缓冲溶液是较理想的生物缓冲剂,但其有多种生物学效应,如:缩短血液凝固时间、减缓平滑肌收缩频率以及阻断细胞膜上的阴离子通道等,在一定程度上会影响实验结果,使用时应需注意。
3 结语
体内的生化反应,医学检测,药物生产与保存以及分析实验等都常需缓冲溶液的参与才能正常进行,同时所需要的缓冲液又各有不同。因此对于理、农、林、医、食品、卫生等相关专业的学生来说,只有掌握缓冲溶液的相关知识及用途,才能正确地根据实际需要选择一定浓度和pH 值的缓冲溶液来使用。在选择缓冲溶液时,既要考虑它的毒性、稳定性、有效的缓冲范围,还要考虑所选缓冲溶液是否与主体物质反应、对主体物质的干扰性以及是否与主药发生配伍禁忌等。目前,已知的缓冲溶液种类很多,许多缓冲溶液的配制方法都可在化验室化学分析实用手册等现成手册中查到。相信随着科学技术和实验的不断丰富和发展,越来越多的缓冲溶液会被开发运用并发挥重要作用。

