微创玻璃体手术治疗息肉样脉络膜血管病变合并玻璃体出血
杨 艳,李 静,梁 军,谷 威
0 引言
近年来,有大量的研究报道了息肉样脉络膜血管病变(polypoidal choroidal vasculopathy,PCV)的临床特征多样性以及其自然病程和治疗方式[1-3],但是对于PCV导致的玻璃体出血(vitreous hemorrhage,VH)的病例特点及其治疗效果的报道相对较少[4-5]。目前报道PCV容易导致视网膜下出血和VH[5],发生率分别为30%~63.6%和1%~19.9%[6-7]。大多PCV合并VH的玻璃体出血浓厚,难于自行吸收,需手术清除积血,然后通过荧光素钠/吲哚菁绿血管造影(fundus fluorescein angiography,FFA;indocyanine green angiography,ICGA)来明确诊断,后期联合眼内注药或/和激光治疗。为此,我们回顾分析了一组接受玻璃体手术治疗PCV合并VH患者的临床资料,探讨玻璃体手术对PCV合并VH的疗效以及PCV合并VH患者的临床病例特点。现将结果报道如下。
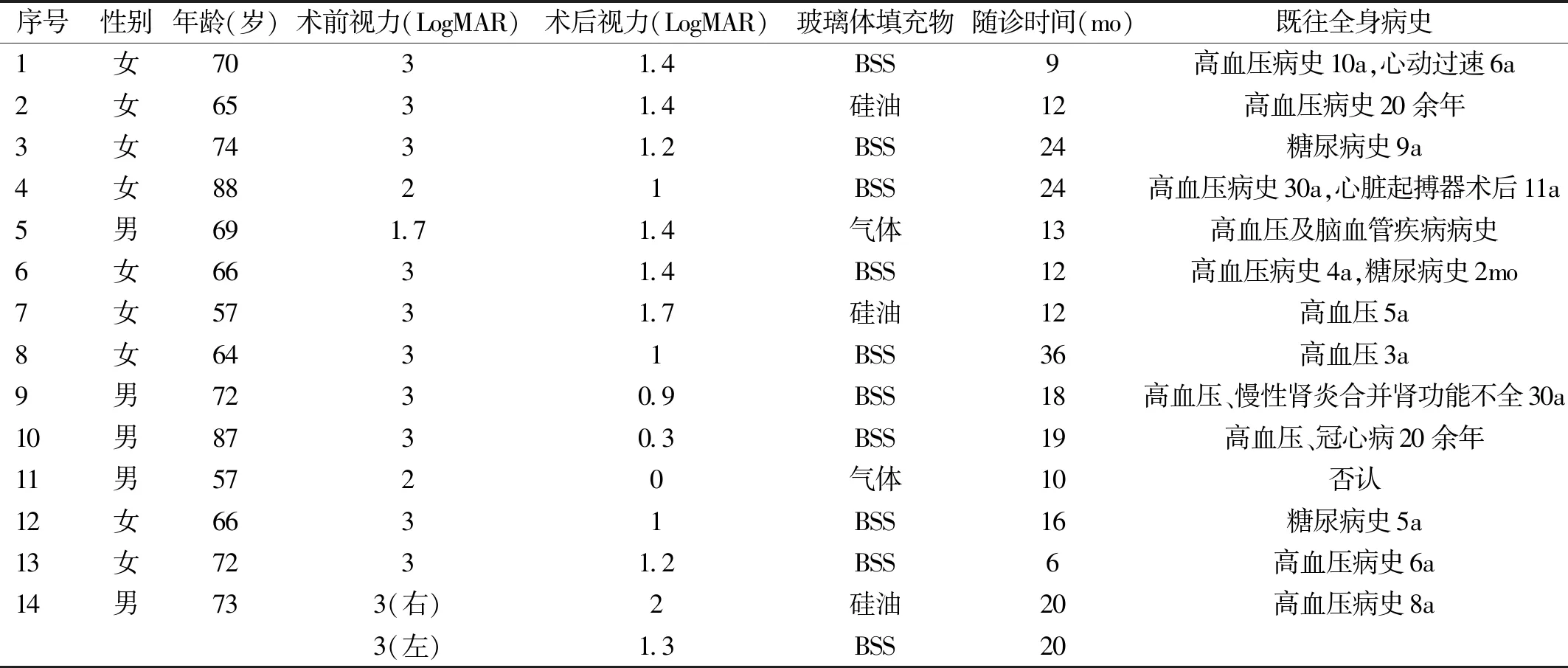
表1 PCV合并VH病例基本情况
1 对象和方法
1.1对象选择2014-01/2017-12收治于北京爱尔英智眼科医院的PCV合并VH经玻璃体手术治疗的患者14例15眼。其中,9眼术前已确诊为PCV,经FFA/ICGA,发现其眼底息肉样脉络膜血管病变(polypoids)和脉络膜异常血管网(branching vascular network,BVN),经确诊后有7眼接受了玻璃体腔内注入抗血管内皮生长因子(anti-vascular endothelial growth factor,anti-VEGF)类注射剂治疗或/和光动力治疗(photodynamic therapy,PDT)。其余6眼根据术前检查拟诊为PCV合并VH,行玻璃体手术治疗后进行FFA/ICGA检查或/和光学相干断层扫描(optical coherence tomography,OCT)进一步确定PCV的诊断。本研究通过医院伦理委员审批,患者知情同意。
1.2方法术前使用标准对数视力表检查患者最佳矫正视力(BCVA),并行眼压、裂隙灯显微镜、间接检眼镜、B型超声检查,根据屈光间质情况行眼底照相、FFA/ICGA和OCT等检查。所有患者均采用Constellation玻璃体切割手术系统进行常规经睫状体平坦部的闭合式三通道玻璃体手术(pars plana vitrectomy,PPV),切口均采用25G套管。晶状体混浊影响手术操作时手术中同时行白内障超声乳化吸除及人工晶状体植入术。术中切除积血混浊的玻璃体后检查视网膜情况,根据视网膜是否合并裂孔或是否采用视网膜切开方式排除视网膜下积血,来确定玻璃体腔内是否采用填充物。硅油填充者一般在术后2~4mo行硅油取出。术后复诊检查包括:BCVA、眼压、裂隙灯显微镜、间接检眼镜检查。术后获得较好屈光间质清晰度时,进行彩色眼底照相、FFA/ICGA、OCT检查明确诊断及病灶范围,根据病灶情况进行后续治疗,包括玻璃体腔内注入anti-VEGF类注射剂、PDT或热激光治疗。术后随访至少超过6mo。本研究观察指标包括:患者病史信息、BCVA、彩色眼底照相、FFA/ICGA、B超及OCT检查结果。小数视力转换为LogMAR视力便于统计分析,其中指数对应2.0,手动对应3.0[8]。前、末次随访的BCVA转换为LogMAR计算。
2 结果
2.1患者一般情况共14例15眼患者纳入本研究。其中男5例,女9例。患者平均年龄为70±9.1岁。所有病例随访6mo以上,术后平均随访期为16.5±7.83(6~36)mo。患者既往全身病史:既往高血压病史(11例,79%),其中高血压合并心脏病史3例、合并糖尿病史1例、合并脑血管病史1例、合并肾病1例;既往糖尿病史2例;仅1例无明确全身病史(表1)。
2.2病例临床特点在PCV合并VH患者中,双眼发生VH的1例,其余均为单眼发生VH。6眼是以VH为初始表现,否认既往诊断为年龄相关性黄斑变性(age-related macular degeneration,ARMD)或PCV或其他视网膜疾病。其余9眼在诊断为PCV后随访期间出现自发突破性VH,其中1眼除VH外同时合并前房积血、继发性青光眼,这9眼自诊断PCV到出现VH的时间为1mo~10a(平均12.66±32.66mo),而7眼在出现VH之前曾接受玻璃体内注射anti-VEGF类药物治疗或/和PDT治疗,其中,1眼为接受PDT治疗1mo时出现VH,其余均在接受治疗后随访超过3mo以上出现VH。另外2眼未接受治疗。
本研究病例所有眼术前或术后发现均合并有大量的视网膜下出血(subretinal hemorrhage,SRH),范围均超过10视盘直径(disc diameter,DD)以上,其中3例呈现高度隆起的出血性视网膜脱离。视网膜下出血未累及黄斑中心凹1例,余均累及黄斑中心凹。彩色眼底照相或FFA/ICGA结果显示:息肉样脉络膜血管病变或/和BVN位于黄斑中心凹下为6眼,中心凹旁为4眼,中心凹外为5眼。
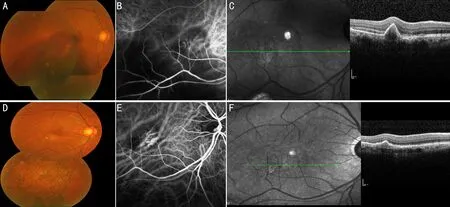
图1典型病例1,57岁男性,右眼视力下降1mo,否认全身病史。BCVA:右眼0.02;左眼1.0,诊断为“右眼PCV”A、B、C:分别为术前右眼VH前的彩色眼底照相、ICGA、OCT图像。眼内注射后3mo发生VH,1mo后行PPV及术后PDT治疗。术后6mo复查:BCVA:右眼1.0,左眼1.0。D、E、F:分别为术后3mo右眼彩色眼底照相、ICGA、OCT图像。
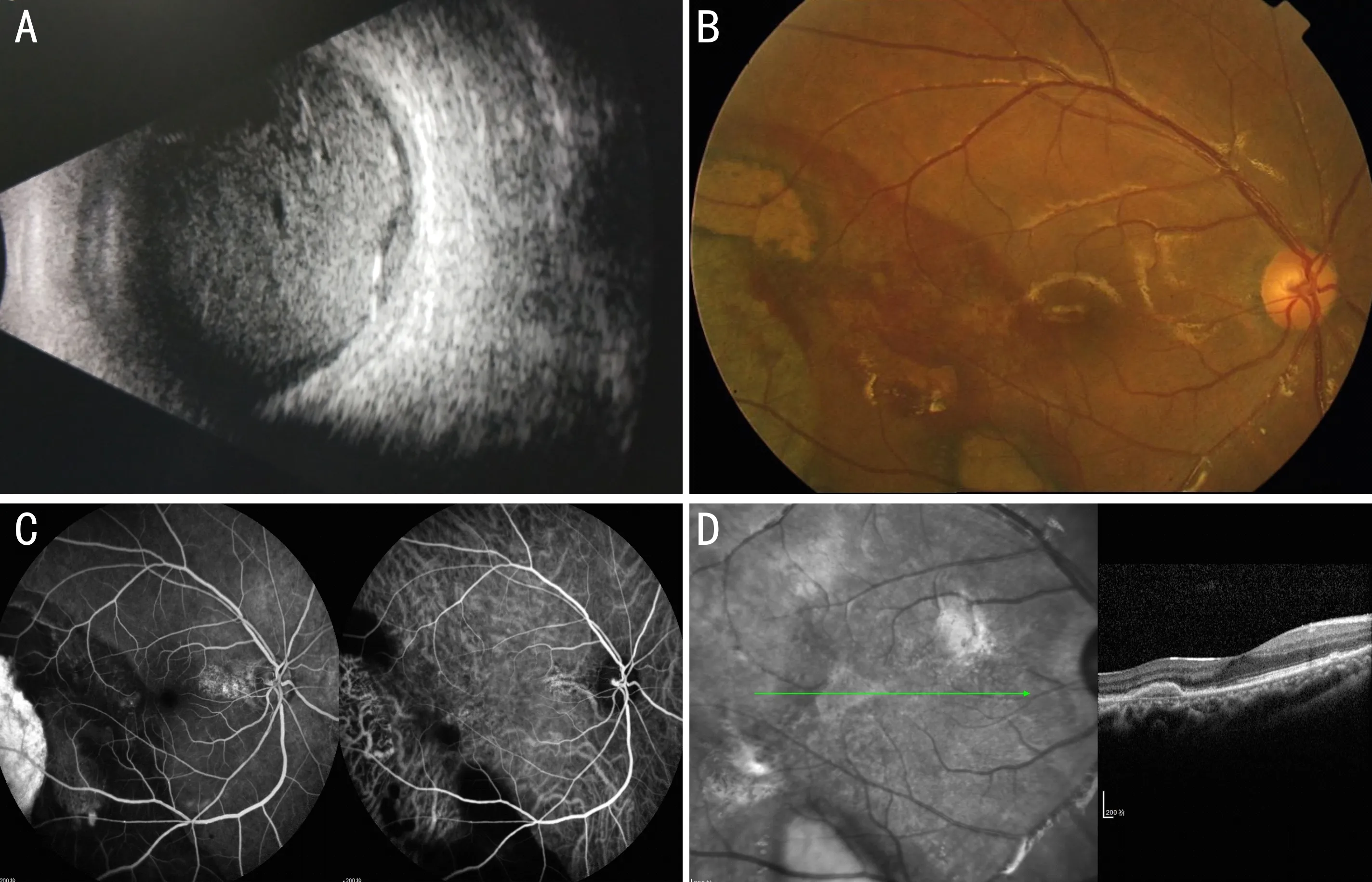
图2典型病例2,72岁男性,右眼突然视力下降1mo余。BCVA:右眼手动。A:右眼术前B超图像,B、C、D:分别为术后1mo随诊时右眼彩色眼底照相、FFA/ICGA、OCT图像。术后6mo复查BCVA:右眼0.12。
2.3病例手术治疗情况接受玻璃体手术治疗的14例15眼患者(典型病例见图1、2),均采用25G微创玻璃体切除手术系统进行常规PPV手术。3眼玻璃体积血合并高度隆起的出血性全视网膜脱离,手术中行周边视网膜切开后清除视网膜下积血,然后行气液交换复位视网膜、激光光凝视网膜切开部位并行硅油填充,术后2~3mo硅油取出,视网膜附着良好。2眼术中行气体填充。余10眼行PPV清除玻璃体积血+玻璃体腔内灌注液填充(balanced salt solution,BSS),其中5眼术中同时行玻璃体内注射anti-VEGF类药物(雷珠单抗/康柏西普眼内注射液)。15眼无术中并发症发生。术后并发症包括:白内障核性混浊加重2眼(观察随访期间未治疗),复发VH 1眼(采取观察1mo后自行吸收),高眼压1眼(术后1mo降眼压滴眼液治疗后逐渐稳定至正常),视网膜脱离0眼。术后随访期间5眼PCV病变活跃,采用重复玻璃体腔内注射anti-VEGF类药物(雷珠单抗/康柏西普眼内注射液),其中1眼联合PDT治疗,1眼联合局灶性视网膜激光光凝治疗。
2.4病例术前术后视力末次随访时,6眼(40%)视力提高且BCVA 0.1或以上。术前BCVA为2.78±0.46,末次随访时间(术后36mo)BCVA为1.15±0.50,术后较术前提高,差异有统计学意义(t=11.14,P<0.01)。
3 讨论
早在1985年文献报道了PCV引起VH[9],但对于PCV合并VH的治疗文献较少,其手术治疗效果报道各异[6,10-11]。PCV患者多在发生视网膜下出血后几周或几个月内发生VH[12],在我们的病例中,9眼在诊断为PCV后的随访期间出现自发性VH。PCV的诊断时间与VH发生时间1mo~10a(平均12.66±32.66mo),较目前报道的发病时间为长,这可能与患者的随诊依从性及人群差异有关。
对于PCV合并VH的治疗,早期的研究报道采用玻璃体手术治疗的患者视力提高不定,但此研究报道病例数较少。但近些年的报道逐渐增加,且大多术后视力较术前有提高。如Jalali等[10]报道了10眼PCV合并VH接受PPV手术治疗,平均随诊19.5mo,术前视力光感,术后为光感~0.8,其中6眼(60%)BCVA>0.05(LogMAR 1.3)。Jung等[4]报道了12眼经PPV手术治疗的PCV合并VH患者,术前视力光感~0.25,术后视力为指数~0.8,其中7眼(54%)>0.05。Lin等[11]报道的17眼PCV合并VH病例中,术前视力光感~0.04,术后手动~0.8,其中8眼(47%)>0.05。在我们的研究中,15眼PCV合并VH均合并大量视网膜下出血,经过玻璃体手术联合眼内注药或激光治疗,术后视力较术前提高,但术后视力恢复个体间差异较大,1眼术后视力提高到1.0(LogMAR 0);1眼0.5(LogMAR 0.3),4眼0.1~0.12,1眼继发性青光眼术后随访视力0.05(LogMAR 1.3),合并糖尿病患者的术后随访平均视力为0.06(LogMAR 1.2),其余低于0.1(高于LogMAR 1.0)。视力的改善主要受到视网膜下出血或PCV的病变部位是否累及到黄斑中心凹的影响。术后40%患眼获得0.1(LogMAR 1.0)或以上的视力,术后获得0.05(LogMAR 1.3)以上视力的占53%,这与国内外近期的一些研究结果相似[13-14]。
目前,对于PCV合并VH的PPV手术治疗病例报道中,主要术中并发症为医源性视网膜裂孔,大多报道认为待VH发生自发性玻璃体后脱离后再进行玻璃体手术治疗,可减少术中医源性裂孔的产生。另外,我们经验认为PCV大多合并浓厚的玻璃体出血机化,为避免切口处套管周的玻璃体嵌顿堵塞,建议先行切口处玻璃体切除,在手术中清除基底部处玻璃体时应注意避免过大负压或过多器械进出玻璃体牵引而造成锯齿缘离断性损伤或周边医源性视网膜裂孔,也可减少术中此类并发症发生。对于大量视网膜下出血是否采取手术中切开视网膜排除视网膜下积血,目前尚无一致观点。在Isizaki等[14]的一组12眼的病例研究报道中,采取了颞侧120°周边视网膜切开取出视网膜下积血和增生膜后激光封闭及硅油填充的方法,除外1眼视力无提高外,其他视力都较术前改善,且3眼获得了0.4以上的视力。在我们的研究病例中,对于脱离较高且术中视网膜下血液化明显的出血性视网膜脱离进行周边视网膜切开吸除视网膜下积血,并进行硅油填充,术后视力较术前提高。但由于此类手术操作的病例较少,未与其他无眼内填充的病例进行对照研究,且行视网膜切开需要一定的手术技巧及经验,不作为首选操作方式。
Chung等[15]的38例回顾性病例研究中,报道高血压是PCV复发视网膜下出血的一个危险因素(3.9倍)。我们的研究中,PCV合并VH的患者79%患有高血压病史,提示高血压可能是PCV合并VH的一个危险因素。另外也有报道玻璃体出血发生在PDT治疗或眼内注药(抗新生血管内皮因子类药物)后[16-17]。我们的病例中7眼术前接受PDT和/或眼内注药治疗,随访中仅1眼在PDT治疗1wk后突然发生玻璃体出血,其余病例随访发生VH与治疗时间间隔超过3mo或以上,但由于本研究中病例数少,所以不能确定PDT是发生VH的一个诱因。
另外,以往的研究表明,以视网膜下出血为主要表现的PCV与无视网膜下出血的PCV表现为不同的临床过程,其中一个主要特点是在大量视网膜下出血的PCV病例中,病变再次活动的发生率明显较低[18-19]。在我们的这组观察病例中,所有VH病例均合并大量视网膜下出血(范围超过10DD),术后只有1例发生再次玻璃体出血,余病例术后视力相对较为稳定。目前认为大量视网膜下出血可导致视网膜组织广泛损伤,视网膜组织对营养和氧气需求减少,从而引起组织中VEGF的分泌可能已经减少,从而降低PCV病变的再次活跃[18]。最近一项研究也表明了视网膜下出血吸收后外层视网膜显著变薄,视网膜下出血同时也是PCV病变纤维化瘢痕的一个危险因素[20-21]。
本研究也存在一些不足之处,病例样本量较少、为病例回顾性分析,可能存在潜在混杂因素使研究结果有一定的局限性,需要进一步大样本的临床资料深入研究探讨PCV合并VH的手术治疗效果、手术技巧及病例特点。

