Graves 病131I治疗后发生甲减的影响因素
马玉琴,密继清,张霞
山东省地方病防治研究所,济南 250014
甲状腺弥漫性肿大伴甲状腺功能亢进症,又称Graves病,是甲状腺功能亢进(甲亢)的主要病因,近年来我国发病率呈上升趋势。放射性碘131(131I)治疗是其主要治疗方法之一,但131I治疗后甲状腺功能减退症(甲减)难以避免,甲减的发生率每年5%左右,10年可达40%~70%[1]。如何降低131I治疗后甲减的发生率是研究热点,但其与自身免疫性甲减(由于甲状腺腺体自身免疫损伤引起的甲减)病情的区别目前相关报道较少。2019年3月,我们对Graves病患者131I治疗后甲减与治愈及自身免疫性甲减病情进行了分析。现报告如下。
1 资料与方法
1.1 临床资料 选择2014年1月~2018年12月于甲状腺疾病防治中心就诊的甲状腺功能减退症(甲减)患者901例,诊断标准参照中国甲状腺疾病诊治指南[2]确诊。其中Graves 病131I治疗后甲减患者235例(131I疗后甲减组),自身免疫性甲减患者666例(自身免疫性甲减组)。131I疗后甲减组纳入标准:①131I治疗前符合 Graves 病诊断标准[3];无放射性131I治疗禁忌证;131I治疗相关资料完整;②均于2013年1月之前行131I治疗,定期随访,未辅助抗甲状腺药物(ATD)治疗或已停ATD 3个月以上;131I治疗后发生甲减并替代治疗、定期随访1年以上,随访资料完整;③剔除有甲亢手术治疗史、多次131I治疗史或怀疑伴发甲状腺肿瘤者。自身免疫性甲减组纳入标准:①符合指南[2]中甲减的诊断标准,无甲状腺手术史、放射性治疗史、含碘药物治疗史等;②替代治疗并定期随访1年以上,随访资料完整;③剔除年龄<19岁患者,以便与Graves 病131I治疗后患者年龄有可比性。选择同期Graves 病131I治疗后甲状腺功能正常患者290例(131I治愈组)作为对照,纳入标准:①131I治疗前符合 Graves 病诊断标准[3];无放射性131I治疗禁忌证;131I治疗相关资料完整;②均于2013年1月之前行131I治疗,定期随访,未辅助抗甲状腺药物(ATD)治疗或已停ATD 3个月以上,甲功正常1年以上且查血3次以上,每次甲功三项(TSH、FT3、FT4)结果均在正常范围内,无相关症状体征,随访资料完整;③剔除有甲亢手术治疗史、多次131I治疗史或怀疑伴发甲状腺肿瘤者。
1.2131I个体化小剂量治疗方案131I治疗用量=计划量×甲状腺重量÷甲状腺最高摄碘率,计划量按每克甲状腺组织70~100 μCi(2.59~3.7 MBq),结合年龄、病程、甲亢程度、生物半衰期上下浮动,甲状腺重量估算采用B超与触诊相结合。患者131I治疗用量于早晨一次性空腹口服,服后2 h进食。
1.3 甲状腺摄碘率(RAIU)及生物半衰期测定方法 患者检查前禁食含碘丰富的食物及药物1个月,检查日早晨空腹口服131I 3 μCi,服后2 h进食,分别于3、6、24、48、72 h检测颈前甲状腺肿大最明显处。检测仪器为MN-6110甲状腺功能测定仪。
1.4 血清甲功三项及自身抗体检测方法 血清甲功三项(TSH、FT3、FT4)及自身抗体(TGAb、TPOAb)测定均采用化学免疫发光法,分析仪及试剂盒均由贝克曼公司提供;自身抗体同步进行半定量测定(TGAb、TMAb),试剂由天津协和医药有限公司提供, TGAb>30%为阳性 ,>60%为强阳性;TPOAb>20%为阳性,>60%为强阳性。
1.5 甲减替代治疗方法 均采用左旋甲状腺素片(优甲乐,德国默克公司)50 μg /片剂型,初始剂量25 μg/d,根据病情递增,早晨空腹顿服每日用药量;待甲减病情稳定,服用某药量3~6个月,期间查血2~4次,每次甲功三项(TSH、FT3、FT4)结果均在正常范围内,则确定该药量为优甲乐替代治疗维持量。
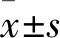
2 结果
2.1 三组性别、年龄对比分析 自身免疫性甲减组、131I疗后甲减组、131I治愈组女性占比分别为96.7%(644/666)、78.3%(184/235)、78.3%(227/290),年龄分别为19~82(41.78±12.87)、21~77(43.06±11.62)、19~67(36.91±10.10)岁,自身免疫性甲减组、131I疗后甲减组、131I治愈组年龄≤25岁者占比分别为11.3%(75/666)、5.1%(12/235)、12.1%(35/290),年龄26~50岁者占比分别为64.3%(428/666)、68.1%(160/235)、77.9%(226/290),>50岁者占比分别为26.8%(63/235)、24.5%(163/666)、10.0%(29/290),自身免疫性甲减组女性占比高于131I疗后甲减组(P<0.05),两组间年龄差异无统计学意义,但>50岁者比例自身免疫性甲减组高于131I疗后甲减组(P<0.05)。131I疗后甲减组与131I治愈组年龄比较差异有统计学意义(P<0.05),而女性占比两组间比较无统计学差异,131I疗后甲减组>50岁者占比高于131I治愈组(P=0.000)。
2.2 三组甲状腺自身抗体水平对比分析131I疗后甲减组、自身免疫性甲减组、131I治愈组TGAb水平分别为(26.41±24.85)%、(37.37±25.62)%、(31.87±25.89)%,TGAb阳性率分别为36.2%(85/235)、55.7%(371/666)、46.2%(134/290),TGAb强阳性率分别为14.9%(35/235)、24.2%(161/666)、18.3%(53/290),TMAb水平分别为(22.20±21.32)%、(29.27±21.10)%、(26.94±22.18)%,TMAb阳性率分别为43.0%(101/235)、60.5%(403/666)、53.1%(154/290),TMAb强阳性率分别为8.5%(20/235)、10.5%(70/666)、9.3%(27/290)。131I疗后甲减组自身抗体(TGAb、TMAb)均值、阳性率及TGAb强阳性率均低于自身免疫性甲减组(P均=0.000);自身抗体(TGAb、TMAb)均值、阳性率低于131I治愈组(P均<0.05),三组TMAb强阳性率比较,P均>0.05。
2.3131I疗后甲减组与自身免疫性甲减组优甲乐替代治疗维持药量对比分析131I疗后甲减组与自身免疫性甲减组优甲乐每日替代治疗维持药量分别为(63.96±27.85)、(62.63±29.81)μg/d,其中≤50 μg /d者占比分别为50.4%(119/235)、53.0%(353/666),50~100 μg /d者占比分别为41.5%(98/235)、39.0%(260/666),>100 μg /d者占比分别为8.1%(19/235)、8.0%(53/666),两组优甲乐替代治疗维持量均值及各剂量段占比差异均无统计学意义(P均>0.05)。所有甲减患者中优甲乐替代治疗维持药量≥150 μg/d者10例,其中女7例,年龄32~70(50.6±14.5)岁,均在自身免疫性甲减组。
2.4 Graves 病131I疗后甲减组与131I治愈组摄碘率、生物半衰期及131I治疗量比较 见表1。131I治疗后甲减组与治愈组6/24 h摄碘率比<0.8者占比分别为9.4%(22/235)、2.4%(7/290),6/24 h摄碘率比0.8~1.0者占比分别为55.7%(131/235)、52.1%(151/290),6/24 h摄碘率比≥1.0者占比分别为34.9%(82/235)、45.5%(132/290),131I治愈组6/24 h摄碘率比≥1.0者占比高于131I疗后甲减组(P<0.05)。
3 讨论
Graves病是临床常见的自身免疫性甲状腺疾病(AITD),女性患病率为男性的5~10倍。目前临床上主要采用ATD、131I和手术治疗,三种治疗方法各有利弊。研究显示,Graves病采用131I 治疗与采用ATD治疗的治愈率分别为69.9%和41.2%,甲减发生率分别为21.5%和9.0%[4]。

表1 Graves 病131I疗后甲减组与131I治愈组摄碘率、生物半衰期及131I治疗量比较
成人甲减的最常见病因是自身免疫性甲状腺炎,在中老年人群中发病率较高。本研究资料显示,Graves 病131I疗后甲减组较自身免疫性甲减组女性占比高,且高于文献[5]报道。131I疗后甲减组与自身免疫性甲减组年龄均值均>40岁,显著高于131I治愈组,>50岁患者占比高于131I治愈组,说明年龄是AITD发展至甲减的重要因素,亦是131I治疗后甲减的主要影响因素,与周敏等[6 ]研究结果一致。美国临床内分泌医师学会(AACE)建议在老年人群中进行 TSH常规检测,尤其是女性[7]。
现已证实 TPOAb/TMAb、TGAb均是AITD重要的自身抗体,通过激活细胞毒作用或杀伤细胞引起甲状腺滤泡损伤,致甲状腺功能改变。本组资料显示,自身免疫性甲减组自身抗体水平和阳性率均高于Graves病131I疗后甲减组和131I治愈组,说明甲状腺自身抗体是自身免疫性甲减的主要发病因素。而131I疗后甲减组自身抗体水平均值及阳性率均低于131I治愈组,强阳性率两组差异无统计学意义,与王朝栋等[8]研究结果一致,说明自身抗体阳性不是Graves病131I治疗后发生甲减的主要原因。本研究结果与陈永辉等[9]研究结果不同,可能与本研究资料131I疗后甲减组随访时间较长有关系。
目前各种原因导致的甲减均采用替代治疗。英国甲状腺学会(BTA)[5]和中华医学会内分泌学分会(CSE)等均推荐左旋甲状腺素(L-T4)为甲减的首选治疗药物。L-T4为人工合成的四碘甲状腺原氨酸钠(T4),由于人体不能区分内源性和外源性的L-T4,所以该药可与内源性激素一样在人体内发挥特定作用。在甲状腺功能基本缺失的情况下,成人L-T4替代剂量约为每日1.6 μg/kg[10]。本组资料显示,Graves 病131I疗后甲减组与自身免疫性甲减组L-T4(优甲乐)替代治疗维持药量均值及各剂量段占比差异均无统计学意义。两组甲减患者优甲乐维持药量≤50 μg/d者均占半数以上,由此可推算出,半数以上患者只有部分甲状腺功能损伤,完全甲状腺功能缺失者或优甲乐治疗效果不理想者(用药量>100 μg/d)在本研究资料中只有10例,且均为自身免疫性甲减患者。
尽管131I治疗Graves甲亢指南[11]中认为,不存在既可纠正甲亢又不会造成甲减的理想剂量,大部分患者最终会出现甲减,但临床医师仍在全力降低甲减的发生率。本组资料中Graves病131I治疗均采用个体化小剂量方案,目的是降低甲减的发生率。分析结果显示,131I治愈组的131I治疗量高于131I疗后甲减组,131I疗后甲减组与131I治愈组24 h摄碘率差异无统计学意义;说明131I治疗量及24 h摄碘率不是Graves 病131I治疗后远期预后的影响因素,只是近期预后的影响因素[12]。131I治愈组6/24 h摄碘率比高于131I疗后甲减组,生物半衰期低于131I疗后甲减组,差异有统计学意义;说明6/24 h摄碘率比、生物半衰期与远期预后关系密切,131I治愈组6 h摄碘率升高及峰值前移(比值≥1.0部分)比例增高,与生物半衰期均值缩短一致,说明临床可用6/24 h摄碘率比代替生物半衰期检测,使131I治疗前检查时间由3 d缩短为1 d,与曾昭辉等[13]研究结果一致。张建阳等[14]研究显示,6/24 h 摄碘率比>1时,131I治愈率不足50%,超过半数的Graves病患者需多次131I治疗。而本组资料131I治愈组6/24 h摄碘率比≥1.0部分占比(45.5%)高于131I疗后甲减组(34.9%),可能与本组资料中采用131I治疗患者的生物半衰期不少于3.5 d有关。故若以6/24 h摄碘率比代替生物半衰期检测,以选择比值在0.8~1.0者为宜,对于比值>1者,需检测生物半衰期。
综上所述,甲状腺自身抗体(TGAb、TMAb)水平升高是自身免疫性甲减的主要因素,不是Graves 病131I治疗后发生甲减的主要因素;131I疗后甲减的L-T4替代治疗维持药量与自身免疫性甲减相同;年龄、6/24 h摄碘率比、生物半衰期是131I疗后甲减的主要影响因素,而与131I治疗剂量无关。

