锡林郭勒地区紫花苜蓿根腐病原菌的分析
李春冬 徐伟良 王润元 郭梁
摘 要:为鉴定锡林郭勒盟白音锡勒地区紫花苜蓿根腐病的致病菌,采用组织分离法获得可培养致病菌群,基于16S rDNA对细菌进行种属分析,基于ITS对真菌进行种属分析。结果表明:在紫花苜蓿根腐部分离鉴定的19株细菌中有6株成团泛菌(Pantoea agglomerans)和6株假单胞菌属(Pseudomonas baetica);所分离的19株真菌中有13株织球壳菌(Plectosphaerella cucumerina)。通过相关文献的分析推测优势细菌成团泛菌和优势真菌织球壳菌为引起紫花苜蓿根腐病的主要病原菌。本研究通过微生物的分离和鉴定揭示锡林郭勒盟白音锡勒地区紫花苜蓿可培养病原菌种类,以期为当地紫花苜蓿根腐病害的诊断和防治提供理论依据。
关键词:
紫花苜蓿;根腐病;16S rDNA序列;ITS序列
中图分类号:S-3
文献标识码:A
DOI:10.19754/j.nyyjs.20200315005
紫花苜蓿(Medicago sativa),属于蔷薇目、豆科、苜蓿属,为多年生草本植物[1]。紫花苜蓿是我国种植面积最广泛的优质牧草,具有较强抗旱、抗寒、耐盐、耐风沙、耐贫瘠等能力,富含蛋白质、矿物质、多种氨基酸、维生素和胡罗卜素[2-4]。近年来由于我国大力发展畜牧业,带动了牧草产业的迅速发展,促使了紫花苜蓿集约化种植面积的不断增加[5]。随着紫花苜蓿种植面积的进一步扩大,伴随而来的病害问题也极大地制约了其产品的质量。紫花苜蓿病害部位主要包括茎部、叶部和根部。根部病害与茎部和叶部病害不同,根部是参与体内物质的吸收、合成和转化的重要部位。由于根部病害在初期不易被察觉,在诊断上比较困难,一旦根部染病对紫花苜蓿的危害一般是不可挽回的。紫花苜蓿致病微生物有真菌、细菌、病毒和菟丝子害4大类,其中真菌病害最为普遍,对生产的危害最大可达总病原菌的86.6%[6]。然而,目前还没有针对根腐病的有效预防方法。因此紫花苜蓿病原菌的研究对其产品的开发和生态环境的保护有着重大的意义。
紫花苜蓿根腐病原菌的分类与鉴定通常采用经典形态学方法,根据致病微生物的形态、生长特点和孢子的结构等特征来进行分类鉴定[7]。王多成等按照柯赫证病律对在甘肃张掖和酒泉市采集的苜蓿根腐病原菌进行病原物分离、鉴定[8]。然而,紫花苜蓿的致病菌种类众多,种间形态特征相似难以区分,依靠形态学方法鉴定实验操作复杂,检测周期长,需要专业操作人员,而且并非所有植物的病原菌都能直接通过形态学特征鉴定[9]。因此,需要一种快速、准确、灵敏性高,并且能够对大量样品进行鉴定的方法。而脱氧核糖核酸(DNA)作为遗传物质包含有全部遗传信息,是非常理想的基因标记手段,能够很好地进行物种标记,利用以聚合酶链式反应(polymerase chain reaction,PCR)为基础的各类分子检测方法对其扩增基因分析后,可以准确地对植物病原菌进行分类鉴定,能够更加客观、全面地从本质上区分各种病原菌,使植物真菌病害的鉴定工作更加高效、准确[10]。因此,分子技术手段在植物病理研究方面有着良好的应用前景。柏玉晶等对甘肃省武威市紫花苜蓿根腐病菌进行分离,运用分子鉴定方法对致病性最强的菌株进行了鉴定[11];梁嘉俊等对陕西省4个区县的36株紫花苜蓿根腐病原菌利用PCR方法进行了分离鉴定[12]。
近些年,虽有学者对内蒙古自治区呼和浩特市、巴彦淖尔市临河区和赤峰市阿鲁科尔沁旗苜蓿根腐病病原菌进行鉴定和分析[13-15],但对锡林郭勒盟地区紫花苜蓿根腐病原菌的研究还未见报道。为明确锡林郭勒盟白音锡勒部分地区紫花苜蓿根腐病原菌的主要种类及优势致病菌群组成,本研究通过对当地主要紫花苜蓿种植区的受害苜蓿进行样品采集并分离病原菌,运用分子检测方法对病原菌进行鉴定,初步明确了该地区紫花苜蓿根腐病原菌种类,以期为当地紫花苜蓿生产中根腐病害的诊断和防治提供理论依据。
1 实验器材与试剂
1.1 材料
于2019年6月自锡林郭勒盟白音锡勒地区采集的紫花苜蓿根腐病样,共3份。
1.2 培养基
马铃薯葡萄糖琼脂培养基(PDA):马铃薯切片200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 L,pH7.0[16]。
牛肉膏蛋白胨琼脂培养基:牛肉膏5 g、蛋白胨10 g、氯化钠5 g、琼脂15 g、蒸馏水1 L,pH7.0。
1.3 试剂
Takara快速提取试剂盒(Code No.9164);Takara Mini BEST Agarose Gel DNA Extraction Kit Ver.4.0(Code No.9762);乙醇为国产分析纯。
1.4 仪器与设备
电子天平FA2004N,SW-J-2FD净化工作台,HWS-250BX恒温恒湿培养箱,2720 Thermal Cycler PCR扩增仪,5418R台式高速离心机,WD-9413B凝胶成像仪,琼脂糖凝胶电泳系统。
2 实验方法
2.1 紫花苜蓿病变组织致病菌分离
采用常规组織分离方法采集紫花苜蓿病变组织,先用75%酒精对紫花苜蓿表面进行消毒(或用手术刀刮除表面多余土壤),再用灭菌手术刀挑出内部病变组织样品,使用灭菌镊子夹取病变组织于灭菌生理盐水中,置于摇床上室温150 rpm振荡20 min,使病变组织与生理盐水充分混合,将微生物细胞从病变组织中充分分散至生理盐水中,从而得到病原菌悬液。
2.2 紫花苜蓿病原菌的分子鉴定
2.2.1 DNA提取
紫花苜蓿病原菌总DNA使用Takara快速提取试剂盒对其进行提取。取40 μL Lysis Buffer for Microorganism to Direct PCR试剂于灭菌的PCR管中,吸取10 μL制备的病原菌悬液,置于PCR管中并吸打混匀,将PCR管置于金属浴上80℃热处理15min,8000 rpm低速离心5min得到上清液,上清液即为致病菌基因组总DNA,将DNA吸出置于新的EP管中,作为PCR反应模板。
2.2.2 病原菌16S rDNA和ITS序列分析
反应体系为:模板DNA 2μL、引物各2μL、ddH2O 14μL、EasyTaq PCR Super Mix 20 μL。
细菌选用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1495R(5'-CTACGGCT ACCTTGTTACGA-3')。PCR反应条件为:94℃预变性5min;94℃变性1min,58℃退火1min,72℃延伸2min,共30循环;72℃末端延伸10min。
真菌选用通用引物ITS1(5'-TCCG TAGGTGAACCTGC GG-3')和ITS4(5'-TCCTCC GCTTATTGAT ATGC-3')。PCR反应条件为:95℃预变性 5min;95℃变性1min,55℃退火1min,72℃延伸1min,共30循环;72℃加强延伸1min。PCR扩增结果用1.2%琼脂糖凝胶电泳检测。
2.2.3 序列测定
PCR扩增产物使用Takara试剂盒(MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0)进行回收。将回收的PCR产物送至北京睿博生物科技有限公司进行测序。测序结果经拼接后在美国国立生物技术信息中心(national center for biotechnology information,NCBI)进行BLAST同源比对。选取最相近的序列,根据对比结果在NCBI数据库中下载标准菌株序列,用MEGA5软件进行同源性分析构建系统进化树。
2.3 紫花苜蓿致病菌的分離培养
取处理好的1g样品放入盛有9mL灭菌生理盐水的试管中,置于摇床上室温150 rpm振荡20min。震荡后使用移液枪吸取1mL,进行梯度稀释。细菌稀释梯度为10-3~10-5;真菌稀释梯度为10-2~10-4。稀释过的菌液使用移液枪吸取200μL分别在牛肉膏蛋白胨琼脂和PDA 2种平板培养基上进行涂布,待完全涂匀后倒置培养,牛肉膏蛋白胨琼脂平板置于37℃恒温培养箱中,厌氧培养2~3d;PDA平板置于30℃恒温培养箱中,培养3~5d,观察菌落生长状况。
2.4 分离菌种的分子鉴定
培养完成后挑选适合稀释梯度培养基,在牛肉膏蛋白胨琼脂和PDA培养基上分别挑取不同外观形态的菌落,每个样品挑取8个菌落(细菌命名为:MB-31~38、MB-41~38、MB-51~58;真菌命名为:MF-31~38、MF-41~38、MF-51~58)。将挑取的菌落置于盛有20 μL Lysis Buffer for Microorganism to Direct PCR试剂的灭菌PCR管中进行DNA的提取,将PCR管置于金属浴上80℃热处理15min,8000 rpm低速离心5min得到上清液,上清液即为致病菌基因组总DNA,将DNA吸出置于新的EP管中,作为PCR反应的模板。细菌和真菌PCR扩增同“2.2.2”反应条件。PCR产物测序方法同“2.2.3”反应条件。
3 结果与分析
3.1 紫花苜蓿病原菌总DNA测定结果
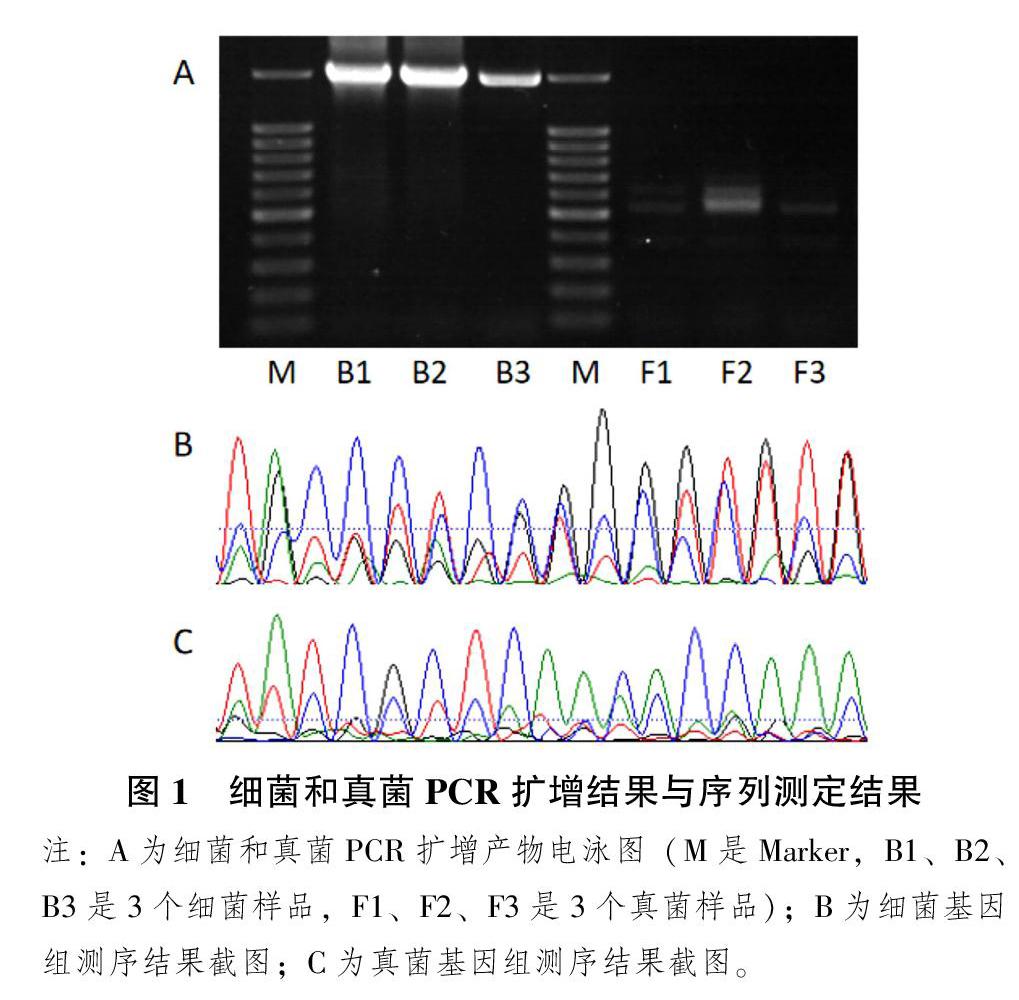
采用Takara快速提取试剂盒对紫花苜蓿病原菌总DNA进行提取,细菌以27F/1495R为引物,真菌以ITS1/ITS4为引物,用1.2%琼脂糖凝胶电泳检测PCR扩增的效果,结果如图1A所示,发现B1、B2、B3经过PCR扩增反应得到1500 bp处有1条清晰条带,符合27F/1495R为引物的目的条带大小;F1、F2、F3可知真菌PCR扩增在550 bp处有条带,特别是F1有2条条带,证明紫花苜蓿病原菌中真菌种类并不单一。
由图1B和1C可知,细菌和真菌测序结果均含有双峰和杂峰,说明紫花苜蓿的病原菌皆不是单一的细菌或真菌。因此,还需对紫花苜蓿致病菌的真菌和细菌进行分离培养,进一步对所纯化的菌株进行鉴定。
3.2 紫花苜蓿病原菌分离培养结果
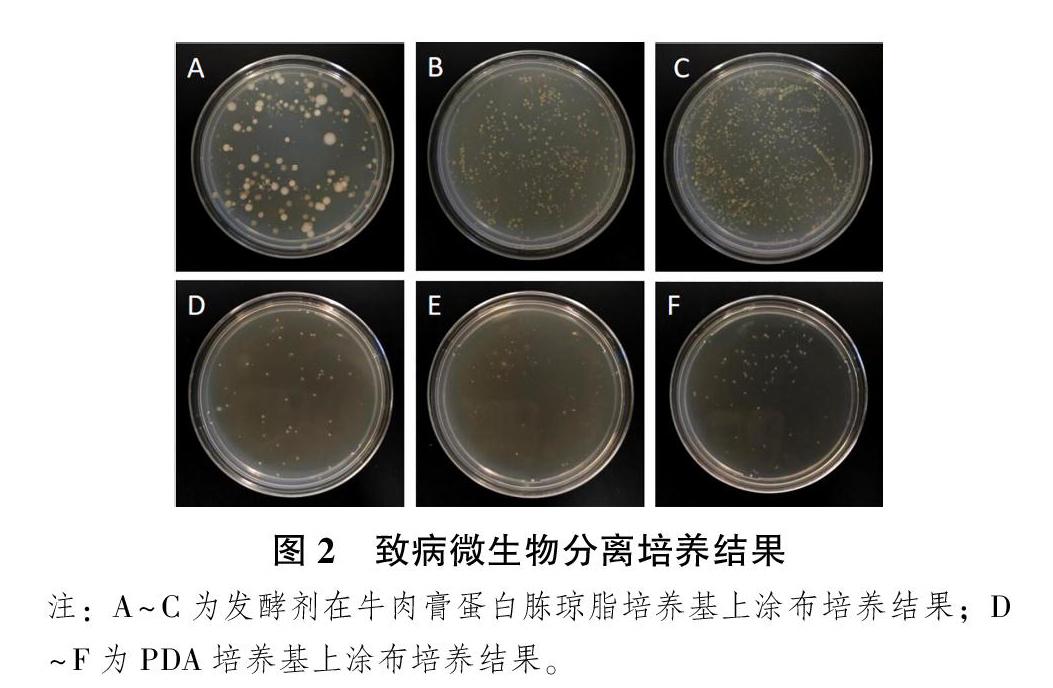
将梯度稀释好的病原菌菌液取100 μL,均匀涂布在牛肉膏蛋白胨琼脂和PDA培养基上,进行病原菌分离培养,培养结果如图2。由图2可知,紫花苜蓿致病微生物在牛肉膏蛋白胨琼脂和PDA培养基上均生长旺盛,但培养基上菌落形态不一,说明培养基上细菌和真菌的种类并不单一,这与“3.1”总DNA测定的结果相同,因此,还需进一步对纯化培养的菌株进行基因测定。
3.3 发酵剂菌种序列鉴定结果
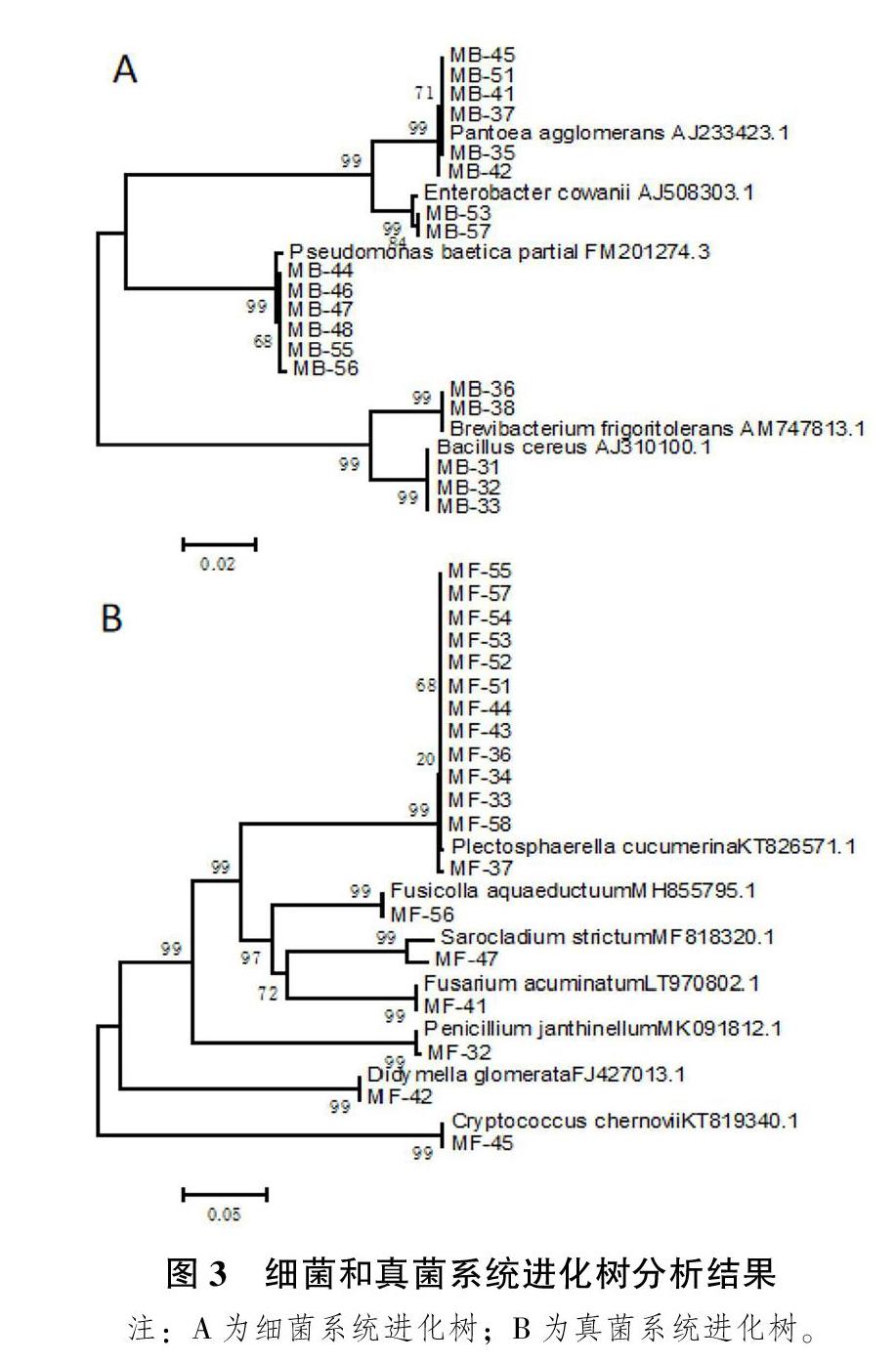
根据菌落外观形态的不同,每个样品细菌和真菌各挑取8个菌落,进行DNA提取和PCR扩增,并经1.2%的琼脂糖凝胶电泳检测后,将样品送至北京睿博生物科技有限公司进行测序。测序结果经拼接后在NCBI数据库中进行BLAST同源比对,19个细菌单菌株(MB-34、MB-43、MB-52、MB-54和MB-58条带未能回收)和19个真菌单菌株(MF-31、MF-35、MF-38、MF-46、MF-48条带未能回收)ident均大于98%,通过MEGA 5软件与相似度最高的标准菌株序列构建系统发育树。
如图3A可知,细菌19个菌株分为5个不同属:菌株MB-35、MB-37、MB-41、MB-42、MB-45和MB-51为泛菌属的成团泛菌(Pantoea agglomerans),菌株MB-53和MB-57为肠杆菌属的Enterobacter cowanii,菌株MB-44、MB-46、MB-47、MB-48、MB-55、MB-56为肠杆菌属的Enterobacter cowanii,菌株MB-36和MB-38为短杆菌属的Brevibacterium frigoritolerans,菌株MB-31、MB-32和MB-33为芽孢杆菌属的蜡样芽胞杆菌(Bacillus cereus)
如图3B可知,真菌19个菌株分为7个不同属:菌株MF-33、MF-34、MF-36、MF-37、MF-44、MF-51、MF-52、MF-53、MF-54、MF-55、MF-57和MF-58为织球壳菌(Plectosphaerella cucumerina)、菌株MF-32为微紫青霉(Penicillium janthinellum)、菌株MF-45为隐球酵母属(Cryptococcus chernovii)、菌株MF-47为帚梗柱孢属(Sarocladium strictum)、菌株MF-56为Fusicolla aquaeductuum、菌株MF-41为镰刀菌属(Fusarium acuminatum)、菌株MF-42为亚隔孢壳属(Didymella glomerata)。
如图4可知,细菌Pantoea agglomerans和Pseudomonas baetica所占比例最高均为细菌优势菌;真菌Plectosphaerella cucumerina所占比例最高为真菌优势菌。
4 结论与讨论
从紫花苜蓿根腐组织分离的19株细菌大多数属于成团泛菌(P. agglomerans)和假单胞菌属(P. baetica),其次是蜡样芽胞杆菌、肠杆菌属(E. cowanii)和短杆菌属(B. frigoritolerans)。据报道成团泛菌是引起苜蓿细菌性顶腐病病原菌之一[17]。未见假单胞菌属的P. baetica在紫花苜蓿上分离的报道,只有López等在比目鱼中分离了鱼类致病性病原菌[18]。黄科等从重庆地区蓝莓园的发病蓝莓叶片上分离得到1株蜡样芽胞杆菌(B. cereus),研究表明B. cereu可以引发蓝莓叶枯病[19]。Furtado等在马槟榔的斑点上分离得到了肠杆菌属,通过研究发现E. cowanii可引起植物幼苗叶斑病[20]。石青研究发现在黄顶菊根际土壤中分离耐旱短杆菌(B. frigoritolerans)可以对尖孢镰刀菌有抑制作用,B. frigoritolerans是植物根际促生菌[21]。综上所述,优势细菌成团泛菌(P. agglomerans)具有导致苜蓿根腐病的潜能。
从紫花苜蓿根腐组织分离的19株真菌大多数属于织球壳菌(P. cucumerina),其次是微紫青霉菌(P. janthinellum)、隐球菌酵母属(C. chernovii)、直帚枝杆孢(S. strictum)、Fusicolla aquaeductuum、锐顶镰刀菌(F. acuminatum)和茎枯病菌(D. glomerata)。徐婧等在辽宁省葫芦岛地区番茄病株上分离的P. cucumerina可引起植株萎蔫和根部腐烂[22]。谢君对在三年生健康三七根部分离的P. janthinellum进行研究,发现P. janthinellum代谢产物对三七的致病菌Alternaria brassicicola、Cylindrocarpon destrucctans和Fusarium solani均有不同程度的抑制活性[23]。Ziauddin等在儿童急性淋巴细胞白血病患者鼻腔标本培养物中分离得到C. chernovii,通过研究发现C. chernovii对卡泊芬净、阿尼芬净、5-氟胞嘧啶和伊曲康唑有抗性,但对两性霉素B、泊沙康唑和伏立康唑敏感[24]。胡兰等在辽宁省农科院试验地的高粱发病株中分离纯化出直帚枝杆孢(S. strictum),通过实验证明S. strictum可侵染高粱和玉米,并通过土壤和种子带菌为主要侵染途径引起黑束病[25]。Huang等在中国淡水环境中的真菌进行分离鉴定,首次报道了Fusicolla aquaeductuum[26]。易铭等在陕西省榆林市定边县牧草种植基地采集的紫花苜蓿植株根部分离得到根腐病病原菌锐顶镰刀菌,经EF-1α序列分析鉴定及正常紫花苜蓿根部接种试验发现发病症状与田间根腐病发病一致[27]。张宇等对美国进境的进口高粱种子上病原菌进行分离,得到1株茎枯病菌,致病性测试结果表明D. glomerata能够引起高粱和小麦的叶部感染[28]。综上所述,真菌织球壳菌(P. cucumerina)和锐顶镰刀菌(F. acuminatum)具有导致苜蓿根腐病的潜能。又因为本研究紫花苜蓿根腐症状主要为病株根系发育不良,侧根减少,组织坏死导致植株萎蔫,叶片自上而下干枯,最终影响植株的根部发育,降低根系对营养和水分吸收而导致植株萎蔫或死亡,这与徐婧报道的织球壳菌导致番茄萎蔫病症状相类似[29]。由于本研究在锡林郭勒地区紫花苜蓿根腐部位分离所得到,又根据文献分析推测优势细菌成团泛菌(P. agglomerans)和优势真菌为织球壳菌(P. cucumerina)为苜蓿根腐病的主要致病菌。
参考文献
[1]
罗英花,敬雪敏,许美花,等. 紫花苜蓿镰刀菌根腐病的研究进展[J].当代畜牧,2019(04):39-40.
[2]李天银,陈录庆,张晓生,等. 紫花苜蓿不同品种在甘肃张掖地区的适应性研究[J].中国奶牛,2019(05):57-61.
[3]张立全,贾旭慧,赵静玮. PEG模拟干旱胁迫对紫花苜蓿种子发芽及幼苗生长的影响[J/OL].分子植物育种,http://kns.cnki.net/kcms/detail/46.1068.S.20190528.1539.014.html.2019-07-16.
[4]王艷,马欣荣,陶向,等. 比较转录组学研究 ABA 对番茄抗病基因的影响[C]. 中国遗传学会.中国遗传学会全国会员代表大会暨学术研讨会论文摘要汇编(2009—2013).中国遗传学会:中国遗传学会,2013:93-94.
[5]张少平,耿小丽,李德明,等. 9个国产优良紫花苜蓿品种在甘肃河西地区引种栽培研究[J].中国草食动物科学,2019,39(02):33-36,41.
[6]常根柱,师尚礼. 优质苜蓿品种及栽培关键技术[M].北京:中国三峡出版社,2006.
[7]彭丹丹,张源明,舒灿伟,等. 植物病原真菌分子检测技术的研究进展[J].基因组学与应用生物学,2017,36(05):2015-2022.
[8]王多成,孟有儒,李文明,等. 苜蓿根腐病病原菌的分离及鉴定[J].草业科学,2005(10):78-81.
[9]段维军,严进,蔡磊,等. 我国进境植物检疫性菌物截获现状与展望[J].菌物学报,2017,36(10):1311-1331.
[10]郭梁,徐伟良,钱俊平,等. 牛源性成分鉴定的引物和探针[J].食品研究与开发,2018,39(16):153-157.
[11]柏玉晶,姚玉玲,张振粉,等. 紫花苜蓿根腐病原——厚垣镰刀菌的鉴定及其拮抗菌的筛选[J].草业学报,2017,26(02):78-87.
[12]梁嘉俊,庞仁江,宁军权,等. 陕西省紫花苜蓿根腐病致病镰孢菌的分离与鉴定[J].植物保护学报,2019,46(03):715-716.
[13]曹丽霞,赵存虎,白全江,等. 内蒙古中部地区苜蓿根腐病病原研究(英文)[J].华北农学报,2008,23(06):105-107.
[14]潘龙其. 紫花苜蓿拟枝孢镰刀菌根腐病的研究[D].兰州:甘肃农业大学,2015.
[15]丛丽丽,康俊梅,张铁军,等. 苜蓿镰刀菌根腐病病原菌的分离鉴定与致病性分析[J].草地学报,2017,25(04):857-865.
[16]李春冬,徐伟良,鲁铁,等. 一株锡林郭勒盟木霉的鉴定及其产纤维素酶研究[J].中国酿造,2019,38(03):94-98.
[17]张振粉. 紫花苜蓿种带细菌及其致病性[D].兰州:兰州大学,2013.
[18]López Jose R,Lorenzo Laura,Marcelino-Pozuelo Cinta,et al. Pseudomonas baetica: pathogenicity for marine fish and development of protocols for rapid diagnosis[J]. FEMS microbiology letters,2017,364(3):1-9.
[19]黄科,孙向成,陈思兵,等. 蓝莓叶枯病蜡样芽孢杆菌的分离鉴定及宿主应答反应[J].作物杂志,2015(05):145-149,167.
[20]Furtado G Q, Guimares L M S, Lisboa D O, et al. First Report of Enterobacter cowanii Causing Bacterial Spot on Mabea fistulifera, a Native Forest Species in Brazil[J]. Plant disease,2012,96(10):1576.
[21]石青. 耐寒短杆菌和巨大芽孢杆菌在黄顶菊入侵过程中的作用[D].保定:河北大学,2018.
[22]徐婧,徐秀德,王丽娟,等. 番茄织球壳萎蔫病菌的生物学特性[J].沈阳农业大学学报,2014,45(06):673-678.
[23]谢君. 三七内生真菌Penicillium janthinellum及次级代谢产物的研究[D].沈阳:沈阳药科大学,2018.
[24]Ziauddin Khan, Eiman Mokaddas, Suhail Ahmad, et al. Burhamah. Isolation of Cryptococcus magnus and Cryptococcus chernovii from nasal cavities of pediatric patients with acute lymphoblastic leukemia[J]. Medical Mycology,2011,49(4):439-443.
[25]胡蘭,刘可杰,徐婧,等. 高粱种质资源对黑束病的抗性鉴定与评价[J].植物遗传资源学报,2019,20(03):550-555.
[26]Shi-Ke Huang, Rajesh Jeewon, Kevin D. Hyde,et al. Cosmosporium gen. nov and Aquanectria sp.nov.(Nectriaceae) from freshwater habitats in China[A]. 中国菌物学会(Mycological Society of China).中国菌物学会2018年学术年会论文汇编[C].中国菌物学会(Mycological Society of China):中国菌物学会,2018:1.
[27]易铭,梁嘉俊,史建,等. 采用EF-1α序列分析法对苜蓿根腐病病原菌——锐顶镰刀菌的鉴定[J].草业学报,2017,26(02):61-68.
[28]张宇,许萍萍,吴晶,等. 进境高粱种子中葡萄茎枯病菌的检疫鉴定[J].植物保护,2017,43(03):192-198.
[29]徐婧. 中国番茄新病害—番茄织球壳萎蔫病研究[D].沈阳:沈阳农业大学,2016.
(责任编辑 贾灿)

