O2和CO2浓度对黑木耳菌丝生长及出耳的影响
戴肖东 韩增华 马银鹏 张丕奇 陈 鹤 张介驰
(黑龙江省科学院微生物研究所,黑龙江哈尔滨150010)
黑木耳(Auricularia heimuer)[1]是我国主要的食用菌栽培品种之一,近几年生产规模迅速扩大,工厂化生产正是发展趋势。黑木耳在菌种生产和菌包制备等环节基本可以实现机械化、自动化、智能化,出耳环境工厂化调节能力显著提升[2]。根据黑木耳生长特性,通过对其生长各阶段的环境参数调控,实现精准、可控栽培,是研究者追求的目标。环境中的O2和CO2对食用菌菌丝生长和不同发育阶段子实体生长都有一定影响[3-4],在食用菌生长环境智能控制系统设计中,也将CO2作为主要指标[5]。研究O2和CO2对于黑木耳菌丝生长及子实体发育的影响,可为黑木耳栽培环境条件的精准调控提供理论参数。
1 材料与方法
1.1 供试材料
黑木耳菌株:黑29、黑威15号,由黑龙江省科学院微生物研究所菌种保藏中心提供。
培养基有①综合PDA培养基:马铃薯20%(煮汁),葡萄糖2%,磷酸二氢钾0.3%,硫酸镁0.15%,蛋白胨0.05%,琼脂粉1.4%;②木屑培养基:木屑83%,麸皮15%,石膏1%,石灰1%。
培养设施及测定仪器有①培养箱:自行设计的两种密闭的培养装置,包括O2和CO2钢瓶、气体流量计、培养箱三部分,由软管连接,密闭培养装置设有进气孔、出气孔,保持箱体内气体浓度相对平衡(图1);②氧气浓度测定仪:科尔诺GT901-O2-IR(0%~50%);③二氧化碳浓度测定仪:科尔诺GT901-CO2-IR(0%~5%)、Telaire TEL7001(0%~1%)。
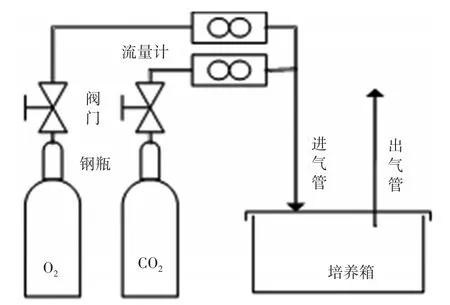
图1 试验培养装置示意图
1.2 试验方法
1.2.1 不同O2浓度处理黑木耳菌丝培养试验
黑29和黑威15号接种平板培养基后25℃培养,菌丝萌发后分别放入不同的培养箱及培养室中继续培养。将4个不同的培养箱放在培养室中,分别通入CO2及O2,保持4个培养箱中CO2百分浓度相同,O2百分浓度不同(浓度均为体积百分浓度),以培养室作为对照,培养8 d。测定菌落生长直径,计算平均值。利用CO2和O2浓度检测仪分别测定气体浓度(表1)。
1.2.2 不同CO2浓度处理黑木耳菌丝培养试验
采用1.2.1的方法,将4个培养箱保持CO2浓度不同,O2浓度相近,测定菌丝生长情况,4个培养箱及培养室中气体浓度如表2。
1.2.3 不同O2浓度处理黑木耳出耳试验
黑29和黑威15号接种于木屑培养基,25℃培养,菌丝长满菌袋后开口,保持温度20~23℃,空气相对湿度70%左右,培养4 d菌丝封口,分别放置在4个不同O2浓度培养箱中,进行出耳试验。4个培养箱中O2浓度见表3。保持相同的培养温度(20~22℃)和空气相对湿度(85%~90%)。观测不同O2浓度对黑木耳催芽及生长的影响。

表1 培养箱O2浓度试验

表2 培养箱CO2浓度试验

表3 不同O2浓度处理
1.2.4 不同CO2浓度处理黑木耳出耳试验
按照1.2.3的方法,菌丝封口后,置于4个培养箱中,CO2浓度见表4。保持相同的培养温度和空气相对湿度。测定不同CO2浓度对黑木耳催芽及生长的影响。

表4 不同CO2浓度处理
2 结果与分析
2.1 不同O2浓度对黑木耳菌丝生长的影响
对照组O2浓度接近空气中O2浓度,4个试验组O2浓度均低于对照(表1)。培养箱1的O2浓度为18.71%~20.38%,2个黑木耳菌株菌丝生长量与对照相比差异不显著;培养箱2~4,O2浓度为17.45%~6.50%,2个黑木耳菌株菌丝生长量显著降低,说明菌丝的生长受到抑制,且O2浓度越低,对菌丝生长的抑制程度越明显(图2、图3)。
2.2 不同CO2浓度对黑木耳菌丝生长的影响
对照组CO2浓度接近空气中CO2浓度,4个试验培养箱CO2浓度均高于对照(表2)。培养箱1,CO2浓度为0.52%~3.10%,对黑木耳菌丝的生长有明显的促进作用,菌丝的生长量较对照有明显提高,菌丝长势旺盛;培养箱2—培养箱4,CO2浓度为3.07%~13.24%,菌丝的生长量与对照相比显著降低,菌丝生长受到抑制。但是,随着CO2浓度的上升,菌丝生长量没有显著差异(图4、图5)。

图2 不同O2浓度处理黑木耳菌丝生长状态
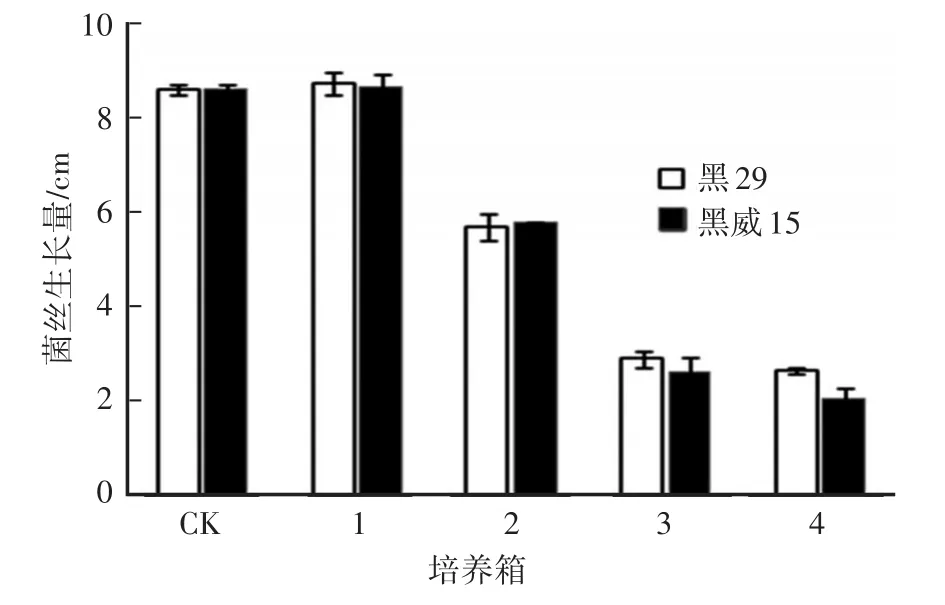
图3 不同O2浓度处理黑木耳菌丝生长量
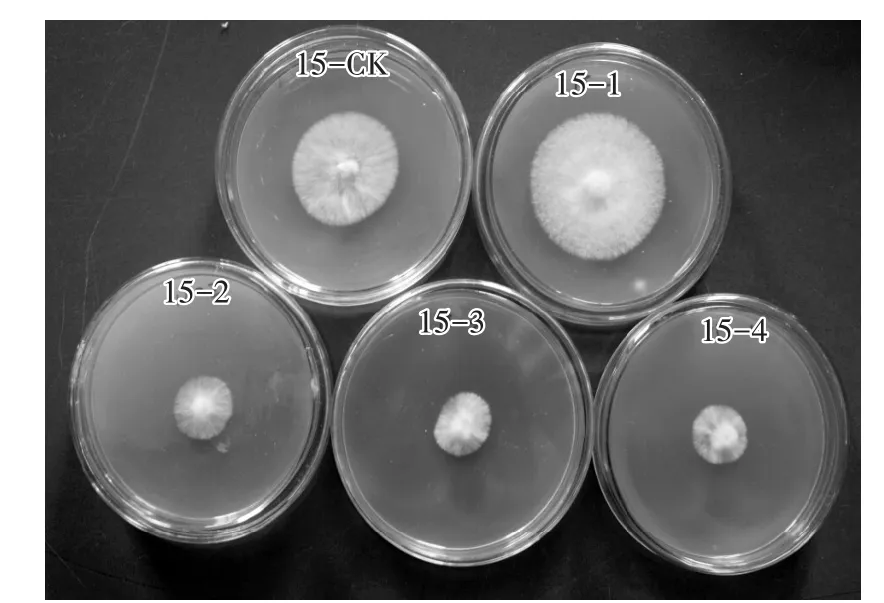
图4 不同CO2浓度处理黑木耳菌丝生长状态
将经过CO2处理的平板,重新置于CO2浓度与空气相当的培养室(对照)继续培养,受抑制的黑木耳菌丝恢复生长,新生菌丝与原菌丝之间出现明显的界线(图6)。
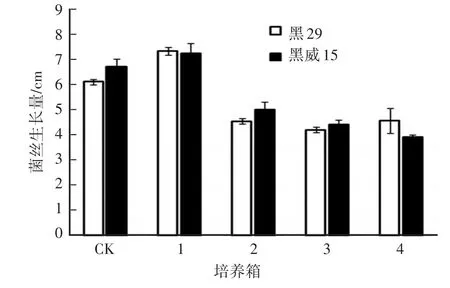
图5 不同CO2浓度处理黑木耳菌丝生长量
2.3 不同O2浓度处理对黑木耳出耳的影响
4个培养箱O2浓度为18.85%~41.85%(表3)。结果显示,4个培养箱的2个黑木耳菌株均能形成子实体原基,不同处理出芽率及出芽时间没有显著差异。但是,各处理组在原基形成后,耳芽伸长,不易形成耳片,子实体出现白色菌丝体。结果表明,O2浓度为18.85%~41.85%对耳芽形成没有显著差异,高浓度的O2对黑木耳展片没有明显促进作用(图7)。

图6 培养室培养后菌丝恢复生长状态
2.4 不同CO2浓度处理对黑木耳出耳的影响
4个培养箱CO2浓度为0.19%~3.52%,O2浓度基本相同(表4)。结果显示,4个培养箱的2个黑木耳菌株均能形成子实体原基,子实体正常开片生长,不同处理出芽率没有显著差异。但是,培养箱2~培养箱4原基(耳芽)形成时间较培养箱1早3~4 d。结果说明,CO2浓度为0.19%~3.52%对黑木耳子实体原基分化即耳芽的形成有一定促进作用,对子实体开片没有显著的影响(图8)。

图7 不同O2浓度处理黑木耳子实体生长状态

图8 不同CO2浓度处理黑木耳子实体生长状态
3 小结与讨论
试验表明,黑木耳菌丝培养阶段CO2浓度为0.52%~3.10%时对菌丝生长有促进作用,O2浓度低于17.45%时,菌丝生长受到抑制。黑木耳催芽阶段,CO2浓度为0.2%~3.5%时可缩短出芽时间;O2浓度为18%~40%时对耳芽形成没有显著影响,高浓度氧气没有促进耳片的形成与生长。
O2和CO2作为食用菌生长的重要影响因子,对菌丝体和子实体的生长发育、形态、品质等有重要影响,在菇类生产中研究的较多,其参数在工厂化生产中得到应用[6-7]。目前,黑木耳的出耳以开放式的“全光地摆”或半开放式的“大棚吊袋”为主,无法实现对栽培环境氧气、二氧化碳的精准调控。工厂化生产黑木耳菌种需要建立培养环境中温、湿、光、气的参数调控体系;黑木耳的棚室化栽培也是未来发展的方向,确定最佳培养条件可以提高黑木耳栽培的生产效率,有助于黑木耳栽培生理研究体系的建立和完善。而对于黑木耳栽培生理的研究还处于起步阶段,由于环境因子复杂、互作性较强,综合研究较为困难,因而需要开展系统的环境生理和营养生理研究,逐步完善栽培环境参数精准调控技术。

