杏鲍菇柄抗氧化肽的制备及其稳定性初步分析
,*
(1.青岛农业大学食品科学与工程学院,山东青岛 266000;2.青岛农业大学生命科学学院,山东青岛 266000)
杏鲍菇(Pleurotuseryngii)又名刺芹侧耳,是近年来开发栽培成功的集食用、药用和食疗于一体的珍稀食用菌新品种[1]。杏鲍菇富含蛋白质、总糖、膳食纤维,而且还含有铜、铁、锰、锌、钙等大量对人体有益的矿物质及微量元素[2]。杏鲍菇本身含有较多抗氧化活性物质,杏鲍菇抗氧化物是近几年来才开发的新型产品[3]。药用研究表明,杏鲍菇抗氧化活性物质具有降血脂[4]、降胆固醇、增强机体免疫力[5]、抗氧化和抗肿瘤[6]的作用。
近年来,我国食用菌产量持续增长,其中杏鲍菇产量在2015年达到110万吨,占同期国内食用菌总产量的3.1%。杏鲍菇在生产加工过程中,会产生大量的杏鲍菇菌柄切削角料,大约平均每生产7吨商品杏鲍菇,就会产生1吨该类副产品[7]。目前,杏鲍菇菌柄切削角料主要用作饲料和肥料,利用率不高,环境污染严重[8]。从营养角度分析,杏鲍菇柄与杏鲍菇子实体基本毫无差别,其低廉的价格及优异的抗氧化性,使之非常适用于开发具有优良抗氧化性能的食用菌深加工产品[9]。柯乐芹等[10]利用酶法微波辅助从杏鲍菇残渣中提取多糖抗氧化活性物质,但其选用酶较为单一;Mishra等[11]研究了不同食用菌种的抗氧化特性及提高杏鲍菇的生物转化效率,而杏鲍菇抗氧化活性物质的自由基清除活性要高于其它菌种;郑艺梅等[12]研究了不同粒度杏鲍菇菌柄基部粉体氨基酸组成特性、营养价值及总糖含量,表明杏鲍菇柄营养价值与杏鲍菇子实体基本无差别。多糖的提取在杏鲍菇深加工领域占主导地位,而多糖提取后的蛋白质和膳食纤维副产物等尚未被开采,造成资源浪费和环境污染。这些方面使得杏鲍菇综合利用率低,加工产品品种少,技术含量低[13]。因此,以杏鲍菇的加工废弃物杏鲍菇柄为原料,制备杏鲍菇柄抗氧化肽,更容易被消化吸收,具有较高的生物活性,可应用在食品深加工领域中实现资源的充分利用,使杏鲍菇的营养价值和药用价值得到充分的发挥。
本文以杏鲍菇的加工废弃物杏鲍菇柄为原料,通过对杏鲍菇柄抗氧化肽的制备,研究其多肽的抗氧化活性与稳定性分析,为食用菌副产品的开发利用提供一定数据支持。
1 材料与方法
1.1 材料与仪器
新鲜杏鲍菇柄 青岛市城阳批发市场;木瓜蛋白酶、碱性蛋白酶、中性蛋白酶、风味蛋白酶、胰蛋白酶 北京索莱宝科技有限公司;1,1-二苯基-2-苦基肼自由基 梯希爱(上海)化成工业发展有限公司;磷酸(GR)、乙酸(AR)、邻苯三酚(AR)、FeCl3(AR) 国药集团化学试剂有限公司;无水乙醇、丙酮、冰醋酸 莱阳市康德化工有限公司;磷酸氢二钠、氢氧化钠 国药集团化学试剂有限公司;三氯乙酸 天津市致远化学药剂有限公司;磷酸二氢钠 天津市巴斯夫化工有限公司。
CU600A型恒温水槽 上海福玛试验设备有限公司;E0M210型精密电子分析天平 奥豪斯国际贸易(上海)有限公司;TGL-16M型高速台式冷冻离心机 长沙湘仪离心机仪器有限公司;UV-2000型紫外可见分光光度计 尤尼克(上海)仪器有限公司;UVS-1型涡旋机 北京优晟联合科技有限公司。
1.2 实验方法
1.2.1 杏鲍菇柄多肽的制备 粗蛋白的提取:称取10 g杏鲍菇柄,加50 mL 水打浆,用1 mol/L NaOH溶液将pH调至11.0,4 ℃ 6000 r/min离心10 min,取上清液,回调pH到7.0。加入90%的乙醇进行沉淀,4 ℃ 6000 r/min离心取上清,旋转蒸发仪50 ℃将上清液中乙醇蒸出,得杏鲍菇柄蛋白粗提液。
配制一定浓度的杏鲍菇柄蛋白液,在选用酶最适温度和pH的条件下,添加一定量的酶,加热水解1.5 h,并在沸水浴中灭酶10 min,最后在6000 r/min下离心10 min取上清液[14],得杏鲍菇柄粗抗氧化肽。
1.2.2 单因素实验
1.2.2.1 蛋白酶的筛选 选取木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶、风味蛋白酶[15],在加酶量6000 U/g以及其最适pH及最适温度(表1)下水浴酶解1.5 h,同上1.2.1,所得上清液即为杏鲍菇柄粗抗氧化肽。以 DPPH自由基清除率为指标,确定杏鲍菇柄酶解的最佳蛋白酶。
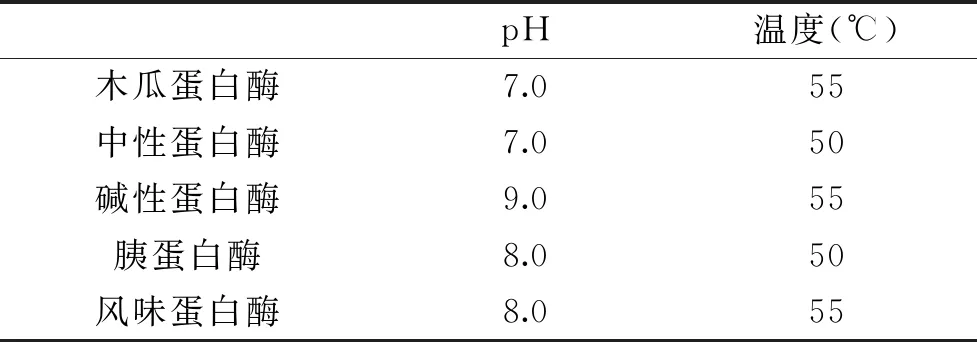
表1 酶的最适pH和最适温度Table 1 Optimal pH and temperature of enzymes
1.2.2.2 加酶量的确定 液料比为20∶1 mL/g的条件下,添加不同浓度(2000、4000、6000、8000和10000 U/g)的碱性蛋白酶,pH9.0、45 ℃下水解1.5 h,以 DPPH自由基清除率为指标,确定最适加酶量。
1.2.2.3 酶解时间的影响 在液料比为20∶1 mL/g的条件下,添加6000 U/g的碱性蛋白酶,pH9.0、45 ℃下水解(0.5、1.0、1.5、2.0和2.5 h),研究不同加酶量对酶解产物DPPH自由基清除率的影响。
1.2.2.4 液料比的影响 在不同的液料比(10∶1、20∶1、30∶1、40∶1、50∶1 mL/g)下,添加6000 U/g的碱性蛋白酶,pH9.0、45 ℃下水解1.5 h,研究不同液料比对酶解产物DPPH自由基清除率的影响。
1.2.3 响应面试验 单因素实验的基础上,以液料比(A)、加酶量(B)、酶解时间(C)为变量,以DPPH自由基清除率(Y)为响应值,进行三因素三水平的响应面实验[16]。试验因素与水平设计见表2所示,数据分析软件采用Design-Expert 8.0.5。

表2 试验因素水平编码Table 2 Factors and levels of response surface methodology
1.2.4 抗氧化活性研究
1.2.4.1 DPPH自由基清除率的测定 依次加入4 mL DPPH溶液和提取液,再加入无水乙醇至10 mL,混匀在517 nm处测吸光值,吸光值记为Ai,再避光保存30 min后测吸光值,记为Aj,对照为只加DPPH的乙醇溶液,其吸光值记为Ac。按下式计算自由基清除率(K)[17]:
K(%)=[1-(Ai-Aj)/Ac]×100
式(1)
1.2.4.2 还原能力的测定 依次加入2.5 mL磷酸缓冲液、铁氰化钾溶液混合均匀,水浴30 min,取出加入三氯乙酸,混匀,离心10 min,取上清液加入2.5 mL二次水和三氯化铁溶液,混匀后用分光光度计在700 nm下测定吸光度[18]:
还原能力(%)=[1-(Ai-Aj)]/Ao×100
式(2)
式中:实验组(Ai);对照组(Ao);空白组(Aj)。
1.2.4.3 羟基自由基清除能力的测定 试管中依次加入3.5 mL去离子水,0.5 mL水杨酸-乙醇溶液,0.5 mL样品,0.5 mL FeCl2溶液,5 mL H2O2,摇匀,在510 nm处测定吸光度[19]:
羟自由基清除率(%)=[1-(A1-A2)/A3]×100
式(3)
式中:A1-样品的吸光度值;A2-蒸馏水替代9 mmoL/L的FeCl2的吸光度值;A3-去离子水替代样品溶液的吸光度值。
1.2.4.4 超氧阴离子自由基清除能力测定 采用邻苯三酚自氧化法[20]。以等体积0.01 mol/L HCl代替邻苯三酚为空白调零,对照组为等体积二次水代替样品。对照品为VC:
清除率(%)=(A0-A)/A0×100
式(4)
式中,A0-对照组的吸光度值;A-样品组的吸光度值。
1.2.5 稳定性研究
1.2.5.1 温度对杏鲍菇柄抗氧化肽稳定性的影响 配制浓度为10%的杏鲍菇柄抗氧化肽溶液,放置于20、40、60、80、100 ℃的恒温水浴中处理1 h后[21],再冷却至室温后测定DPPH清除活性保持率。
1.2.5.2 pH对杏鲍菇柄抗氧化肽稳定性的影响 配制浓度为10%的杏鲍菇柄抗氧化肽溶液,将其pH分别调为2、4、6、8、10、12,在室温下放置1 h后,测定DPPH清除活性保持率。
1.2.5.3 金属离子对杏鲍菇柄抗氧化肽稳定性的影响 配制浓度为10%的杏鲍菇柄抗氧化肽溶液,向溶液中加入1 mL 500 μg/mL的K+、Ca2+、Zn2+、Mg2+、Cu2+等金属离子溶液,在室温下放置1 h后,测定DPPH清除活性保持率。
1.2.5.4 食品原料对杏鲍菇柄抗氧化肽稳定性的影响 配制浓度为10%的杏鲍菇柄抗氧化肽溶液,向溶液中分别添加NaCl、葡萄糖、淀粉、蔗糖、乳糖等食品原料,使其最终浓度均为5%,室温下放置1 h后,测定DPPH清除活性保持率。
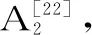
DPPH自由基清除活性保持率(%)=A2/A1×100
式(5)
1.3 数据处理
每次实验设3个平行,取平均值,数据采用Sigma Plot 10.0软件和Design Expert 8.06软件进行统计分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 蛋白酶的筛选 各蛋白酶对杏鲍菇柄粗抗氧化肽清除DPPH自由基能力如图1所示。图1可以看出,碱性蛋白酶酶解水解度最高,水解1.5 h,其DPPH自由基清除率达40.38%,其次是风味蛋白酶,达32.17%。因此,选择碱性蛋白酶进行水解,这一结果与国外采用的商业碱性酶作为水解蛋白酶的研究结果一致[23]。

图1 蛋白酶的筛选结果Fig.1 Screening results of protease
2.1.2 加酶量的确定 增大酶浓度可以增加酶与底物之间结合的几率,从而增强酶解程度[24]。图2所示,在酶添加量为2000 U/g时,DPPH自由基清除率仅为26.75%,随加酶量的增加,在6000 U/g时,DPPH自由基清除率达到最大值42.67%,随后呈现下降的趋势。酶添加量过高导致DPPH自由基清除率下降,可能是因为活性较好的抗氧化肽被进一步酶解为不具活性的氨基酸或小分子肽,从而导致抗氧化活性降低[25]。由此可见,为得到最佳效果的DPPH自由基清除率,故选择6000 U/g为本实验的最佳酶用量。
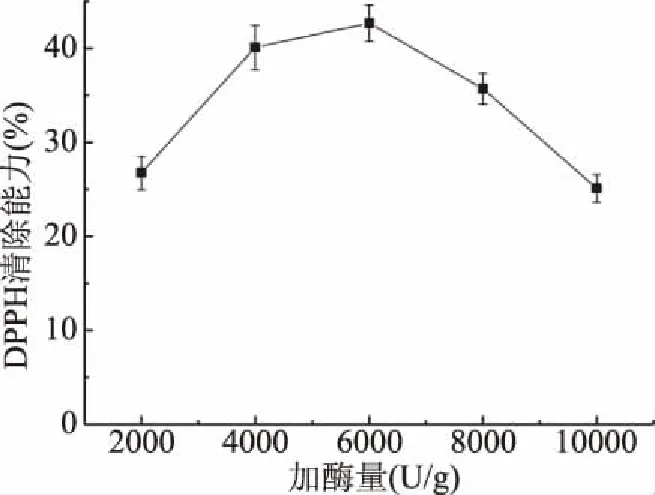
图2 加酶量对抗氧化活性的影响Fig.2 Effect of enzyme amount on antioxidant activity
2.1.3 酶解时间的影响 随着酶解时间的延长,酶解得到的肽段和游离氨基酸构成比例有所不同,酶解物对DPPH自由基清除率也有所变化[26]。由图3所示,随着时间的增加,DPPH自由基清除率逐渐增大,在酶解时间为1.5 h时达到最大值,为40.97%。由于随着酶解时间的增加,具有抗氧化作用的多肽被切断,导致失去抗氧化活性并引起DPPH自由基清除能力的下降[27],当酶解2.5 h时DPPH自由基清除率仅为29.12%。因此,最佳酶解时间为1.5 h。

图3 酶解时间对抗氧化活性的影响Fig.3 Effect of enzymatic hydrolysis time on antioxidant activity
2.1.4 不同液料比的影响 过高的底物浓度易造成水解液黏度增大,降低了底物与蛋白酶的扩散,对蛋白质链断裂反应有抑制作用。在底物浓度一定的时候,理论上酶分子越多,则酶与底物之间作用越频繁。随着底物浓度的减少,会降低蛋白酶和作用底物的碰撞概率[28-29]。当底物浓度小到一定程度时,酶的数量就趋于过剩,单位时间内一部分酶分子不与底物结合,造成蛋白质链断裂反应变缓慢。由图4可知,清除DPPH自由基的能力随液料比的增大呈先增大后减小的趋势,液料比在20∶1 mL/g处清除率到达最大值,清除率为40.02%。因此选择20∶1为最佳液料比。

图4 液料比对抗氧化活性的影响Fig.4 Effect of liquid-to-material ratio on antioxidant activity
2.2 响应面试验结果及分析
2.2.1 响应面试验设计结果 根据上述单因素的实验结果,以DPPH自由基清除率为响应值,利用design-expert 8.0.5响应面软件设计了3因素3水平的响应面法实验,共有17个实验点,其中13个为分析因点,4个为零点以估计误差,进行响应面优化实验,响应面试验设计结果如表3所示。

表3 响应面试验设计结果Table 3 Design and results of response surface methodology
2.2.2 响应面回归模型的建立与分析 以DPPH自由基清除率作为响应值(Y),通过design-expert 8.0.5响应面软件对试验结果进行响应面分析,对表3数据进行方差分析后得到其线性回归方程如下:
Y=55.58-4.44A-0.90B+1.17C+1.17AB+1.20AC+1.97BC-6.07A2-11.54B2-2.66C2对回归模型方差分析结果如表3所示:

表4 回归模型的方差分析结果Table 4 Regression analysis results of variance analysis
由回归方程和表4的方差分析结果可以看出,所得Y的回归方程极显著(P<0.01),失拟检验不显著(P>0.05),说明该方程拟合良好,实验误差小。该模型的修正系数由R2=0.9724确定,表明响应值变化的97.24%可以由方程中的3个因子解释。说明采用响应面法设计所得的回归模型有效,适用于碱性蛋白酶酶解制备杏鲍菇柄多肽实验的理论预测。
该模型中,各响应因素影响程度依次为:A>B>C,即液料比>加酶量>酶解时间。液料比对酶解液DPPH自由基清除率的影响显著,而酶解时间与加酶量对酶解液DPPH自由基清除率的影响不显著。
由Design-expert 8.0.5响应面分析软件结果得出酶解法制备杏鲍菇柄多肽的最佳条件为:碱性蛋白酶加酶量为5846 U/g,酶解时间为1.59 h,液料比为16.06∶1 mL/g,DPPH自由基清除率为56.5%。按照该条件进行DPPH自由基清除率的验证性实验,通过3次验证试验发现平均清除率为55.52%±0.98%,与理论值的相对误差为1.89%[30],与上述结果基本一致,表明本实验优化结果可信。优化条件的结果见图5,发现等高线稀疏,两两因素交互作用对响应值的影响不显著。
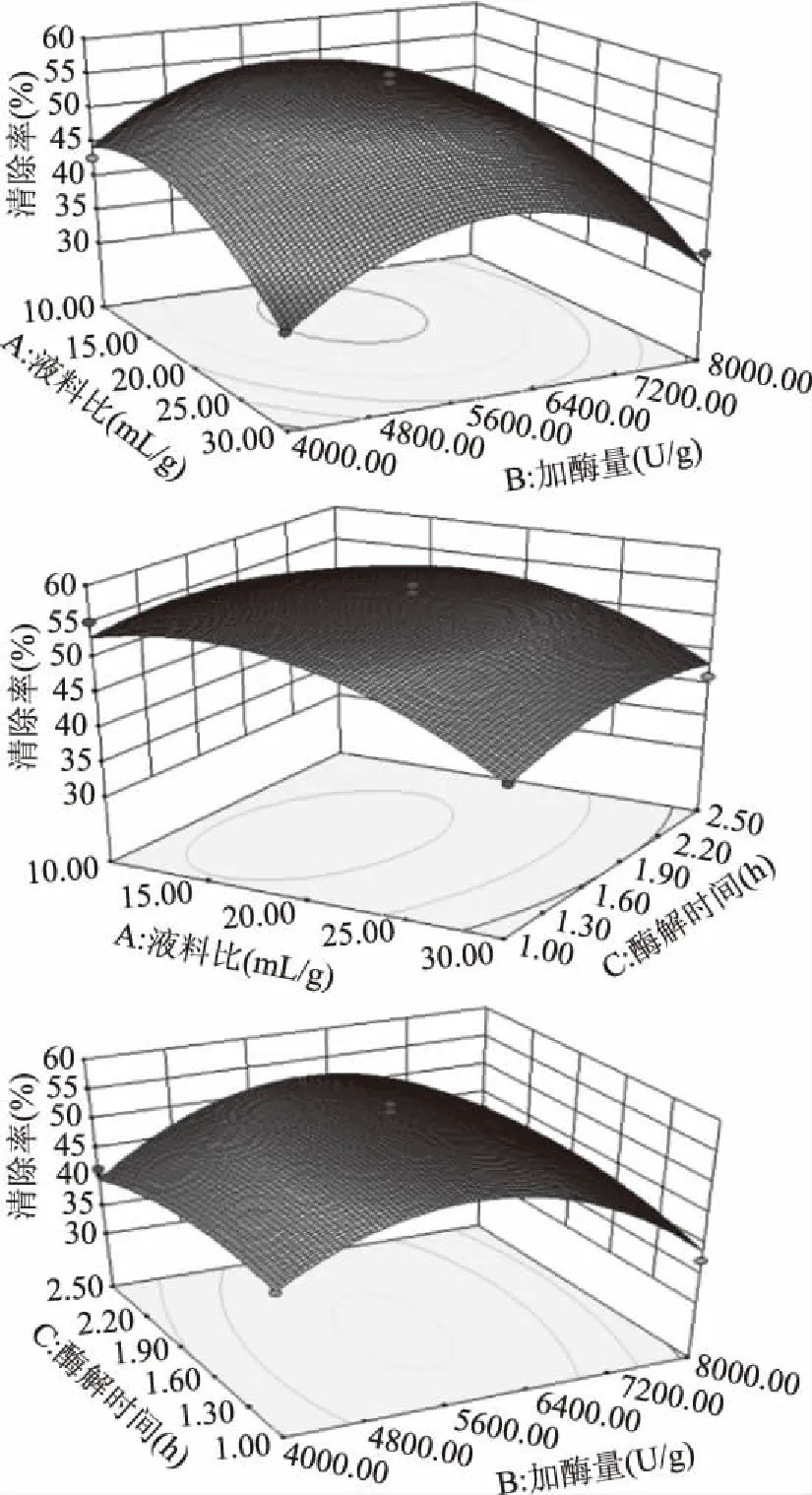
图5 各因素交互作用对DPPH自由基清除能力的影响Fig.5 Effects of interaction of various factors on DPPH free radical scavenging ability
2.3 杏鲍菇柄多肽的抗氧化活性分析

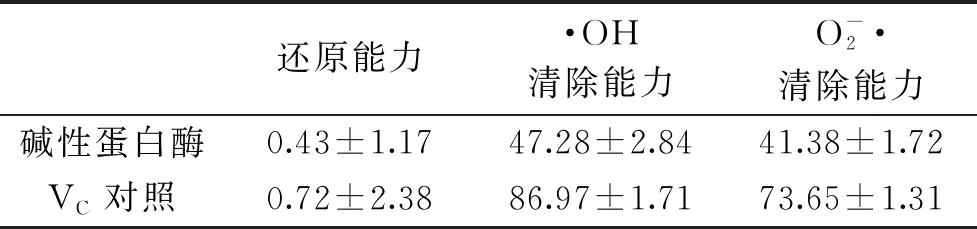
表5 抗氧化指标结果(%)Table 5 Antioxidant index results(%)
2.4 杏鲍菇柄多肽的稳定性分析
2.4.1 温度对杏鲍菇柄多肽稳定性的影响 食品加工过程中通常会涉及到温度的变化,杏鲍菇柄多肽溶液在20~100 ℃下恒温水浴处理后,其抗氧化活性的变化情况如图6所示。随着温度的升高DPPH自由基清除率下降。杏鲍菇柄的酶解产物在温度超过40 ℃后,抗氧化活性保持率下降明显,当处理温度升高到100 ℃时,抗氧化活性的损失比较明显,这说明高温处理会使得多肽中的氨基酸发生降解作用。

图6 温度对杏鲍菇柄抗氧化肽稳定性的影响Fig.6 Effect of temperature on the stability of antioxidant peptides in Pleurotus eryngii stalk
2.4.2 pH对杏鲍菇柄多肽稳定性的影响 杏鲍菇柄多肽溶液在pH2~12的范围内处理,其抗氧化活性的变化情况如图7所示:当pH为中性时,DPPH自由基清除活性保持率几乎没有影响。而强酸或强碱性环境都会影响抗氧化活性,且强碱性环境影响更为显著。碱性蛋白酶的酶解产物在pH为12时,其DPPH自由基清除活性保持率为83.65%。由此可见,碱性条件下对的杏鲍菇柄多肽抗氧化活性会有显著影响,猜测可能是因为在碱性条件下,多肽发生消旋作用而使肽链的构象发生变化,从而影响其活性[35]。

图7 pH对杏鲍菇柄抗氧化肽稳定性的影响Fig.7 Effect of pH on stability of antioxidant peptides from Pleurotus eryngii stalk
2.4.3 金属离子对杏鲍菇柄多肽稳定性的影响 由于含蛋白水解物的营养食品在加工中经常要与金属接触,故金属离子对多肽稳定性的影响非常重要。一些蛋白酶在金属离子的作用下可以发生构象的转变,由此多肽分子对不同的金属离子刺激响应程度不同[36]。杏鲍菇柄多肽溶液中添加500 μg/mL的K+、Ca2+、Zn2+、Mg2+、Cu2+等金属离子,抗氧化活性的变化情况如图8所示:金属离子对碱性蛋白酶酶解产物的活性保持率持有不同程度的影响,对碱性蛋白酶的酶解产物影响大小依次为:Cu2+>Zn2+>Ca2+>Mg2+>K+。Thanonkaew等[37]报道不同浓度、种类和化合价的金属离子对乌贼肌肉影响不同,如添加 Fe2+会加速乌贼肌肉的脂肪氧化,而Cu2+和Cd2+则对其无显著影响,与Thanonkaew报道的对乌贼肌肉影响结果不同,可能是由于Cu2+、Zn2+和杏鲍菇柄多肽之间存在特殊的化学力作用,导致杏鲍菇柄多肽抗氧化活性的降低。总体来说,多肽对Cu2+、Zn2+非常敏感,而对K+、Mg2+而言,活性保持率虽有所下降,但下降不明显。因此在杏鲍菇柄多肽的加工使用和贮藏中要避免与含Cu2+、Zn2+的材料接触。
2.4.4 食品原料对杏鲍菇柄多肽稳定性的影响 杏鲍菇柄多肽溶液中添加5.0%的NaCl、葡萄糖、淀粉、蔗糖、乳糖等食品原料,抗氧化活性的变化情况如图9所示:添加质量分数为5.0%的NaCl对酶解产物的活性影响很小,酶解产物的活性保持率依然接近100%。与杏鲍菇柄多肽溶液相比,添加质量分数为5.0%的葡萄糖对杏鲍菇柄肽的抗氧化活性下降明显,杏鲍菇柄多肽酶解产物的活性保持率为82.19%(图9)。而添加质量分数为5.0%的蔗糖、淀粉以及乳糖对酶解产物的抗氧化活性略微影响,DPPH自由基清除活性保持率下降不明显。Benjakul等[38]研究表明半乳糖与猪血浆蛋白产生的反应产物较葡萄糖具有更大的DPPH自由基清除活性。牛改改等[39]发现,与乳糖相比,半乳糖、葡萄糖对牡蛎蛋白肽的功能特性和抗氧化性改善效果较好,与本实验研究结果一致。可能是因为乳糖与杏鲍菇柄多肽糖基化反应产物的溶解性更好,促进了氢原子或自由基中间体的形成,进而与DPPH·结合形成稳定分子结构,从而使DPPH自由基清除活性保持率下降不明显。由此可见相较于其它食品原料对杏鲍菇柄多肽稳定性的影响,质量分数为5.0%的葡萄糖对杏鲍菇柄多肽稳定性的影响最为明显。
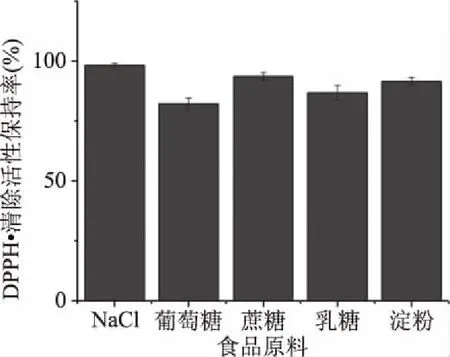
图9 食品原料对杏鲍菇柄抗氧化肽稳定性的影响Fig.9 Effect of food materials on the stability of antioxidant peptides in Pleurotus eryngii stalk
3 结论
研究表明,选用碱性蛋白酶、木瓜蛋白酶、中性蛋白酶、胰蛋白酶、风味蛋白酶五种酶进行酶解,碱性蛋白酶抗氧化活性效果明显。单因素实验与响应面优化试验确定最优工艺条件为:碱性蛋白酶加酶量为5846 U/g,酶解时间为1.59 h,液料比为16.06∶1,DPPH自由基清除率为55.52%±0.89%。杏鲍菇柄抗氧化肽的稳定性研究表明,杏鲍菇柄多肽在温度超过40 ℃时,活性保持率明显降低。强酸环境和强碱环境对多肽的抗氧化活性均有影响,强碱性环境下影响更显著;金属离子对杏鲍菇柄多肽溶液的抗氧化活性有很大影响,Cu2+对水解产物的DPPH自由基清除率影响最显著,K+对水解产物的影响相对较小;与杏鲍菇柄多肽溶液相比,添加质量分数为5.0%的NaCl对水解产物的抗氧化活性没有显着著影响,添加5.0%的葡萄糖使杏鲍菇柄肽的抗氧化活性下降明显,5.0%的蔗糖和淀粉稍微影响水解产物的抗氧化活性。结果显示碱性蛋白酶进行酶解制备得到的抗氧化肽,其抗氧化活性比用风味蛋白酶效果更好,因此在以后的生产中可以选用碱性蛋白酶进行酶解制备杏鲍菇柄抗氧化肽,同时在储存过程中要尽量避免与高温、强酸强碱环境及金属离子等因素接触。研究结果对于进一步开发和利用杏鲍菇柄资源提供一定的技术支持。

