响应面法优化超声协同复合酶分步提取恰玛古多糖工艺
(江西中医药大学药学院,江西南昌 330004)
恰玛古为十字花科芸薹属二年生草本植物,学名芜菁(BrassicarapaL.),又称“蔓菁”、“诸葛菜”;根肥大肉质成球状,是食用和入药主要部位,恰玛古药食两用历史悠久,是维吾尔族传统的药食两用植物,被称为“长寿圣果”[1];其药用始载于《名医别录》,“味苦温、无毒;主利五脏,轻身益气,可长食之”[2],《本草纲目》记载其“辛、苦、平,无毒,可升可降,能汗能吐,能下能利小便,又能明目解毒,其效甚伟”[3]。维吾尔族医药理论认为恰玛古具有“生湿生热、营养全身、肥体强身、润肺止咳、增强食欲、软便利尿、填精壮阳、明目增视之功效”[4]。近年来研究人员发现恰玛古多糖主要由半乳糖、甘露糖、葡萄糖、阿拉伯糖、鼠李糖等组成,具有降血糖、抗疲劳、抗氧化、抗肿瘤、抗炎和免疫调节等作用[5],因此,恰玛古多糖可应用于医药卫生和饮食保健等领域,作为绿色天然生物医药产品,有着广阔的市场前景。
目前关于恰玛古多糖的提取主要以水提醇沉法为主,但有费时、得率低等缺点[6-7]。近些年兴起的超声辅助提取法已广泛应用于中药有效成分的提取,超声产生的空化作用能够促进分子的运动,促使有效成分的溶出,提高有效成分的提取效率[8]。蔡啸镝等[9]以恰玛古为原料,利用响应面法对超声辅助提取恰玛古多糖的工艺条件进行优化,在液料比16.7∶1 mL/g、乙醇体积分数75.1%、超声功率为156.4 W条件下超声提取65.4 min,多糖的提取率为6.86%。
目前,复合酶提取法已广泛应用于植物多糖的提取,且复合酶提取法具有反应条件温和、高效、能耗低的特点。蒋德旗等[10]以金樱子根为原料,在单因素实验基础上采用响应面法优化复合酶提取金樱子根多糖工艺,表明在酶添加量2.1%、酶解pH4.4、料液比16∶1 g/mL、温度45 ℃条件下酶解49 min,多糖提取率为14.15%。关于超声协同复合酶分步提取恰玛古多糖的研究鲜有报道。本文以恰玛古多糖得率为响应值,在单因素考察基础上利用Box-Behnken进行试验设计,优化超声协同复合酶分步提取恰玛古多糖的工艺,以期为恰玛古多糖的开发与利用提供参考。
1 材料与方法
1.1 材料与仪器
恰玛古干品 新疆阿克苏地区(批号:20180711),鉴定人为江西中医药大学中药资源与民族药研究中心杜小浪教授;磷酸氢二钠、柠檬酸、葡萄糖、浓硫酸、苯酚 均为分析纯,西陇化工股份有限公司;果胶酶(40 U/mg)、纤维素酶(3 U/mg)、木瓜蛋白酶(80万U/g) 北京索莱宝科技有限公司。
YF-118B型高速中药粉碎机 瑞安市永历制药机械有限公司;UV-8000S双光束紫外可见分光光度计 上海元析仪器有限公司;HH-6型数显恒温水浴锅 常州国华电器仪器有限公司;SQP电子天平 塞多利斯科学仪器(北京)有限公司;KQ-300TDB数控超声波清洗器 昆山舒美超声仪器有限公司。
1.2 实验方法
1.2.1 恰玛古多糖含量的测定
1.2.1.1 葡萄糖标准曲线的绘制 采用苯酚-硫酸法测定多糖含量。准确称取100 mg无水葡萄糖标准品置于100 mL量瓶中,加蒸馏水定容至刻度,再取出1.0 mL溶液稀释定容10 mL得0.10 mg/mL的葡萄糖标准溶液。分别取0.10 mg/mL的葡萄糖标准溶液0、0.20、0.40、0.60、0.80、1.00、1.20 mL于7支25 mL比色管中,各补蒸馏水至2.0 mL,分别加入1.0 mL浓度为5%的苯酚溶液,混匀后迅速加入5.0 mL浓硫酸,静置10 min后置于沸水浴中反应15 min,取出冷却至室温,在490 nm处测定吸光度。以吸光度为纵坐标,葡萄糖质量浓度为横坐标,绘制葡萄糖标准曲线。得线性回归方程:Y=13.156X+0.0973,R2=0.9988。
1.2.1.2 恰玛古多糖的提取及测定 将干燥的恰玛古药材粉碎,60目过筛,石油醚回流2 h脱脂,自由挥干,50 ℃真空烘干,得预处理样品。称取1.0 g预处理样品,加入一定体积的蒸馏水,在一定的温度下超声提取一定时间。在最佳超声波条件提取结束后,加入缓冲液和复合酶(纤维素酶∶木瓜蛋白酶∶果胶酶=1∶1∶1,质量比),水浴恒温酶解反应一定时间后,置于沸水浴灭酶10 min,冷却至室温,离心取上清液,减压浓缩后加入4倍体积95%乙醇,4 ℃静置12 h,离心,收集沉淀并依次用无水乙醇、丙酮、乙醚洗涤,溶解定容至25 mL,得恰玛古多糖提取液,备用。
精密吸取0.10 mL制备的多糖提取液,置于15 mL具塞试管中,补蒸馏水至2.0 mL,其余步骤同1.2.1.1,在490 nm波长处测定吸光度,根据葡萄糖标准曲线计算多糖的质量浓度。
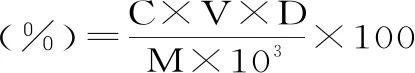
式中:C为多糖质量浓度(mg/mL);V为提取液定容体积(mL);D为样品稀释倍数;M为恰玛古质量(g)。
1.2.2 超声提取单因素实验 准确称取1.0 g恰玛古粉末若干份,固定实验条件液料比为20∶1 mL/g、超声功率为200 W,超声温度为60 ℃,超声时间40 min,分别考察液料比(10∶1、20∶1、30∶1、40∶1、50∶1 mL/g)、超声温度(40、50、60、70、80 ℃)、超声时间(20、30、40、50、60 min)、超声功率(100、150、200、250、300 W)对多糖得率的影响。
1.2.3 复合酶酶解单因素实验 准确称取1.0 g恰玛古粉末若干份,在最佳超声波条件提取结束后,加入复合酶进行酶解反应,用磷酸氢二钠和柠檬酸缓冲溶液调节pH。固定实验条件酶解pH5.0、酶加入量为1.5%、酶解时间为40 min、酶解温度为60 ℃,分别考察pH(3.0、4.0、5.0、6.0、7.0)、酶解温度(40、50、60、70、80 ℃)、酶加入量(1.0%、1.5%、2.0%、2.5%、3.0%)、酶解时间(20、30、40、50、60 min)对多糖提取率的影响。
1.2.4 超声提取响应面试验设计 根据超声提取单因素实验结果,选取液料比、超声温度、超声时间及超声功率为实验因素,采用Box-Behnken设计方法,建立四因素三水平RSM分析试验,RSM分析因素与水平见表1。

表1 超声波条件响应面分析因素与水平Table 1 Factors and levels of ultrasonic conditional response surface analysis
1.2.5 复合酶酶解响应面试验设计 在最佳超声波条件提取结束后,加入复合酶进行酶解反应。根据单因素试验结果,选取pH、酶解温度、酶解时间及酶加入量为实验因素,采用Box-Behnken设计方法,建立四因素三水平RSM分析试验,RSM分析因素与水平见表2。

表2 复合酶酶解条件响应面分析因素与水平Table 2 Factors and levels of conditional response surface analysis for complex enzyme hydrolysis
1.3 数据处理
每组实验重复3次,采用Excel 2010和SPSS 20.0软件分析数据及作图,Box-Behnken设计采用Design Expert 8.0.6软件并进行响应面分析,实验结果以“平均值±标准差”表示。
2 结果与分析
2.1 超声提取单因素实验结果
2.1.1 液料比对多糖得率的影响 由图1所示,随着液料比的增大,其整体趋势先增大后减小。液料比小于30∶1 mL/g时,细胞内、外多糖浓度梯度增大,利于多糖向水中扩散,多糖得率增大[11];当液料比大于30∶1 mL/g时,单位体积水吸收的超声能量降低,得率随之降低[12]。因此,选择液料比为30∶1 mL/g进行后续优化试验。

图1 液料比对多糖得率的影Fig.1 Effect of liquid to material ratio on the yield of polysaccharides
2.1.2 超声温度对多糖得率的影响 由图2所示,随着温度升高,其整体趋势先增大后减小。具体为超声温度小于60 ℃时,随着温度升高,有利于多糖溶出,多糖得率增大;当温度大于60 ℃时,多糖得率降低,可能但温度过高导致多糖结构可能被破坏[13]。因此,选择超声温度为60 ℃进行后续优化试验。

图2 超声温度对多糖得率的影响Fig.2 Effect of ultrasonic temperature on the yield of polysaccharides
2.1.3 超声时间对多糖得率的影响 由图3所示,随着超声时间延长,其整体趋势先增加后减小,具体为超声时间小于40 min 时,随着超声时间增加,多糖得率逐渐提高;当超声时间大于40 min时,多糖得率降低,可能长时间超声使多糖降解[14];当超声时间为40 min时,多糖得率最高。因此,选择超声时间为40 min进行后续优化试验。
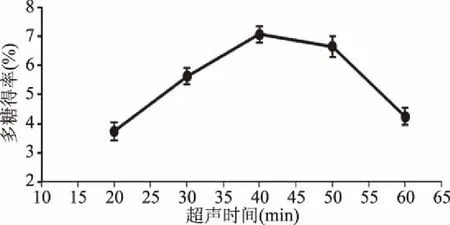
图3 超声时间对多糖得率的影响Fig.3 Effect of ultrasonic time on the yield of polysaccharides
2.1.4 超声功率对多糖得率的影响 由图4所示,随着超声功率增大,其整体趋势先增加后减小,超声功率小于250 W时,随着超声功率增大,多糖得率逐渐提高;当超声功率大于250 W时,多糖得率降低,可能过高的超声功率导致多糖降解[14];当超声功率为250 W时,多糖得率达到最大。因此,选择超声功率为250 W进行后续优化试验。

图4 超声功率对多糖得率的影响Fig.4 Effect of ultrasonic power on the yield of polysaccharides
2.2 复合酶酶解单因素实验结果
2.2.1 酶解pH对多糖得率的影响 由图5所示,随着酶解pH增大,其整体趋势先增加后减小,具体为pH<5.0时,随着pH的增大,复合酶活性升高,酶解能力加强,多糖提取率增大;当pH>5.0时,复合酶活性降低,多糖得率减小[10,15];当pH为5.0时,多糖得率达到最大。因此,选择酶解pH为5.0进行后续优化试验。

图5 酶解pH对多糖得率的影响Fig.5 Effect of enzymatic hydrolysis of pH on the yield of polysaccharides
2.2.2 酶解温度对多糖得率的影响 由图6所示,随着温度升高,其整体趋势先增加后减小;温度小于50 ℃时,随着温度的上升,复合酶活性增强,酶解能力提高,多糖得率增大;当温度大于50 ℃时,随着温度的上升复合酶活性降低,多糖得率下降[16];当温度为50 ℃时,多糖得率达到最大。因此,选择酶解温度为50 ℃进行后续优化试验。
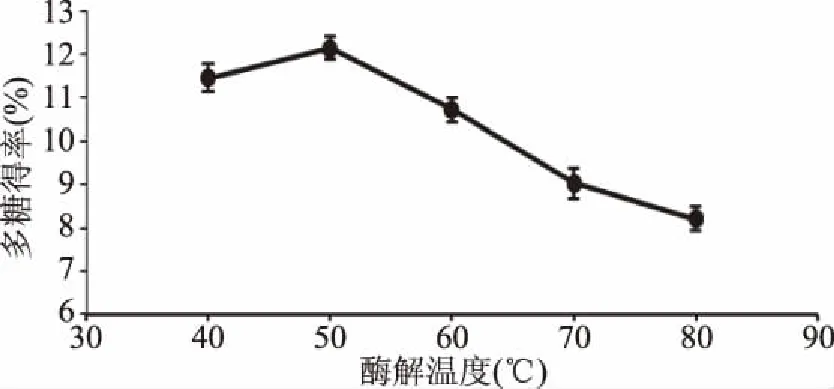
图6 酶解温度对多糖得率的影响Fig.6 Effect of enzymatic hydrolysis temperature on the yield of polysaccharides
2.2.3 酶加入量对多糖得率的影响 由图7所示,随着酶加入量增多,其整体趋势先增加后减小;酶加入量小于2.5%时,随着加入复合酶量增加,多糖得率逐渐增大;当酶加入量大于2.5%时,复合酶浓度增大,酶解效率降低,多糖得率下降[17];当酶加入量为2.5%时,多糖得率达到最大。因此,选择酶加入量为2.5%进行后续优化试验。
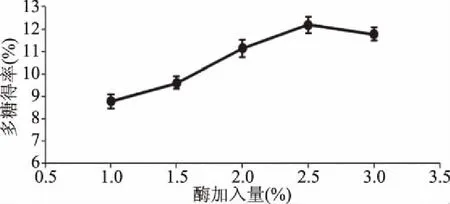
图7 酶加入量对多糖得率的影响Fig.7 Effect of enzyme addition on the yield of polysaccharides
2.2.4 酶解时间对多糖得率的影响 由图8所示,随着酶解时间延长,其整体趋势先增加后稳定;酶解时间小于50 min时,酶解反应未完全,多糖得率随时间的延长逐渐提高;当酶解时间大于50 min时,多糖得率增加不明显[10,15];当酶解时间为50 min时,多糖得率达到最大。因此,选择酶解时间为50 min进行后续优化试验。
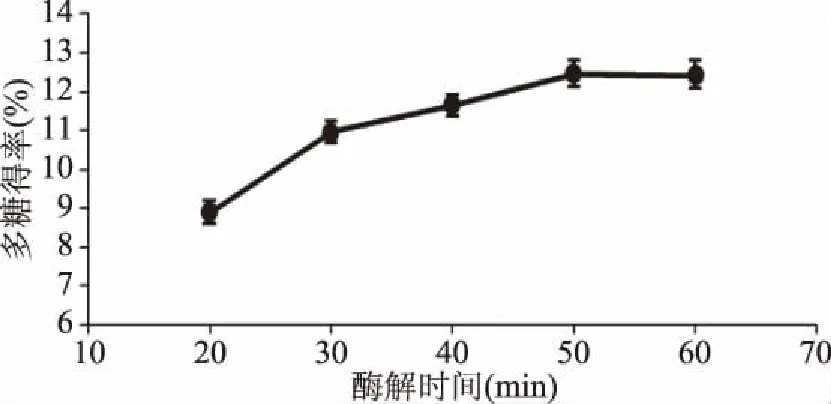
图8 酶解时间对多糖得率的影响Fig.8 Effect of enzymatic hydrolysis time on the yield of polysaccharides
2.3 RSM优化超声提取工艺条件
2.3.1 回归模型建立及方差分析 Box-Behnken实验设计及结果见表3,利用Design Expert 8.0.6软件对数据进行模型拟合,结果为Y=7.01+0.14A+0.39B+0.4C+0.35D+0.27AB+0.036AC-0.1AD+0.24BC+0.013BD+0.07CD-0.35A2-1.1B2-0.2C2-0.32D2。
方差试验分析结果见表4。由表4可知,模型的P<0.0001,此回归模型极显著,失拟项(P=0.0557>0.05)不显著,决定系数R2=0.9487,表明该模型与试验拟合较好,可适用于分析和预测恰玛古多糖提取工艺。各因素对恰玛古多糖得率的影响大小为:超声温度>超声时间>超声功率>液料比。

表3 超声波条件Box-Behnken试验设计与结果Table 3 Box-Behnken design and experiment results for ultrasonic conditional
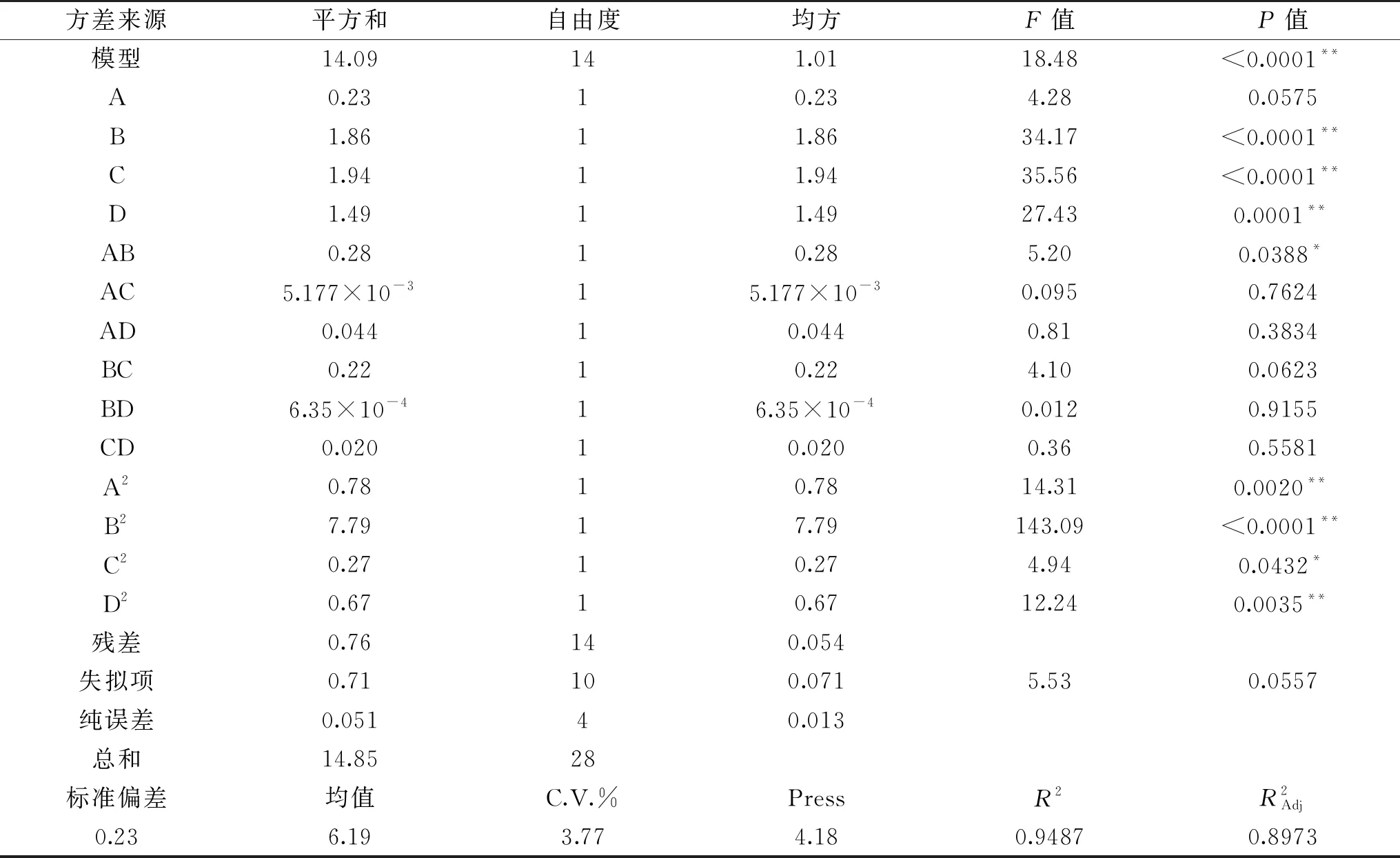
表4 超声波条件回归模型方差分析结果Table 4 Results of variance analysis of regression model for ultrasonic conditional
2.3.2 响应面交互作用分析及优化结果 根据回归模型,将任两因素固定在零水平,可以得到另外两因素交互作用的响应曲面及相应等高线图,反映各因素交互作用对超声提取多糖得率的影响[18]。超声提取阶段各因素交互作用见图9。响应曲面陡峭程度和等高线图的形状可反映各因素间的交互作用的显著与否,当两因素间交互作用显著时,响应面越陡,等高线呈椭圆形;反之,响应面越缓,等高线呈圆形[19-20]。由图9可知,在交互项对超声提取恰玛古多糖得率的影响中,液料比与超声温度之间交互作用显著(P<0.05),其他因素之间交互作用不显著,与方差分析结果一致。

图9 各因素交互作用对超声提取多糖得率影响的响应面图Fig.9 Response surface diagram of the effect of interaction of various factors on the yield of polysaccharides extracted by ultrasound
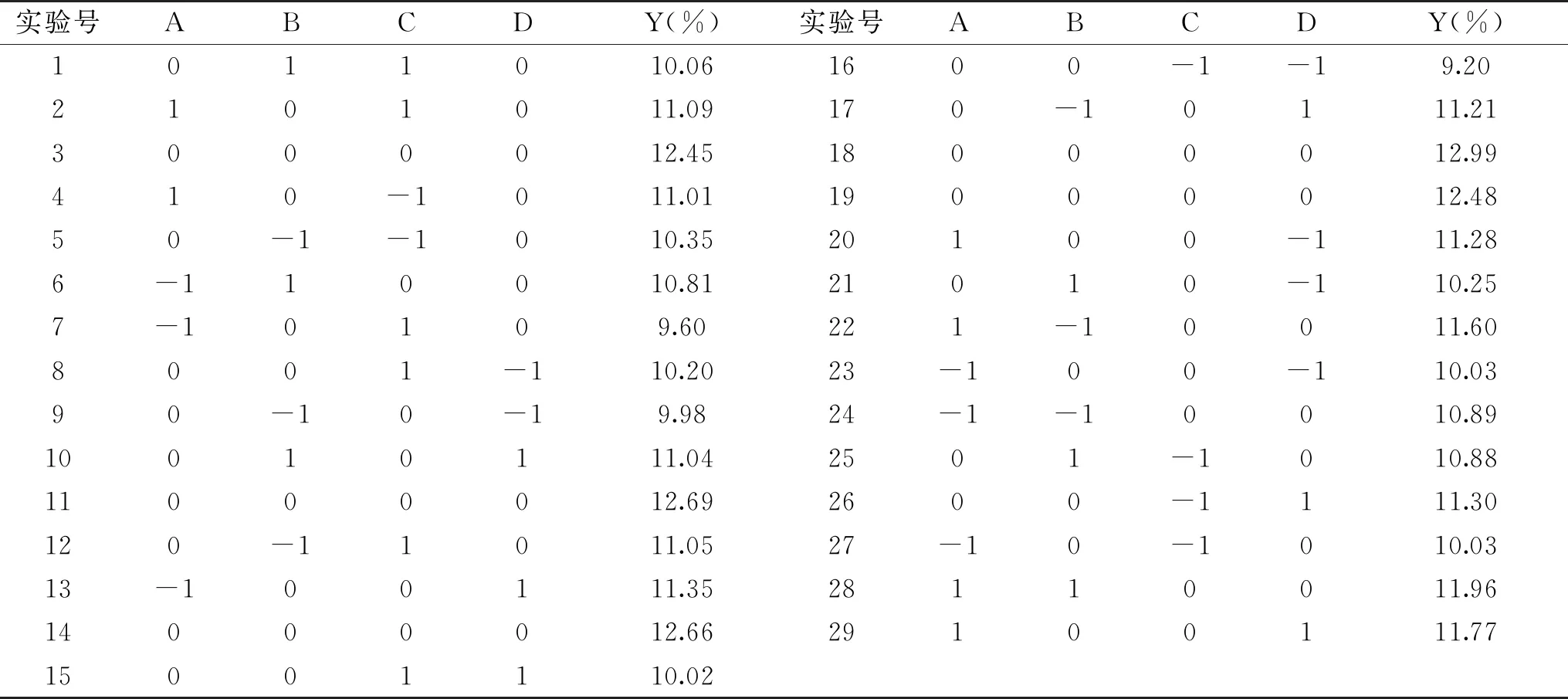
表5 复合酶酶解Box-Behnken试验设计与结果Table 5 Box-Behnken design and experiment results for complex enzyme hydrolysis
利用Design-Expert 8.0.6软件优化得到多糖超声提取最佳工艺:液料比32.85∶1 mL/g、提取温度61.63 ℃、超声功率250 W、超声时间 43.09 min,多糖理论预测得率为7.46%。结合实际操作后最终确定优选方案为:液料比33∶1 mL/g、提取温度62 ℃、超声功率250 W、超声时间43 min;在此条件下3次验证试验测得多糖得率为7.32%±0.16%,与理论预测值7.46%无显著差异。
2.4 RSM优化复合酶酶解工艺条件
2.4.1 回归模型及方差分析 Box-Behnken实验设计及结果见表5,利用Design Expert 8.0.6软件对数据进行模型拟合,结果为Y=12.65+0.50A-6.667×10-3B-0.062C+0.48D+0.11AB+0.13AC-0.21AD-0.38BC-0.11BD-0.57CD-0.61A2-0.77B2-1.43C2-1.08D2。
方差试验分析结果见表6,由表6可知,模型的P<0.0001,此回归模型极显著,失拟项(P=0.4316>0.05)不显著,决定系数R2=0.9715,表明该模型与试验拟合较好,可适用于分析和预测恰玛古多糖提取工艺。
2.4.2 响应面交互作用分析及优化结果 利用Design-Expert 8.0.6软件的Model Graphs模块,固定酶解pH(A)、酶解温度(B)、酶加入量(C)、酶解时间(D)其中的两个因素为零水平,可得到另外两因素的交互作用对多糖得率的影响,可通过响应曲面更加直观地表现出来,结果见图10。由图10所示,BC和CD两两因素响应曲面较陡,表明酶解温度与酶加入量和酶加入量与酶解时间之间交互作用对响应值的影响极显著(P<0.01),与方差分析结果一致。
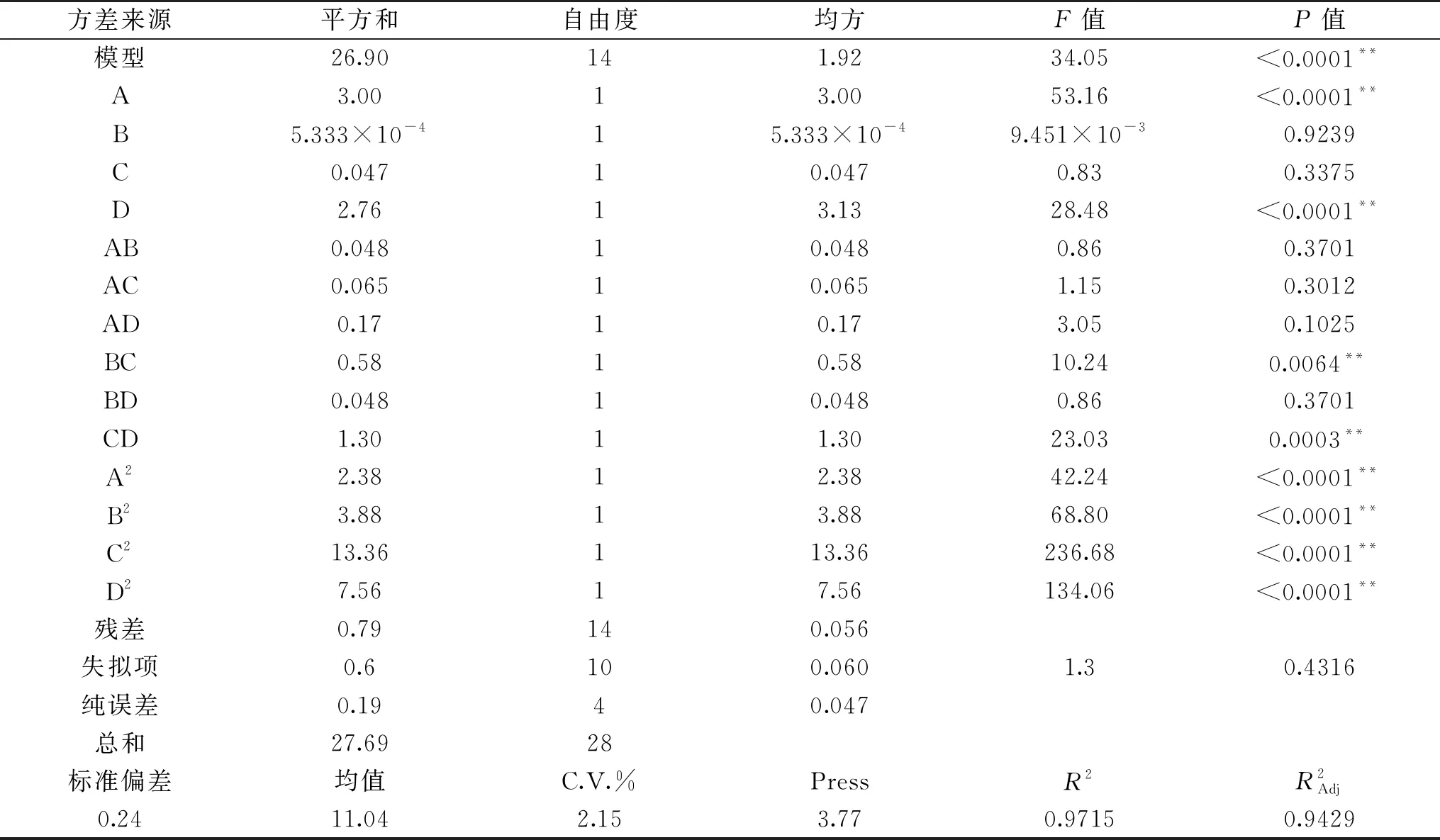
表6 复合酶酶解回归模型方差分析结果Table 6 Results of variance analysis of regression model for complex enzyme hydrolysis
2.5 最佳工艺条件确定和验证实验
通过回归模型预测,得到超声协同复合酶分步提取恰玛古多糖的最佳工艺条件,超声提取阶段最佳条件为:液料比32.85∶1、超声温度61.63 ℃、超声功率250 W、超声时间 43.09 min,复合酶解阶段最佳条件为:酶解pH5.38、酶解温度50.02 ℃、酶加入量2.48%、酶解时间51.97 min,多糖理论得率为12.79%。为便于实际操作,将此工艺条件调整为:在液料比33∶1 mL/g、温度62 ℃、超声功率250 W条件下超声提取43 min后;加入复合酶进行酶解反应,酶解条件为酶解pH5.4、酶解温度50 ℃、酶加入量2.5%、酶解时间52 min,在此工艺条件下进行3次平行验证试验,恰玛古多糖得率为12.62%±0.18%,与理论预测值12.79%相近,说明该回归模型实验设计可靠,采用响应面法优化恰玛古多糖提取工艺是可行的。
3 结论
本实验通过对超声辅助和复合酶两步法提取恰玛古中多糖的工艺研究,最终得到超声辅助和复合酶两步法提取多糖的最佳工艺条件为:超声辅助提取阶段为液料比33∶1 mL/g、超声温度62 ℃、超声功率250 W、超声时间43 min;复合酶法提取阶段为酶解pH5.4、酶解温度50 ℃、酶加入量2.5%、酶解时间52 min,在此条件下恰玛古多糖提取率为12.62%±0.18%,与预测值12.79%无显著差异。
因此,超声协同复合酶分步提取法适用于恰玛古多糖的提取,与传统超声辅助提取法(6.86%)高5.76%[9],比传统热水浸提法(8.86%)高3.76%[6];并具有提取率高、条件温和、高效等优点,可在恰玛古多糖提取工艺及生产中推广应用。

