直穗小檗果粉对STZ诱导的Ⅰ型糖尿病大鼠糖脂代谢的调节作用
1,
(1.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海西宁 810016;2.青海大学农牧学院,青海西宁 810016;3.中国科学院西北高原生物研究所,青海西宁 810001;4.中国科学院大学,北京 100049)
直穗小檗(BerberisdasystachyaMaxim.)、沙棘(HippophaerhamnoidesL.)和唐古特白刺(NitrariatangutorumBobr.)的果实泛称“三刺”果。在西北地区,蒙、藏、维吾尔等少数民族将其作为药用与食用的传统野生浆果,因其为低矮灌木,且具刺,因此统称为“青海三刺”。直穗小檗果实作为高原特色浆果植物资源,天然无毒,具有多种活性物质[1-2],20世纪80年代,已有添加小檗果汁的青海三刺饮料问世[1]。而直穗小檗果在降血脂、降血糖方面的作用和应用还未见报道。
糖尿病(Diabetes Mellitus,DM)是一种由多种病因引起的以慢性高血糖为主要特征的代谢紊乱综合症。研究证明,Ⅰ型糖尿病是完全的胰岛素依赖性疾病,是由胰岛素分泌胰岛β细胞的免疫相关破坏造成的疾病,通常导致高血糖症,高脂血症,和其他糖尿病并发症[3]。近年来,糖尿病调节治疗方面取得了很大的进展,目前糖尿病药物主要包括胰岛素疗法、口服降糖治疗和氧化应激相关的补充剂治疗[4]。同时,还有西药及合成药,如α-糖苷酶抑制剂类、磺脲类和双胍类等化学药物直接作用于胰岛细胞或者改善胰岛素敏感性间接作用[5]。化学药物降糖效果显著、针对性强、降糖机制比较明确,但在降糖的同时也带来许多副作用,特别是对糖尿病并发症的治疗收效甚微。针对这一现象,采用天然药物制备具低副作用的降血脂、降血糖的药物尤为迫切,因此,开发具有良好降脂降糖作用的天然药物产品将具有良好的应用前景[6]。
本论文采用链脲酶素(STZ)诱导的Ⅰ型糖尿病大鼠,对直穗小檗果粉调节糖尿病大鼠血糖和血脂功能进行研究,并初步探讨其调节的作用机制,以期为研发干预糖尿病的功能性食品及青海地区直穗小檗的综合开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
四周龄雄性SD大鼠(8~9周,160~180 g) 甘肃大学,中国医学实验动物中心购买(动物合格证号:SYXK(甘)2011-0001),于实验室内将大鼠单独饲养在鼠笼中,按照光照12 h及黑暗12 h的饲养周期,在温度(22±1) ℃,湿度42%±2%条件下饲养1周后进行实验,大鼠在实验过程中,以标准啮齿动物供给所需食物和蒸馏水,所有的动物方案在“National Institute of Health Guide”指导下进行;直穗小檗鲜果 产自青海互助;链脲酶素(Streptozotocin,STZ) 北京中生瑞泰科技有限公司;格列本脲片 同仁堂大药房;甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL)、高密度脂蛋白胆固醇(HDL)、极低密度脂蛋白胆固醇(VLDL)、超氧阴离子试剂盒、羟自由基试剂盒、谷氨酸转氨酶(AST)、谷丙氨酸转氨酶(ALT)、脂蛋白酯酶(LPL)、肝酯酶(HL)试剂盒、丙二醛(MDA)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH-Px)试剂盒 南京建成生物科技有限公司。
DZX6020真空干燥箱 上海南荣仪器公司;UV-722N可见紫外分光光度计 上海尼柯有限公司;HD型恒温水浴锅 辽阳市恒温仪器厂;血糖测试仪及血糖试纸三诺 天士力大药房;Bio-Rad680型酶标仪 美国伯乐公司;DS-1型组织匀浆仪 上海正慧工贸有限公司。
1.2 实验方法
1.2.1 直穗小檗果粉的制备 直穗小檗鲜果于55 ℃,真空干燥6 h。然后直穗小檗果实去籽,用超微粉碎机粉碎(2000 r/min,1~2 s)后过80目筛网,即得直穗小檗果粉(BDF)。
1.2.2 Ⅰ型糖尿病大鼠模型的建立 大鼠禁食12 h后采用低剂量的链脲酶素(STZ)诱导[7]。将STZ溶解于新鲜的柠檬酸钠缓冲液(0.1 mol/L的柠檬酸钠和0.1 mol/L柠檬酸,pH4.2~4.5),后立即以60 mg/kg的单次剂量对大鼠进行腹膜内注射进行造模。正常对照大鼠用等体积的柠檬酸钠缓冲液注射。在造模期间,给予大鼠5%葡萄糖溶液过夜以克服药物诱导而造成的低血糖期。于STZ或柠檬酸缓冲液注射试验72 h后测定血糖:从大鼠的尾尖端收集血液,用血糖试纸检测血液中的葡萄糖,血糖值大于16.80 mmol/L的大鼠被选定为Ⅰ型糖尿病模型大鼠。
药物治疗模型大鼠四周,末次给予受试物后,使用腹腔注射水合氯醛溶液对大鼠进行麻醉,麻醉后采用颈总动脉插管收集血液。采血后的血样在室温下静止2 h后,经离心(3000 r/min,10 min),得到血清,并在-80 ℃冷冻直至分析。取血完毕后,将大鼠的肝脏、肾脏以及脾脏剥离出后,用磷酸盐缓冲盐水漂洗(PBS,pH=7.4)后,滤纸吸去多余液体并-80 ℃冷冻直至分析。同时,在每块器官的同一部位切去一小块组织,投入10%福尔马林溶液中固定。
1.2.3 实验分组及灌胃情况 空白组和模型组每天灌胃给予超纯水;阳性药组每天灌胃给予格列本脲1次(0.02 g/kg);受试药物组每天灌胃给予直穗小檗果粉1次(低剂量组0.4 g/kg,高剂量组1.6 g/kg),五组均连续灌胃给药28 d(详细给药浓度见表1):

表1 大鼠的分组情况及各组给药量Table 1 The group situation and given amount of medical for each group
1.2.4 各实验组大鼠健康状况及体重的统计 在试验期间,每周[即-7(造模前7 d)、0、7、14、21、28 d]观察大鼠的健康状况,包括饮水量、饮食量、毛色以及脱毛与否、排尿量(垫料干燥程度)、精神状态等方面的观察。
在试验期间,每周(即-7、0、7、14、21、28 d),称各组大鼠的体重。
1.2.5 血糖相关指标的测定 末次给药灌胃结束后禁食过夜,从大鼠的尾静脉获得用于葡萄糖测定血样。血糖的测定采用血糖仪和血糖试纸进行测量。血清胰岛素水平通过使用胰岛素ELISA试剂盒进行测定。
肝脏、肌肉匀浆在冰冷的培养基中通过组织均质化制备(pH为7.4,10 mmol/L的Tris-HCl,0.1 mmol/L的EDTA-2Na,10 mmol/L蔗糖,0.8% NaCl),并在4 ℃下3000 r/min离心10 min后收集上清液。基于Keppler的方法[8]使用糖原测定试剂盒测定肝脏、肌肉中的糖原含量。
1.2.6 血脂相关指标及脂代谢酶活性的测定 血清血脂包括甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)采用试剂盒测定。极低密度脂蛋白(VLDL)是根据Wilson等[9]的方法计算(式1)。
VLDL=0.2×TG
式(1)
肝脏匀浆在冰冷的培养基中通过组织均质化制备,并在4 ℃下3000 r/min离心10 min后收集上清液,上清液制备好后用于测定肝脏标志酶和脂质代谢酶。肝脏标志酶谷氨酸转氨酶(AST)和谷丙氨酸转氨酶(ALT),两种脂质代谢酶即脂蛋白酯酶(LPL)和肝酯酶(HL)含量分别采用试剂盒测定。
1.2.7 体内抗氧化活性的测定 胰腺匀浆在冰冷的培养基中通过组织均质化制备,并在4 ℃下3000 r/min离心10 min后收集上清液。制备所得胰腺上清液和血清用于体内抗氧化活性酶活性测定。蛋白质浓度根据Bradford[10]的方法测定,并以牛血清白蛋白(BAS)为标准。脂质过氧化采用Armstrong等[11]报道方法,采用Zhang等[12]所述的方法测量过氧化氢酶(CAT)的活性。超氧化物歧化酶(SOD)活性通过Marklund所报道的方法[13]。还原型谷胱甘肽酶(GSH-Px)的活性参照Lawrence等[14]的方法。
1.2.8 病理组织切片 取出已固定的胰腺组织,切取合适厚度的组织。经过脱水、透明、浸蜡、包埋、切片、贴片与烤片、脱蜡及水化、染色、脱水、透明和封片的操作过程制得石蜡切片,晾干后即可观察切片。
1.3 实验数据分析
2 结果与分析
2.1 各动物分组试验期间的健康状况
实验期间,各试验组大鼠的健康状况记录见表2。空白组大鼠摄食和饮水均属正常水平,毛色光亮,粪便颜色和量正常,垫料干燥,精神状态活泼健康。模型组大鼠体毛色发黄,暗淡,且脱毛现象严重,多尿,饮水量和饮食量较大,垫料潮湿带有酸涩味,精神萎靡,体质虚弱,易怒较为暴躁,实验期间有个别老鼠死亡。阳性药组大鼠较正常大鼠毛色发黄,较模型组少脱毛,多尿,饮水量和饮食量大,垫料较模型组干燥,精神不活泼。直穗小檗果粉样品组:两剂量组大鼠毛色部分发黄,脱毛轻,多尿,饮水量和饮食量大较模型组明显减轻,精神活泼,有追逐现象发生。
2.2 各动物分组试验期间体重变化
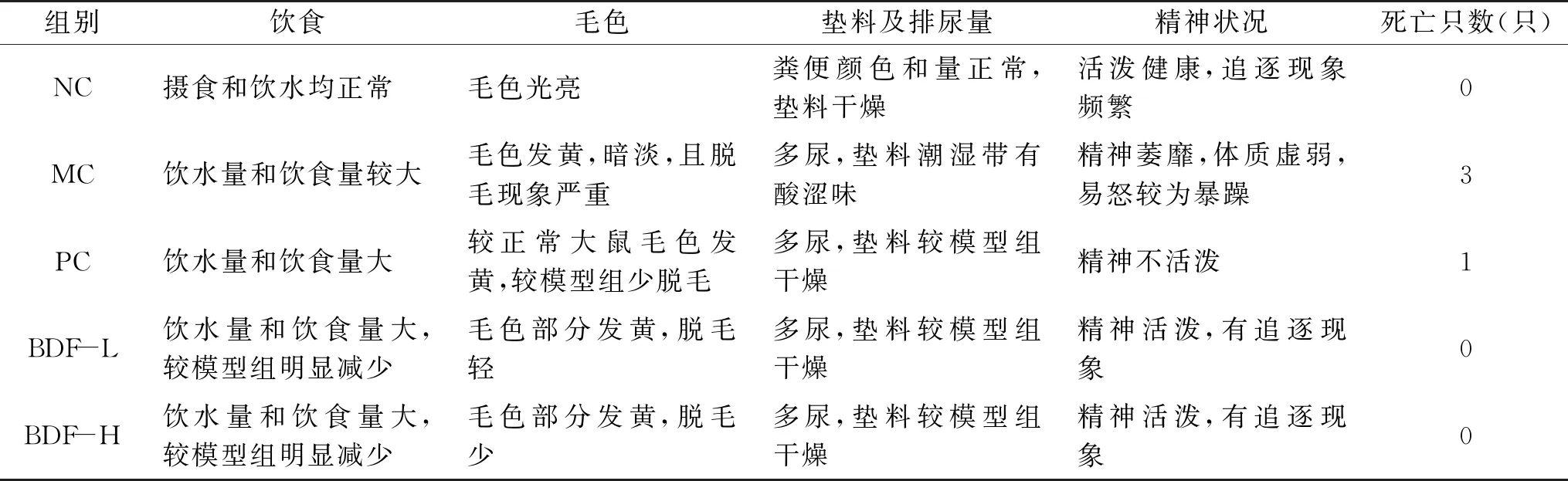
表2 各动物分组试验期间的健康状况Table 2 The health condition of each group

表3 直穗小檗果粉对Ⅰ型糖尿病大鼠体重的影响Table 3 Effect of fruit of Berberis dasystachya M.on the body weight of TypeⅠdiabetic

表4 直穗小檗果粉对Ⅰ型糖尿病大鼠血糖的影响Table 4 Effect of fruit of Berberis dasystachya M.on the blood glucose of TypeⅠdiabetic
实验期间,各试验组大鼠在给药-7、0、7、14、21、28 d的体重记录见表3。由表3可知,模型组体重在实验期间明显下降,这与Ⅰ型糖尿病的发病患者表现出的典型症状一致(即体重迅速下降)。与模型组相比,从第7 d开始直穗小檗剂量组体重均极显著(P<0.01)上升。给药最后一天(28 d),相比模型组糖尿病大鼠的体重,不同剂量(0.4、1.6 g/kg)的果粉给药大鼠体重分别可增幅16.29%和27.02%。此外直穗小檗果粉对糖尿病大鼠体重急剧下降的改善随剂量的增加而增强,其中,阳性组大鼠的体重与模型组相比有极显著性差异(P<0.01),直穗小檗剂量组大鼠的体重与模型组相比有极显著性差异(P<0.01)。以上体重结果说明直穗小檗果粉能显著缓解Ⅰ型糖尿病所致的体重下降。
2.3 直穗小檗果粉对Ⅰ型糖尿病血糖的影响
实验期间,各试验组大鼠在给药-7、0、7、14、21、28 d的血糖记录见表4。如表4所示,健康正常大鼠的血糖水平在5.00 mmol/L左右保持稳定,由于低浓度链脲酶素STZ直接损伤胰岛细胞,导致了Ⅰ型糖尿病,因此造模后,各组造模大鼠的空腹血糖(FBG)与正常大鼠相比均极显著升高(P<0.01)。在给药最后一天(第28 d),低剂量和高剂量果粉组血糖相比模型组分别降低25.17%和26.93%,各给药组大鼠的血糖与模型组相比均极显著下降(P<0.01),且直穗小檗果粉的降血糖作用随剂量的增加而增强。采用直穗小檗果粉对模型组大鼠进行治疗后,血糖水平的显著增加在治疗阶段具有剂量依赖性和时间依赖性。因此,直穗小檗果粉可显著缓解由STZ诱导的高血糖症状,其高剂量组的治疗效果与阳性药格列本脲片相当。
2.4 直穗小檗果粉对Ⅰ型糖尿病胰岛素水平的影响
图1展示了各试验组大鼠在给药28 d后血清中胰岛素的水平。STZ诱导的糖尿病大鼠相比健康正常大鼠,血清胰岛素水平极显著降低(P<0.01)。如图1所示,相比模型组,不同剂量的直穗小檗果粉和格列本脲给药组,均可极显著增加糖尿病大鼠血清胰岛素水平(P<0.01)。此外,与模型组相比,果粉高剂量组可显著增加糖尿病大鼠血清胰岛素水平1.047倍。胰岛素检测结果表明,直穗小檗果粉能显著缓解Ⅰ型糖尿病所致的胰岛素分泌功能障碍的情况,但其缓解的原因有待进一步明确。
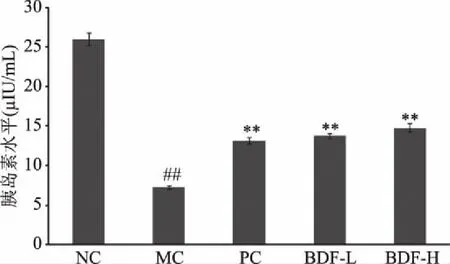
图1 直穗小檗果粉对Ⅰ型糖尿病大鼠胰岛素水平的影响Fig.1 Effect of fruit of Berberis dasystachya M.on the iInsulin level in Type Ⅰ diabetic rats注:NC:空白组;MC:模型组;PC:阳性药组;BDF-L:直穗小檗果粉低剂量组;BDF-H:直穗小檗果粉高剂量组;# P<0.05,##P<0.01与正常组比较;*P<0.05,**P<0.01与模型组比较。图2~图4同。
2.5 直穗小檗果粉对Ⅰ型糖尿病大鼠肝糖原和肌糖原的影响
本实验进一步研究了直穗小檗果粉在抗高血糖过程中,是否参与肝糖原和肌糖原合成,试验结果如图2所示。在STZ诱导的Ⅰ型糖尿病大鼠中(模型组),相比空白组大鼠其肝糖原和肌糖原水平均极显著减少(P<0.01)。直穗小檗果粉高剂量组与模型组相比,可极显著的提高肝糖原含量1.03倍;格列苯脲组与模型组相比,可极显著地提高肌糖原含量0.35倍。直穗小檗果粉和格列苯脲的治疗后结果表明,二者均可改善糖的代谢控制,因此促进了更高效的能量代谢。然而,直穗小檗果粉参与糖原合成以维持稳定的血糖水平的细胞机制,需要进一步的实验得出明确的结论。
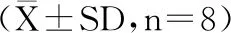
表5 直穗小檗果粉对STZ诱导的大鼠的血脂指标的影响Table 5 Effect of fruit of Berberis dasystachya M.on theserumlipid in Type Ⅰ diabetic
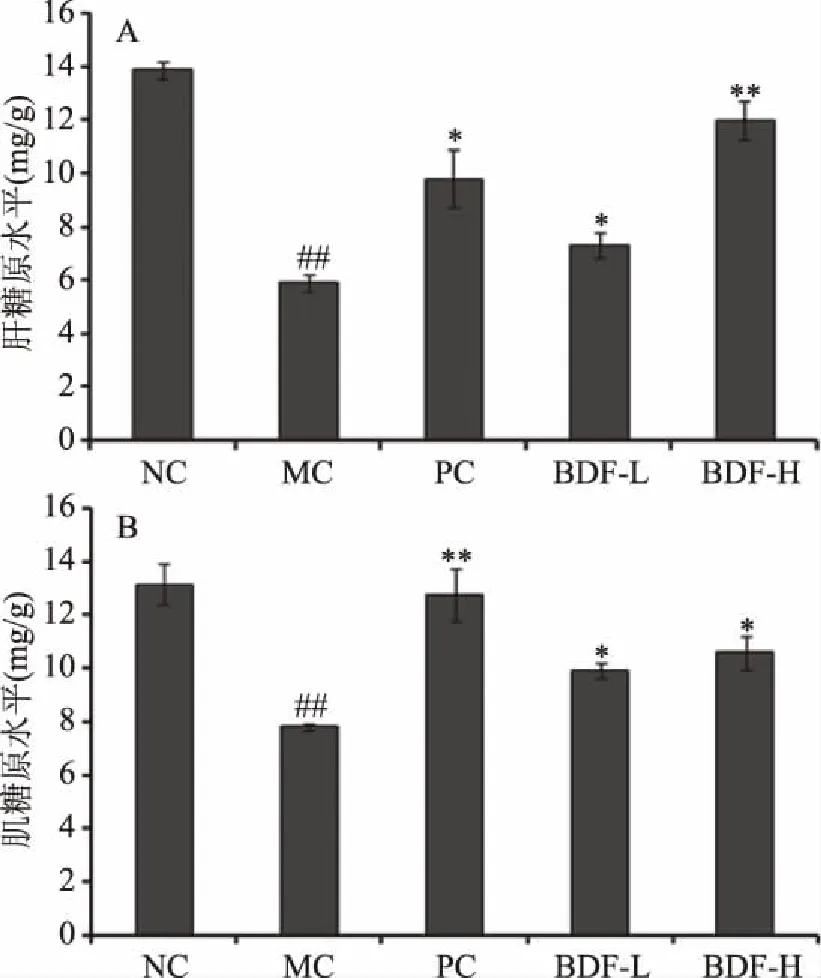
图2 直穗小檗果粉对Ⅰ型糖尿病大鼠肝糖原(A)和肌糖原(B)水平的影响Fig.2 Effect of fruit of Berberis dasystachya M.on the level of hepatic and muscle glycogen of Type Ⅰ diabetic rats
2.6 直穗小檗果粉对Ⅰ型糖尿病血脂及脂代谢的影响
STZ诱导的糖尿病,会使得大鼠胰岛细胞发生核固缩和玻璃样病变。其脂代谢随之发生紊乱。同时大鼠的脂代谢发生紊乱,相关血脂指标及脂代谢相关的酶活性亦发生紊乱。脂蛋白代谢异常可引起各种低血糖症或高血脂症。由于脂质水平升高,导致糖尿病与冠状动脉、心脏疾病、过早动脉粥样硬化的风险增加[15]。血清TC、TG含量是高血脂症的重要指标,HDL能转运胆固醇,其中载脂蛋白又能激活卵磷脂-胆固醇转脂酰基酶,催化卵磷脂分子中β位脂肪酰基与胆固醇作用生成胆固醇酯,使TC和TG含量降低,所以HDL是高血脂症的辅助标志。同时,研究发现,相比于正常对照大鼠或小鼠,STZ诱导的Ⅰ型糖尿病大鼠或小鼠TG,TC和LDL水平显著增加,HDL水平显著下降[15-17]。表5结果显示空白健康大鼠、模型组大鼠和给药组大鼠的四种血脂水平。
与模型组相比,当用不同浓度的直穗小檗果粉的给药处理糖尿病大鼠后,糖尿病大鼠的四项血脂水平均呈现明显的改善。其中,果粉高剂量组相比模型组大鼠四项指标TC、TG、LDL和VLDL分别降低41.17%、33.52%、57.30%、32.85%,HDL调节上升1.44倍。同时,实验表明,直穗小檗果粉治疗STZ诱导的Ⅰ型糖尿病大鼠后,高剂量组对其不同的血脂指标的调节效果与格列本脲的效果相当,而格列本脲作为化学合成的药品,其对机体有一定的副作用,因此可采用天然植物即直穗小檗果粉可做替代保健品使用。
本研究中,直穗小檗果粉治疗STZ诱导的Ⅰ型糖尿病大鼠28 d后,发现在脂质代谢的相关指标发生改变,即TC、TG、LDL相比STZ诱导的糖尿病大鼠显著衰减,并可增加糖尿病大鼠血清HDL的浓度。因此,直穗小檗果粉能够减少动脉粥样硬化和其他心血管糖尿病并发症的风险[18-20]。推测直穗小檗果粉降低血脂水平的作用机制可能有三种,其一,可能充当载体参与胆固醇的代谢和加速传输和/或血清脂质的排泄[21];其二,可能作为胆汁酸合成的促进剂[22];其三,可能作为自由基清除剂,以防止LDL形成氧化的LDL[18]。然而,直穗小檗果粉影响脂质代谢的机制在尚未明确,需要进一步研究。
2.7 直穗小檗果粉对Ⅰ型糖尿病脂代谢的影响
HL是由肝实质细胞合成的一种具有磷A1和甘油三酯水解酶活性,对血浆脂质转运有重要作用的胞外蛋白,HL活力异常与动脉粥样硬化、糖尿病有较高的相关性。LPL是脂肪细胞、心肌细胞、骨骼肌细胞、乳腺细胞以及巨噬细胞等实质细胞合成和分泌的一种糖蛋白[17-18]。LPL是脂蛋白代谢的关键酶,是水解富含甘油三酯蛋白中TG的关键酶[17]。LPL和HL可以分解TG并分解为甘油和游离脂肪酸(FFA),采用铜试剂测定其分解产生的游离脂肪酸就可以分别计算出HL和LPL的活性[19]。因此,LPL和HL酶活性的升高,意味着其脂代谢的增加以及脂蛋白含量的降低。AST和ALT是肝损伤或坏死重要标志[19]。肝脏内的AST与ALT含量在一些药物的刺激下,其体内肝组织受到脂肪细胞侵润,影响相关肝细胞酶活性。一般情况下,格列本脲、辛伐他汀及其他化学药物都会对肝组织有一定的影响。表6为空白大鼠、模型组大鼠及给药组大鼠四种肝脏标志酶的水平。
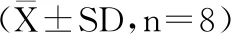
表6 直穗小檗果粉对STZ诱导的大鼠肝脏标志酶的影响Table 6 Effect of fruit of Berberis dasystachya M.on liver markers in Type Ⅰ diabetic
由表6可知,与模型组大鼠相比,直穗小檗果粉能够使患病大鼠的HL和LPL酶活性增加,LPL是清除富含TG脂蛋白的限速酶,从而发挥了其在脂蛋白循环中的重要作用。同时可使糖尿病大鼠的HL活性增加,通过HL作为配体,促进肝细胞摄取胆固醇和乳糜微粒残粒,降低血浆中总胆固醇和甘油三酯浓度,进而达到调节机体脂代谢紊乱的作用。本研究表明,直穗小檗果粉治疗STZ诱导的糖尿病大鼠一段时间后,可显著增强以上两种关键酶的活性,从而调节脂质代谢。
相比格列本脲阳性药组,直穗小檗果粉给药组的AST和ALT活性均有不同程度的降低,说明阳性药组即格列苯脲对肝脏具有损伤作用,而直穗小檗果粉对肝脏则损伤作用较小,直穗小檗果粉高剂量组相比阳性药组,其AST和ALT活性呈现极显著的下降(P<0.01),表明直穗小檗果粉可减少肝损伤。直穗小檗果粉治疗的糖尿病大鼠体内两个肝脏标记酶活性的降低,可能是由于直穗小檗果粉表现出有效的抗氧化剂活性,衰减了肝脏内的细胞损伤。
2.8 直穗小檗果粉对Ⅰ型糖尿病大鼠氧化应激的影响
糖尿病导致升高的血糖和血脂浓度,与肝,肾和胰腺等组织中活性氧化物的形成相关联[20]。Davi等也已经证明胰岛素抵抗的发生与系统性氧化应激有关[18,21]。同时,有研究表明使用抗氧化剂治疗糖尿病实验动物,可降低糖尿病的相关症状,推测可能减少了患病动物体内氧自由基和脂质过氧化物的水平[22]。动物组织或血清内MDA含量作为脂质过氧化程度的标志物,MDA含量的升高意味着组织内或者体内过氧化物损伤增加。CAT、SOD和GSH-Px是动物体内重要的氧化应激防御酶,其活性的增加表明可减少体内或组织内的氧化损伤[23]。图3为各试验组大鼠血清和胰腺中MDA含量的变化,图4为各试验组大鼠血清和胰腺中CAT、SOD和GSH-Px酶活水平的变化。

图3 直穗小檗果粉对Ⅰ型糖尿病大鼠血清(A)和胰腺(B)中丙二醛含量的影响Fig.3 Effects of fruit of Berberis dasystachya M.on MDA in serum(A)and pancreas tissue(B)of Type Ⅰ diabetic rats
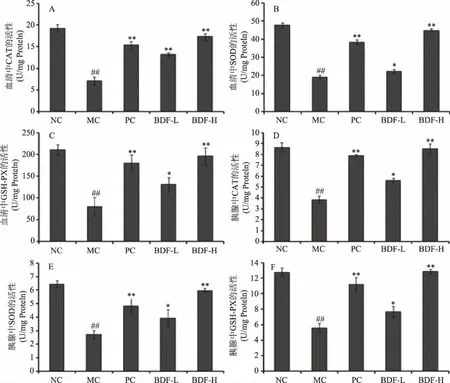
图4 直穗小檗果粉对Ⅰ型糖尿病大鼠血清(A,B,C)和胰腺(D,E,F)中CAT,SOD,GSH-Px含量的影响Fig.4 Effects of fruit of Berberis dasystachya M.on CAT,SOD and GSH-Px in serum(A,B,C)and pancreas tissue(D,E,F)of diabetic rats
直穗小檗果粉对STZ诱导的糖尿病大鼠血清和组织中的MDA、CAT、SOD和GSH-Px的含量及活性均有影响,结果如图3和4所示,与模型组相比,直穗小檗果粉的不同剂量(0.4、1.6 g/kg)均可使MDA水平显著降低,并且可升高糖尿病大鼠血清和组织内CAT、SOD和GSH-Px的活性(P<0.05或P<0.01)。模型组的糖尿病大鼠血清和组织内的MDA含量相对于正常对照大鼠分别升高了1.06倍和2.00倍。当患糖尿病大鼠灌胃给予低剂量和高剂量直穗小檗果粉治疗28 d后,胰腺组织中MDA水平分别减少64.04%和45.00%;血清中MDA水平分别减少56.65%和29.87%。
相比于空白组健康大鼠,模型组大鼠胰腺组织中的CAT、SOD和GSH-Px水平分别下降55.59%,58.04%和56.27%;模型组大鼠的血清中的CAT、SOD和GSH-Px的水平分别降低63.53%,60.23%和61.96%。同时,相比模型组大鼠,发现在糖尿病大鼠血清中的CAT、SOD和GSH-Px酶活性,通过低剂量组直穗小檗果粉治疗后分别增幅88.16%、17.52%和63.43%;通过高剂量组直穗小檗果粉治疗后分别增加了1.46、1.36和1.45倍。相比模型组大鼠胰腺组织中的CAT、SOD和GSH-Px酶活性,通过低剂量组直穗小檗果粉治疗可显著提高三种氧化酶活性,可分别增加45.97%、45.02%和36.80%;通过高剂量组直穗小檗果粉治疗后分别增加了1.22、1.21倍和1.30倍。
不同剂量直穗小檗果粉治疗STZ诱导的Ⅰ型糖尿病大鼠28 d后,均可使糖尿病大鼠血清和组织的MDA水平显著降低,并且可以升高糖尿病大鼠血清和胰腺组织内CAT、SOD和GSH-Px的活性。以上结果表明,直穗小檗果粉可以减轻STZ诱导的Ⅰ型糖尿病大鼠胰腺及血清内的氧化损伤,同时,推测直穗小檗果粉通过改善糖尿病大鼠体内氧化应激程度的效应,进而影响其糖代谢及脂代谢。
2.9 胰腺组织病理学观察
图5呈现了五个试验组大鼠的胰腺组织病理学切片。在正常大鼠体内,其胰腺的胰岛内,大量的胰岛β细胞以固定的形状和形态、定期的、均匀地进行排列(5A)。在糖尿病大鼠中,胰腺组织的由于受到低剂量的STZ的损伤,其胰岛严重损害,包括出现有局灶性坏死和凋亡,组织收缩,β细胞溶解与β细胞数量的减少的现象(5B)。但是,此现象随着格列本脲和直穗小檗果粉不同剂量的治疗,发现以上病变明显减少。不同剂量的直穗小檗果粉治疗糖尿病大鼠后(5D和5E),可有效缓解了胰岛架构的损伤,并伴随着胰腺β细胞数量增加。相对于阳性对照组,其高剂量组的大鼠体内胰岛损伤有更明显的改善。说明直穗小檗果粉能一定程度地修复STZ对胰岛造成的损伤,推测其损伤的修复可能与胰岛细胞的氧化应激有关。即直穗小檗果粉通过改善糖尿病大鼠体内氧化应激程度的效应,进而可在一定程度上减轻胰岛胰岛β细胞的损伤及凋亡。
3 讨论与结论

图5 Ⅰ型糖尿病大鼠胰腺病理组织切片Fig.5 Histopathology examination of pancreas in diabetic rats(H&E stain)注:A为空白组;B为模型组;C为阳性药组;D为直穗小檗果粉低剂量组;E为直穗小檗果粉高剂量组。
目前糖尿病的化学诱导造模法通常使用四氧嘧啶和链脲酶素(STZ),两种均是具毒性的诱导型化学合成试剂[24]。Rakieten等[25]首次报道,采用STZ致胰岛β细胞损伤进而导致糖尿病的模型。STZ,一种氨基葡萄糖-亚硝基脲,是一种DNA烷基化试剂,通常在实验动物糖尿病模型建立中作为一种高毒性的β细胞诱导剂[26]。天然的链脲佐菌素是由一种链球菌产生的抗生素,与葡萄糖的化学结构具有很高的相似度,以至于葡萄糖转运蛋白2(GLUT2)会将其当做葡萄糖转运至细胞中,而胰岛细胞内含有大量的GLUT2。STZ进入胰岛细胞后通过DNA烷基化的方式损害DNA,对细胞产生毒性。对β细胞的DNA损伤将诱导ADP-核糖基化的活化,ATP去磷酸化反应增强,同时,可导致超氧化物自由基和羟基自由基的形成[27]。胰岛β细胞的凋亡机制可能以这样的途径进行,因此,降低糖尿病患者体内的自由基,提高氧化应激能力可以作为一种有效的治疗途径,帮助减轻糖尿病并发症。Junod等[28]报道,Wistar雄性大鼠腹腔注射STZ后,观察到β细胞大量坏死,β细胞数量明显减少。STZ所致的速发型糖尿病动物模型,接近于人的Ⅰ型糖尿病。本研究对雄性SD大鼠采用低浓度、单剂量腹腔注射STZ的方法诱导Ⅰ型糖尿病模型的建立。目前关于低剂量链脲酶素诱导大鼠患Ⅰ型糖尿病的发病机制尚未研究清楚,推测其发病机制类似于四氧嘧啶。
本研究通过动物试验发现经STZ诱导的糖尿病大鼠血液中的葡萄糖水平、体重和血清胰岛素在服用直穗小檗果粉后均有所改善。通过直穗小檗果粉的治疗,糖尿病大鼠体重高于模型组大鼠,推测其原因是增加脂肪储存或减少脂肪分解。此外,高血糖的降低可能是由于果粉增加了患病大鼠胰岛素的敏感性。直穗小檗果粉可改善糖的代谢控制,使糖尿病大鼠获得更高效的能量代谢,以抵抗高血糖症;其次,直穗小檗果粉参与了脂代谢的控制,并且对其关键酶具有一定的调节作用;同时对血清和组织中的氧化应激酶以及MDA水平具有调节作用,推测其是改善胰岛细胞损伤的主要机制之一。然而,直穗小檗果粉参糖代谢与脂代谢的控制,以及参与调节氧化应激的细胞机制尚未明确,需要进一步进行实验以得出明确的结论。

