核桃低聚肽对亚健康大鼠氧化应激和炎症反应的影响
刘 睿,康家伟,珠 娜,张 亭,王天星,杜 倩,张 黎,李 勇
(北京大学医学部公共卫生学院,北京 100191)
亚健康(Sub-health)是指处于疾病与健康之间的一种中间状态,又称为“次健康状态”、“第三状态”,根据其成因及表现,主要分为躯体性亚健康、心理性亚健康和社会交往亚健康状态[1-2]。随着社会竞争的日趋激烈、行为和生活方式的改变、环境污染等因素,亚健康人群呈逐年上升趋势[3]。我国亚健康人群比例为60%~70%,其中处于疲劳型亚健康状态的比例近35%,亚健康高发人群多为青壮年,年龄段位于30~50岁[4]。亚健康状态不符合现代医学有关疾病的临床诊断标准的特点,且易向慢性非传染性疾病方向发展,甚至是癌症等重大疾病的征兆,严重威胁人类的健康。但由于亚健康尚属于未病的范畴,且引起不适的确切原因未明,临床上多采用对症治疗,常用药物有消炎镇痛药类、抗抑郁药、抗疲劳药物等,但这些药物多有副作用,不宜长期服用。因此,通过功能性食品防治亚健康的发生发展成为当今亚健康研究的新趋势。
核桃(JuglansregiaL.)又称胡桃、羌桃,胡桃科胡桃属植物。我国是核桃的原产地之一,栽培历史已有7000多年。明代的《本草纲目》记载:“核桃味甘性平微苦微涩,有补肾固精、健脾补血、通便润肠、宁心安神等功效”。现代研究发现,核桃中不仅含有丰富的蛋白质、糖类、脂类成分,更含有人体需要的不饱和脂肪酸、VE、黄酮、叶酸、多酚类等多种生理活性成分[5]。核桃低聚肽(walnut oligopeptides,WOPs)是利用生物酶解技术从核桃蛋白中提取的小分子生物活性肽,近年来研究发现,低聚肽比单个氨基酸的吸收更有效,有效提高了蛋白质的吸收利用率[6]。现有研究发现核桃低聚肽具有提高记忆力[7]、抗辐射[8]、润肠通便[9]、提高性功能[10]等多种生物活性。研究报道核桃肽可以延长实验动物力竭游泳时间,加速乳酸消除,有效促进实验动物疲劳的恢复和延缓疲劳的发生[11-12]。但尚未见核桃低聚肽防治亚健康的相关报道。本研究根据国内外文献报道,通过复合因素即睡眠剥夺(中枢疲劳)与负重力竭游泳(外周疲劳)相结合,在运动疲劳的基础上添加精神上的影响,建立亚健康大鼠模型[13-15],探讨核桃低聚肽对亚健康的防治作用及其可能机制,为核桃低聚肽用于防治亚健康提供理论和实验依据。
1 材料与方法
1.1 材料与仪器
核桃低聚肽 淡黄色固体粉末,购自北京天肽生物科技有限公司提供,通过高效液相色谱法分析WOPs分子量及氨基酸组成,分子量小于1000 Da的低聚肽占86.5%,小于2000 Da的肽类总量高达96.5%,游离氨基酸含量为2.98 g/100 g,其中精氨酸、苯丙氨酸、酪氨酸、亮氨酸含量较多;健康SPF级雄性SD大鼠 60只,8周龄,体重(200±20) g,由北京大学医学部实验动物中心提供(实验动物许可证号:SYXK(京)2011-0039;实验动物生产许可证号:SCXK(京)2011-0012);丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low densitylipoprotein-cholesterol,LDL-C)、血尿素氮(Blood urea nitrogen,BUN)检测试剂盒 英科新创(厦门)科技有限公司;超氧化物歧化酶(Superoxide dismutase,SOD)、还原型谷胱甘肽(Reduced glutathione,GSH)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-PX)、丙二醛(Malondialdehyde,MDA)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin,IL-6)、白介素-1β(interleukin,IL-1β)和脂多糖(Lipopolysaccharide,LPS)检测试剂盒 北京麦格泰克科技有限公司。
Adventurer TM通用型分析天平 美国奥豪斯国际贸易有限公司;5804R高速冷冻离心机 德国艾本德股份公司;DZKW-4电热恒温水浴锅 北京天林恒泰科技有限公司;AU400全自动生化仪 日本奥林巴斯株式会社;FSH-2A可调高速电动匀浆机 金坛市金南仪器厂;GNP-9080型隔水式恒温培养箱 上海创奕科教设备有限公司;BMG FLUO star Omega多功能酶标仪 德国 BMG LABTECH公司。
1.2 实验方法
1.2.1 实验动物与分组 实验大鼠饲养在北京大学医学部实验动物科学部,单笼饲养,自由饮食、饮水。适应性喂养一周后,进行适应性游泳训练(水深50 cm,水温(30±1) ℃;每日一次,每次10 min,连续3 d)。适应性游泳训练结束后,根据体重将大鼠随机分为6组,每组10只:正常对照组、模型对照组、核桃低聚肽(WOPs)低、中、高剂量组(220、440、880 mg/kg·bw,分别对应WOPs 1、WOPs 2和WOPs 3组)。正常对照组和模型对照组大鼠经口灌胃给予蒸馏水,核桃低聚肽组给予相应浓度受试物,灌胃量为1 mL/100 g。实验期间,大鼠单笼饲养、自由饮水进食。
1.2.2 建立亚健康疲劳大鼠模型 分组结束后,采用睡眠剥夺+5%负重游泳的复合方式制备亚健康疲劳大鼠模型[13-15]:正常对照组大鼠正常饲养,其余四组大鼠放入盛有2.2 cm水深的动物笼中,迫使其保持站立的姿态不能睡眠从而导致疲劳。每笼1只,连续5 d,每日早晚各换水1次。造模期间,每日经口灌胃给予受试样品一次,自由饮水进食,水温维持与室温相近(23±1) ℃。5 d后,各组大鼠于末次给予受试样品1 h后[16],在鼠尾根部负荷5%体重的铅皮,置于游泳箱中进行负重力竭游泳实验(水深50 cm,水温(30±1) ℃)。采用力竭判断标准为大鼠游泳协调性显著性下降、身体下沉、水淹没鼻尖至再次浮出水面超过10 s[16-17]。记录大鼠自游泳开始至力竭的时间,作为大鼠负重游泳时间。负重游泳结束后,采用乙醚麻醉处死大鼠,进行相关指标的检测。
1.2.3 指标检测
1.2.3.1 脏器系数的测定 负重游泳结束后,采用乙醚麻醉处死大鼠,称量体重,然后分离肝脏、肾脏、肾周脂肪和附睾脂肪称重(g)。称量肝脏、肾脏、肾周脂肪及附睾脂肪重量(g),并根据公式计算脏体比和脂体比。
脏体比(%)=脏器重量×100/体重
脂体比(%)=(肾周脂肪重量+附睾脂肪重量)×100/体重
1.2.3.2 血清生化指标检测 负重游泳结束后,采用乙醚麻醉处死大鼠,股动脉采血,在4 ℃ 3000 r/min离心10 min 吸取上清,使用全自动生化仪检测血清ALT、AST、TC、TG、HDL-C、LDL-C和血尿素氮BUN含量。

表1 核桃低聚肽对大鼠体重和脏器系数的影响Table 1 Effects of WOPs on the body weight and organ index in
1.2.3.3 ELISA法检测血清氧化应激和脂质过氧化指标 血液3000 r/min离心10 min后,分离血清,根据试剂盒说明书用 ELISA 法检测血清SOD、GSH、GSH-Px和MDA含量。
1.2.3.4 ELISA法检测血清TNF-α、IL-6、IL-1β和LPS水平 血液3000 r/min离心10 min后,分离血清,根据试剂盒说明书用 ELISA 法检测血清中TNF-α、IL-6、IL-1β和LPS的水平。
1.3 数据处理
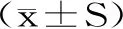

表3 核桃低聚肽对大鼠血清生化指标的影响Table 3 Effects of WOPs on serum biochemical parameters in
2 结果与分析
2.1 核桃低聚肽对亚健康大鼠体重、脏器系数的影响
如表1所示,大鼠初始体重各组间无显著性差异(P>0.05)。造模5 d后,模型组大鼠体重极显著低于正常对照组(P<0.01)。与正常对照组相比,模型对照组大鼠肝脏重量、肾周脂肪、附睾脂肪和脂体比均极显著降低(P<0.01),肾脏重量、肾体比显著降低(P<0.05)。与模型对照组相比,3个核桃低聚肽组除了低剂量组(WOPs 1)肝脏重量与附睾脂肪重量高于模型对照组(P<0.05),其它指标差异均无统计学意义(P>0.05)。
2.2 核桃低聚肽对亚健康大鼠负重游泳时间的影响
在负重力竭游泳测试中,模型对照组大鼠游泳时间极显著低于正常对照组(P<0.01)。核桃低聚肽组大鼠游泳时间长于模型对照组,其中核桃低聚肽中剂量组(WOPs 2)与模型对照组相比差异显著(P<0.05),高剂量组(WOPs 3)具有极显著差异(P<0.01)。

表2 核桃低聚肽对大鼠负重游泳时间的影响Table 2 Effects of WOPs on weight-loaded forced swimming endurance time in
2.3 核桃低聚肽对亚健康大鼠血清生化指标的影响
血清ALT、AST水平是评价早期肝损伤的常用指标。由表3可知,与正常对照组相比,模型对照组ALT、AST含量均极显著升高(P<0.01)。核桃低聚肽低剂量组和中剂量组ALT、AST含量显著低于模型对照组(P<0.05或P<0.01)。血清TC、TG、HDL-C、LDL-C含量在各组间均无统计学差异(P>0.05)。模型对照组和核桃低聚肽各剂量组BUN水平较正常对照组均极显著升高(P<0.01),但核桃低聚肽剂量组与模型对照组相比无统计学差异(P>0.05)。
2.4 核桃低聚肽对亚健康疲劳大鼠氧化应激的影响

表5 核桃低聚肽对大鼠血清炎症因子和脂多糖的影响Table 5 Effects of WOPs on inflammatory cytokine and lipopolysaccharide levels in
如表4所示,与正常对照组相比,模型对照组SOD、GSH活性显著降低(P<0.05),表明亚健康大鼠体内发生了一定程度的氧化应激损伤。与模型对照组相比,核桃低聚肽高剂量组SOD活性显著增高(P<0.05);3个核桃低聚肽剂量组GSH活性均极显著高于模型对照组(P<0.01)。GSH-Px含量(核桃低聚肽高剂量组除外)在各组间均无统计学差异(P>0.05)。

表4 核桃低聚肽对大鼠氧化应激指标的影响Table 4 Effects of WOPs on serum oxidative stress
2.5 核桃低聚肽对大鼠过氧化产物的影响
如图1所示,与正常对照组相比,模型对照组MDA含量显著增高(P<0.05)。与模型对照组相比,核桃低聚肽各组MDA含量均降低,其中高剂量组大鼠血清MDA含量显著低于模型对照组(P<0.05)。
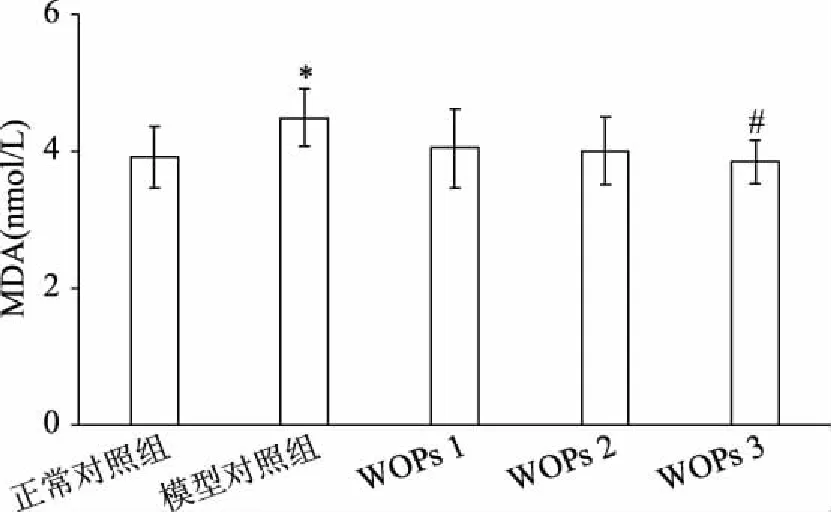
图1 WOPs对大鼠血清MDA含量的影响Fig.1 Effects of WOPs on serum
2.6 核桃低聚肽对亚健康疲劳大鼠细胞因子的影响
如表5所示,与正常对照组相比,模型对照组血清TNF-α显著升高(P<0.05)、IL-1β水平均极显著升高(P<0.01)。与模型对照组相比,3个核桃低聚肽干预组TNF-α、IL-1β水平均显著低于模型对照组(P<0.05或P<0.01);核桃低聚肽高剂量组IL-6含量显著低于模型对照组(P<0.05)。LPS水平在各组间均无显著性差异(P>0.05)。
3 讨论与结论
国内外对亚健康问题的研究中面临的重点问题是缺乏成熟的实验动物模型,很多研究借鉴疲劳动物模型来制备亚健康动物模型,如悬吊、束缚、游泳、跑台等,但跑台运动易引起实验动物足部和尾部的损伤,悬吊和束缚作为应激刺激与人类疲劳的应激原因明显不同,不具备相似性。而且上述单一因素造模无法确定模型是否处于亚健康状态,不宜应用到亚健康动物模型的制备中[18]。大鼠游泳疲劳模型是目前国内外比较公认的实验动物疲劳模型,采用5%负重力竭游泳模型,力竭是疲劳长期积累而引起机体功能紊乱的病理状态,负重力竭游泳时间的长短可以反映动物疲劳的程度,是评价实验动物抗疲劳能力的有效指标[19]。本研究在以往研究单一因素及复合因素建立亚健康模型的基础上,综合考虑亚健康状态者的疲劳、失眠、活力降低等主要表现,采用睡眠剥夺(中枢疲劳)与负重力竭游泳(外周疲劳)复合造模法,在运动疲劳的基础上添加精神上的影响,来制备亚健康疲劳大鼠模型,并在既往研究和预实验的基础上,设计了高、中、低3个WOPs剂量组(220、440、880 mg/kg·bw)。研究发现与正常对照组相比,模型对照组大鼠体重、体脂比明显下降,精神状态差、易疲劳、易激惹。核桃低聚肽各剂量组大鼠负重游泳时间的持续时间均高于模型对照组,其中核桃低聚肽中、高剂量组大鼠负重游泳时间相比模型对照组显著延长(P<0.05或P<0.01),表明核桃低聚肽有效增强了亚健康疲劳大鼠体力和运动耐力,起到了防治亚健康疲劳的效果。
研究发现,在力竭性运动过程中,血液的重新分布、能源物质的消耗和代谢产物的堆积等,都会不同程度地影响肝脏组织的结构和功能[19]。机体内含有20余种转氨酶,当肝细胞被破坏时,转氨酶便会进入血液,通过测定血清或血浆中转氨酶的活性,即可反映肝细胞受损情况,其中以ALT和AST的升高最为敏感。本研究结果显示,模型对照组大鼠血清ALT、AST水平相较正常对照组极显著升高(P<0.01),说明模型对照组大鼠肝功能出现了损伤,聂晓莉等[20]的研究中也出现了相似结果。在本研究中,核桃低聚肽干预后,低、中剂量组大鼠血清ALT、AST水平显著降低(P<0.05或P<0.01),说明核桃低聚肽对亚健康大鼠出现的肝损伤有一定的保护作用。血清尿素氮是肾功能能量代谢的产物。较长时间运动后,当糖、脂肪代谢不能供给机体足够的能量时,蛋白质和氨基酸分解代谢加强,导致机体中血尿素氮含量增加。体内尿素氮和身体耐力之间呈正相关,即身体承受运动耐力越差,尿素氮水平增加越多[21]。模型对照组和核桃低聚肽剂量组BUN水平较正常对照组均极显著升高(P<0.01),但各模型组间无统计学差异(P>0.05)。此外血清TC、TG、HDL-C、LDL-C水平在各组间也未发现统计学差异(P>0.05),提示核桃低聚肽对亚健康大鼠肾功能和脂代谢的影响尚不明确,还有待进一步研究。
亚健康状态与氧化应激反应关系密切,当活性氧分子水平超过机体清除能力时,大量活性氧蓄积,造成DNA、蛋白质、脂质及某些重要酶的损害,同时力竭性运动时机体自由基产生增多,脂质过氧化程度也会增加,加重对机体的损伤[22]。SOD是机体清除自由基的首要物质,可抵制氧自由基对细胞造成的损害,并及时修复受损细胞;GSH是机体重要的抗氧化物质之一,它能敏感有效地反映机体氧化应激状态;GSH-Px是体内广泛存在的一种催化过氧化物分解的酶,可使脂质过氧化物分解成相应的醇类,从而起到保护细胞膜结构和功能完整的作用[23-24]。在疾病或应激状态下,SOD活性、GSH含量、GSH-Px活性均会下降。本研究结果表明,模型对照组SOD、GSH活性显著低于正常对照组(P<0.05),表明亚健康大鼠体内发生了氧化应激损伤,说明核桃低聚肽在一定程度上缓解了亚健康引起的氧化应激损对机体的损伤。
MDA作为脂质过氧化的终产物具有很强的细胞毒性,可以特异的反映机体内脂质过氧化的程度,间接反映出细胞损伤的程度[25]。本研究结果显示模型对照组MDA含量显著高于正常对照组(P<0.05),说明经模型组大鼠体内发生了明显的脂质过氧化反应。核桃低聚肽干预后,高剂量组大鼠血清MDA含量显著低于模型对照组(P<0.05),提示核桃低聚肽干预可显著降低亚健康状态引起的大鼠体内脂质过氧化反应。核桃低聚肽可在一定程度上抑制亚健康引起的机体过度氧化应激和脂质过氧化反应,从而起到保护机体免受氧化应激损伤的作用,这也与之前对核桃低聚肽具有抗氧化作用的研究相符[26]。
疲劳是亚健康的主要表现之一,疲劳状态下炎症反应在体内广泛存在,大量细胞因子产生和累积加重了机体的损伤[27]。细胞因子由循环系统和组织内的白细胞及其它细胞产生,包括IL-1β、IL-6、TNF-α等,是炎症反应时免疫系统和神经内分泌系统之间的重要媒介物质。IL-1除了能通过刺激蛋白酶的合成影响肌肉炎症反应外,还可以诱导其它细胞因子的表达;TNF-α的作用与IL-1有交迭,能增加白细胞的附着性、激发白细胞的功能和增加巨噬细胞的活性,与炎症反应、脂质代谢和细胞死亡都密切相关;IL-6是另一个重要的促炎因子[28-29]。LPS是革兰氏阴性菌细胞壁外模的主要组成部分,一旦进入血液被免疫系统识别,便会引发内毒素血症。本研究结果显示,模型对照组亚健康大鼠血清TNF-α、IL-1β水平均极显著高于正常对照组(P<0.01),但血清LPS水平在各组间无显著性差异(P>0.05),表明亚健康模型大鼠体内发生了炎症反应,刺激了炎症因子的过量产生,但尚未观察到肠源性内毒素血症的发生。核桃低聚肽剂量组TNF-α、IL-1β水平均显著低于模型对照组,高剂量组IL-6含量显著降低(P<0.05或P<0.01),表明核桃低聚肽可在一定程度上改善机体炎症反应,具有一定的抗炎作用。
综上所述,本研究通过模拟亚健康相关发生发展因素,使大鼠站立于水盒中连续5 d,并结合负重力竭游泳实验,制备了亚健康疲劳大鼠模型。核桃低聚肽的干预能够明显提高亚健康大鼠力竭游泳时间,改善模型大鼠血清转氨酶水平异常,提高抗氧化酶活力和抗氧化物质含量,降低脂质氧化产物水平,抑制血清炎症因子水平的升高,从而延缓和减轻了亚健康状态对机体的伤害,提示核桃低聚肽能够较好地对抗亚健康,这位改善亚健康的临床研究提供了科学依据。但仍有许多问题有待进一步探讨。其一,动物模型目前并没有统一定论,造模方式各不相同,稳定性、相似性、可重复性还有待加强,因此亟待建立成熟的亚健康动物模型;其二,目前关于核桃低聚肽的研究相对较少,还需继续优化剂量设置,进行更深入的研究。此外也需要人群研究进一步证实其对亚健康状态的改善效果及适宜剂量。

