基于动物模型的大豆球蛋白诱导肠黏膜过敏反应机理研究
刘 欣 曹广添 陶 菲 张素银 杨喆曦 李永德
(中国计量大学标准化学院 杭州310018)
食物过敏被视为一种严重的公共营养卫生问题,引起全球广泛的关注[1-2]。大豆是人类和动物主要的蛋白质来源之一,同时也是联合国规定的8类主要致过敏食物之一。研究显示,大豆中的致敏因子极大地影响幼年动物对蛋白质的有效吸收,可以引起人和幼年动物发生过敏反应,因而限制了大豆及其制品在食品和饲料工业中的应用[3-4]。
近年来试验动物模型成为评价蛋白过敏性的一个重要手段。以小鼠、大鼠和猪为过敏动物试验模型的研究均有报道[5-7]。然而,至今仍存在很多因素限制了动物模型的应用,比如动物的种类、年龄、性别和对过敏原的敏感性,关于大豆蛋白的过敏试验动物模型也鲜有报道。课题组前期试验结果表明:Balb/c 小鼠模型是一种有效评估大豆蛋白过敏的动物模型[8-9]。王翠燕等[10]的研究也证明了Balb/c 小鼠动物模型可用于评价大豆球蛋白的致敏性。
虽然目前对食物引发个体过敏反应的具体机制尚不清楚,但是许多研究显示食物过敏原的致敏途径是通过胃肠道[11-12]。而食物过敏中黏膜免疫反应的产生一般是由肠黏膜本身对食物抗原口服耐受失败而造成的[13]。黏膜中具有调节、抑制功能的T 淋巴细胞亚群 (Th3,Tr1,CD4+CD25+T 细胞)数量及功能下调,对CD4+T 效应细胞的主动抑制作用降低,导致黏膜中免疫介导的炎症-抗炎平衡破坏,是细胞免疫反应亢进造成肠道损伤的重要原因[14]。目前关于大豆蛋白过敏原诱导的肠道过敏反应发生机理尚未清楚。
基于此背景,在现有研究基础上,针对目前食品中常见的大豆蛋白中主要过敏成分——大豆球蛋白(glycinin)和β-伴球蛋白(β-conglycinin),用易致敏的Balb/c 小鼠作为试验动物,通过连续5周的灌胃方式建立过敏试验动物模型。从肠黏膜免疫的角度探讨大豆球蛋白和β-伴球蛋白诱导Balb/c 小鼠黏膜过敏反应的机制,以期为进一步研究大豆球蛋白和β-伴球蛋白的过敏机理以及预防大豆过敏的发生提供科学依据。
1 材料与方法
1.1 材料与试剂
大豆球蛋白和β-伴球蛋白提取方法参照刘欣[15]的试验方法。T 细胞亚群免疫组化检测试剂盒:EnVisionTM+加强试剂盒产品,CD3、CD4 和CD8 均为鼠来源的单克隆抗体及IgA 免疫组化染色盒,均来自丹麦DAKO 公司;α4β7 整合素为鼠来源,美国Santa Cruz;原位凋亡细胞检测试剂盒(In Situ Cell Death Detection Kit,Code DMK500 Lot:BK1502),TaKaRa 公司。
1.2 仪器与设备
XDS-1B 型生物倒置显微镜,德国莱卡;DK-8D 型水浴锅和78HW-1 型恒温磁力搅拌器,常州金坛市水北康辉实验厂;MH-1 型微量振荡器,江苏海门市麒麟医用仪器厂;台式高速低温冷冻离心机5810R,德国Eppendorf;PTC-200 型热循环仪,北京东胜创新生物科技有限公司;流式细胞仪(BD FACSCalibur TM),美国 Bection Dickinson 公司。
1.3 试验动物
清洁级雌性小鼠Balb/c,体重(20±2)g,6 周龄,购自浙江省医学科学院试验动物中心(动物生产许可号22-2001001),按Kinpples 等[16]的方法连续传两代,以第3 代雌鼠(6 周龄)作为试验对象。Balb/c 小鼠按组分笼饲养,自由饮用去离子水与进食。动物房温度19~25 ℃,湿度55%~65%,(不含豆粕)喂养,光照10~12 h/d,鼠笼每周清洗消毒2 次。
1.4 试验方法
1.4.1 动物分组及模型建立 将6 周龄雌性Balb/c 小鼠随机分为3 组共96 只,每组32 只,每组4 个重复,每个重复8 只,分笼饲养。饲喂颗粒饲料,预试7d 后,进入正式期。按如下方法设计:
对照组(Saline):每天分别灌胃1 mL/只生理盐水;
试验组 (Glycinin):每天分别灌胃1 mg/mL glycinin/只;
试验组(β-conglycinin):每天分别灌胃1 mg/mL β-conglycinin/只。
连续灌胃35 d,每天自由采食和饮水,按试验动物饲养方法饲养。在试验第33 天进行大豆球蛋白肠道激发后48 h 处死小鼠,以排除速发型过敏反应对小鼠小肠的影响。
1.4.2 肠黏膜相关淋巴组织的测定 肠黏膜Peyer's 结数量的观察:参考周华[17]的方法。处死动物后,小心取出全小肠,肉眼计数小肠Peyper's 结的数量。
1.4.3 小鼠小肠绒毛CD3+、CD4+、CD8+T 淋巴细胞观察及计数 采用T 细胞亚群免疫组化检测试剂盒(EnVisionTM+加强试剂盒产品)。阳性结果和分布情况:在小肠黏膜层内主要在固有层内,定位于单个核细胞的胞膜和/或胞浆,阳性呈现棕黄色或黄色;量化:显微镜下随机选取5~10 个高倍视野(400 倍),细胞总数大于500 个,计算各视野内的阳性细胞百分数,再取均数。阳性细胞的百分数=视野内阳性细胞数/视野内总细胞数×100%,然后进行整理及统计分析。
1.4.4 TUNEL 法检测小鼠小肠绒毛上皮细胞凋亡 采用原位凋亡细胞检测试剂盒测试肠绒毛上皮细胞凋亡的情况。TUNEL 的测量:每张切片在200 倍视野下计数200 个以上细胞。每只小鼠选取3 张切片,每组均观察8 只小鼠。细胞中阳性的凋亡细胞数,换算成凋亡指数(AI),AI=视野内的阳性细胞数/视野内总的细胞数×100%,然后进行整理及统计分析。
1.4.5 小鼠小肠固有层中IgA+浆细胞检测 免疫组化检测试剂盒测试。结果:IgA+的阳性表达主要为肠黏膜固有层的炎症细胞的胞浆内等。阳性呈棕黄色定位于细胞浆内,阴性细胞核呈蓝色。
1.5 统计学处理
采用SPSS 19.0 软件中的One-way ANOVA进行方差分析,试验结果以平均数±SD 表示。方差分析差异显著时采用邓肯法(Duncan test)进行多重比较;差异显著性水平为P<0.05。
2 试验结果
2.1 肠黏膜Peyer’s 结数量的观察
肠黏膜淋巴集合小结(PP 结)数量的观察结果如图1所示。灌胃大豆球蛋白和β-伴球蛋白组小鼠的PP 结尽管差异不显著,但有增加的趋势(8.13 vs11.25;8.13 vs 11.63)。
2.2 小鼠小肠绒毛T 淋巴细胞观察及计数
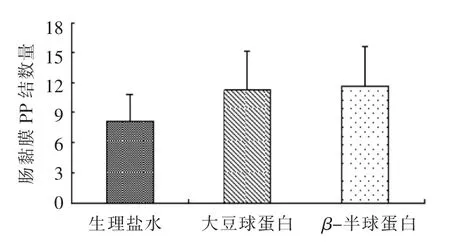
图1 大豆球蛋白和β-半球蛋白对小鼠肠黏膜淋巴集合小结(PP 结)数量的影响Fig.1 Effect of soybean glycinin and β-conglycinin on the number of peyer's patches in the intestinal mucosa of mouse
图2表明,灌胃glycinin 组的小鼠小肠绒毛固有层中CD3+、CD4+LPL 的数量显著高于对照组(P<0.01),CD8+的数量与对照组相比无显著差异。灌胃β-伴球蛋白组的小鼠小肠绒毛固有层(LPL)中CD3+LPL 和CD8+LPL 的数量 (P<0.05)以及CD4+ LPL 的数量(P<0.01)显著高于对照组;两个试验组中整合素α4β7 的数量显著高于对照组;各组CD4+/CD8+的比值无显著差异。灌胃大豆球蛋白组的小鼠小肠上皮淋巴细胞(IEL)中CD3+、CD4+IEL 数量显著高于对照组(P<0.05),及整合素α4β7的数量也显著高于对照组(P<0.01);而CD8+IEL和CD4+/CD8+IEL 的数量均无显著差异。灌胃β-伴球蛋白组的小鼠小肠中CD3+、CD4+和CD8+IEL数量及整合素α4β7 的数量显著高于对照组(P<0.01),CD4+/CD8+的比值也显著高于对照组(P<0.05);CD8+IEL 的数量与对照组相比无显著差异。
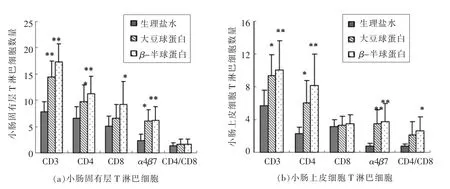
图2 各组小鼠小肠绒毛T 淋巴细胞计数Fig.2 Effect of soybean glycinin and β-conglycinin on the number of T lymphocyte in intestine
2.3 小鼠小肠绒毛上皮细胞凋亡观察及检测
高倍镜下观察显示灌胃大豆球蛋白和β-伴球蛋白组小鼠小肠出现连续性阳性染色,固有层中可见大量浆细胞及淋巴细胞等炎性细胞浸润,多见阳性染色的淋巴细胞。对照组中少见阳性染色,LP 中无明显炎性细胞浸润(如图3所示)。
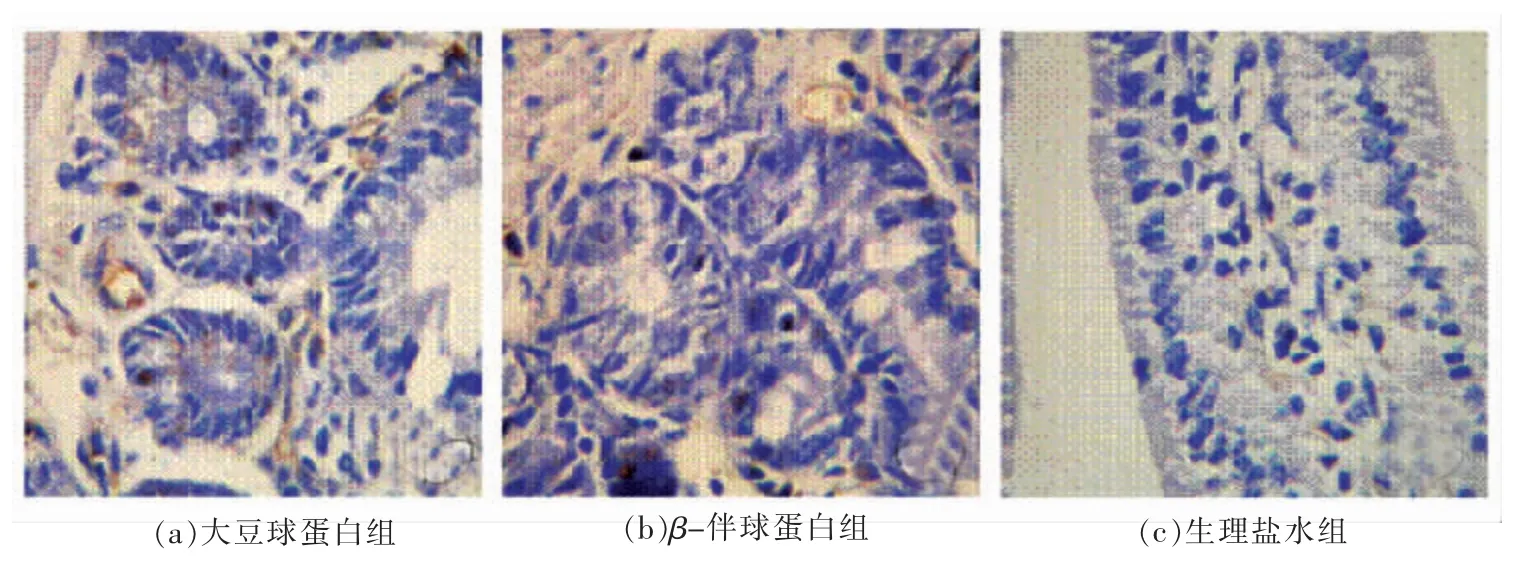
图3 各组小鼠小肠绒毛上皮细胞凋亡观察 (10×20 倍)Fig.3 Apoptotic cellular observation in murine intestinal epithelium of groups
图4表明,与对照组相比,灌胃大豆球蛋白和β-伴球蛋白组小鼠上皮细胞凋亡率显著增加(P<0.01)。
2.4 小鼠小肠固有层IgA+浆细胞检测
图5表明灌胃大豆球蛋白和β-伴球蛋白的小鼠小肠固有层IgA+浆细胞检测情况。由IgA 免疫组化图片可看出,致敏组小鼠小肠固有层IgA+浆细胞呈现明显的连续阳性染色,说明肠道的炎症较高。
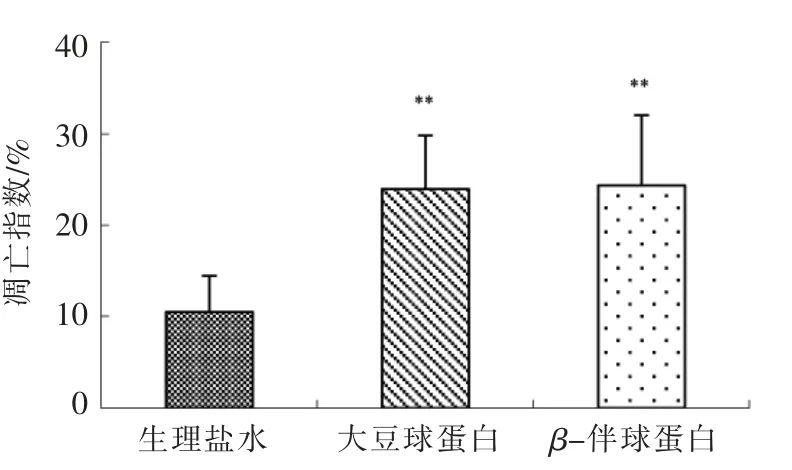
图4 各组小鼠小肠绒毛上皮细胞凋亡率检测Fig.4 Apoptotic ratio observation in murine intestinal epithelium of groups
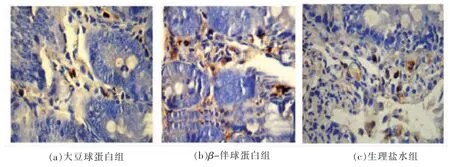
图5 小鼠小肠固有层IgA+浆细胞检测(10×20 倍)Fig.5 IgA+ plasmacyte count in the lamina propria (LP)of Balb/c mice
3 讨论
Peyer's 结是小肠内淋巴组织的集结区域,单个Peyer's 结包含有5 个以上的淋巴滤泡,在人体内主要集中在回肠末端[18]。滤泡具有中心区域,富含B 细胞,其外由混合细胞包围。滤泡间含有聚集的T 细胞,滤泡相关上皮覆盖着Peyer's 结,这有利于其接受肠腔内抗原的刺激。滤泡的圆顶区含有一系列II 型主要组织相容性复合物(Major histocompatability complex,MHC),这表明抗原呈递在这些部位发生。尽管本试验中致敏组的PP 结数量与对照组差异不显著,但有明显的增加趋势,说明大豆球蛋白刺激了小鼠的免疫反应。
在食物过敏过程中,肠道是变态反应发生的主要场所。肠道黏膜免疫是机体防御的第一防线,正常机体的胃肠道生理及免疫屏障能够避免大多数食物引起的可能有害的免疫反应[19-20]。肠道的上皮部分由上皮细胞和上皮内淋巴细胞(Intraepithelial lymphocytes,IEL)构成。肠腔内存在大量不同的抗原,固有层有许多作用强烈的免疫效应细胞,IEL 则位于肠腔与固有层之间这样一个特殊的位置。绝大多数IEL 带有全T 细胞的标志CD3[21]。固有层的淋巴组织是由一系列的细胞,包括T、B 淋巴细胞、浆细胞、巨噬细胞、主细胞和少量的中性粒细胞组成。固有层的T 细胞可能在肠黏膜非正常破裂时充当反应细胞和效应细胞的角色,这种作用有可能被T 细胞分泌的炎症介质(如细胞因子协同)。来源于人类和其他灵长类动物的固有层T 细胞均可合成IL-1α、IL-2β、IL-2、IL-4和IL-5 等细胞因子[22]。
本试验研究结果表明,灌胃大豆球蛋白组的小鼠小肠固有层和上皮间淋巴细胞CD3+、CD4+、CD8+淋巴数量以及CD4+/CD8+细胞比值均较正常组增高,提示食物过敏时小鼠小肠固有层存在大量淋巴细胞浸润,以CD4+T 细胞亚群为主。Dreau等[23]研究表明,在饲喂含大豆球蛋白和β-伴球蛋白豆粕的断奶仔猪肠黏膜上皮细胞和固有层里,CD4+和CD8+T 细胞数量均高于对照组。增加的CD3+、CD4+、CD8+T 细胞和血清里高水平的Ig 抗体表明大豆蛋白能够同时诱导细胞和体液免疫,其它一些文献也证明了这一点[24-25]。
CD4+和CD8+效应T 细胞的选择位点与CCR9和α4β7 的表达量有关[26]。整合素α4β7(α4β7 integrin)是与食物过敏密切相关的黏附分子[27]。本试验发现灌胃大豆球蛋白组的小鼠小肠固有层和肠道上皮组织间α4β7 的阳性细胞数量显著高于对照组,提示食物过敏时黏膜中免疫效应细胞大量浸润现象与肠道粘附系统功能异常亢进关系密切。食物过敏时小肠炎症部位的一系列炎症因子可上调粘附系统,加剧病理性T 细胞向固有层迁移,同时炎症导致的毛细管扩张,血流速度下降又可使得淋巴细胞暴露于毛细血管内皮细胞的时间延长,导致T 细胞表面的整合素得以与黏膜内皮粘附分子作用愈发充分[28]。
细胞凋亡是由基因调控的,不同于坏死的正常生理性细胞死亡形式,它对维持机体稳态方面起着重要作用。但细胞异常凋亡如凋亡增强或凋亡延迟将会对机体造成严重的病理损害。当致病菌感染机体时,由于内毒素、细胞因子以及其它炎性介质的过度释放,可以诱导不同细胞内凋亡相关基因过度表达,使这些细胞出现异常凋亡而损害细胞的功能[29]。肠道黏膜上皮细胞及肠道内淋巴细胞均是分化迅速的细胞,因此也是凋亡比较活跃的细胞。在某些病理情况下,一旦出现细胞死亡,就无法逆转。因此,不可避免地对机体造成严重损害。本试验肠道黏膜凋亡的原位观察中可见灌胃大豆球蛋白组的小鼠小肠上皮细胞出现多处细胞连续性阳性着色现象,提示食物过敏时小鼠小肠上皮细胞病理性凋亡亢进,上皮屏障功能受损。说明过敏反应严重时肠淋巴组织易于发生细胞凋亡,这可能是导致过敏后肠道免疫功能低下的重要原因。
IgA 是肠黏膜表面最重要的抗体,至少有80%的浆细胞位于肠黏膜固有层,分泌大量的IgA,远远多于其它类型的免疫球蛋白[30]。黏膜系统中sIgA 反应涉及B 细胞的一系列活动。smIgA+B细胞是IgA+浆细胞的前体,离开PP 诱导部位后,经淋巴管、淋巴结到达胸导管最后进入血液循环,在粘附分子系统(如MadCAM-1/α4β7)的引导下回到肠黏膜固有层。固有层smIgA+B 细胞在IL-4,IL-5,IL-6 等一系列细胞因子的作用下最终分化为IgA+浆细胞,进而向肠腔分泌sIgA 抗体,同时少量smIgA+B 细胞则储存在固有层中,成为IgA持续分泌的重要来源[31]。前期的试验已经证明灌胃β-伴球蛋白组的小鼠小肠黏膜sIgA 含量显著增加(0.17 μg/mL vs 0.37 μg/mL)(P<0.01)[11]。本试验结果证实致敏组小鼠肠道固有层中B 细胞向IgA+浆细胞的分化增加,肠黏膜中sIgA 分泌增加,即表明sIgA 反应的一系列体液免疫活动得以加强。这种sIgA 升高等高功能的抗体反应过程仍然可能与炎症状态下肠道黏膜“CD8α(-)DC-前体细胞-CD8α(-)DC-Th2-IL-4-B cell(Plasmacyte)-Ig”轴激活有关。
4 结论
大豆球蛋白和β-伴球蛋白过敏小鼠肠黏膜CD3+、CD4+和CD8+T 淋巴细胞的数量显著增加,肠上皮细胞α4β7 表达量的增加,表明过敏小鼠发生以肠黏膜CD4+T 细胞浸润为主的免疫炎症反应,肠黏膜上皮细胞凋亡亢进是造成肠道通透性加强进而破坏肠黏膜屏障功能的重要原因。同时致敏组固有层IgA+浆细胞的增加和肠黏膜中sIgA 含量的增加表明大豆球蛋白同时引发肠道sIgA 体液免疫反应。结果表明大豆球蛋白和β-伴球蛋白可以同时介导细胞免疫和体液免疫变态反应的发生。

