关于物质的量的教学探究
吴 睿,赵佐平,夏冬辉,宋 娟,郝 亮,刘 洋,吴迎春,刘存芳
(陕西理工大学 化学与环境科学学院 陕西省催化基础与应用重点实验室,陕西 汉中 723001)
什么是化学,化学有什么样的作用?化学是一门研究物质的组成、结构、性质、变化以及变化规律的科学[1]。它对我们认识和利用物质具有重要的作用,世界是由物质组成的,化学则是人类用以认识和改造物质世界的主要方法和手段之一,它是一门历史悠久而又富有活力的学科,它与人类进步和社会发展的关系非常密切,它的成就是社会文明的重要标志。从钻木取火的原始社会,到使用各种人造物质的现代社会,人类都在享用化学成果。人类的生活能够不断提高和改善,化学的贡献在其中起了重要的作用。
对于高一化学的学习,难在什么地方?很多学生认为化学这门学科太抽象了,太微观了。不像物理,物理中的电、力、光、热等这些物理量在日常生活中有的我们可以看到,或者可以比较容易地想象到。也就是说对于这些物理概念所对应的事物大部分是宏观的,可以用肉眼观察,而化学学科中,大部分概念属于微观的,不是那么容易观察和想象。
1 物质的量
1.1 物质的量的概念
我们从初三开始接触化学,刚开始,同学们看到老师做的化学实验,比如,镁在氧气中燃烧,发出耀眼的闪光;铁在氧气中燃烧火星四射。大家产生了强烈的好奇心。但渐渐地,学的化学反应越来越多,而且并不是所有的化学反应都有直观现象,而且还要涉及到抽象的计算。所以,有的同学渐渐地觉得化学内容太抽象了,太不容易捉摸了,从而渐渐失去了兴趣。
经过初三一年的化学学习,同学们进入了高中。初中我们接触到了一些宏观物理量,如质量(m),体积(v),浓度(w%)。进入高中后,为了把这些宏观物理量与微观离子联系起来,高一化学首先引入了新的感念:物质的量,其符号为 (n),单位摩尔(mole)。物质的量是国际单位制中7个基本物理量之一。7个国际单位分别是:长度(单位: m)、质量(单位: kg)、时间(单位: s)、电流强度(单位: A)、温度(单位: K)、物质的量(单位: mol),发光强度(单位: cd)。物质的量它和“长度”,“质量”,“时间”等概念一样,是一个物理量的代名词。随着新的概念引入,又增加了一系列的辅助概念,阿佛家得罗常数(NA),摩尔质量,气体的摩尔体积,物质的量浓度等。物质的量概念抽象,大家都感觉不好理解,但物质的量是化学计算的基础。物质的量是学生进入化学学习的第一步,因此,必须搞懂并学好。
1.2 物质的量的学习
简单地讲,物质的量就是用来描述分子等微粒个数的一种工具;数量少的东西可以一个个数,可以十个十个的数,但是化学微粒的个数是非常巨大的,我们无法一个个数,无法十个十个甚至无法万个万个的数;为了方便,采用摩尔(mol),它是物质的量的单位,正如重量的单位是千克,时间的单位是秒,长度的单位是米一样;摩尔是物质的量的单位。1 mol任何物质含有6.02×1023个微粒。就像我们说“一对”含有两个东西,“一打”含有9个东西一样,一摩尔物质含有6.02×1023个肉眼所看不见的微粒。
尽管这些微观单位非常抽象,不好理解,但通过宏观可以求出微观,通过微观也可以求出宏观。联系它们之间的桥梁就是物质的量。通过物质的量的计算我们可以求出宏观的物质的质量,溶液的物质的量浓度以及气体的体积。这时,我们就将宏观和微观物理量紧密地联系在了一起[2-4]。
对于微观的物质量的计算,物质的量是高中化学计算的核心,对于初学者来说,一方面概念多且比较抽象,难以理解,特别是相近概念容易混淆;另一方面对物质的量与其他物理量的关系模糊不清,进行有关物质的量的计算时不知从何处入手。其实,只要抓住物质的量这个桥梁作用,弄清楚各个字母所代表的单位,掌握好物质的量和其它量之间的相互关系,就不难理解了。物质的量的和其他单位之间的转换如图1所示。
从这幅框架图上我们可以看出:以物质的量求质量,只要乘以摩尔质量或者分子量;已知物质的量求总的粒子数,只要乘以阿佛家得罗常数;已知质量求物质的量浓度,只要除以溶液的体积;以物质的量求气体的体积,只要乘以气体摩尔体积;相反,已知其它量求物质的量是以上计算的逆运算。最后我们用气体的体积乘以密度还可以求出气体的质量。以物质的量为媒介可以辐射出以上五个关系式。这也是最简单的关系式,只有一步计算。实际上通过以上物质量关系网我们还可以推导出更多的关系式。
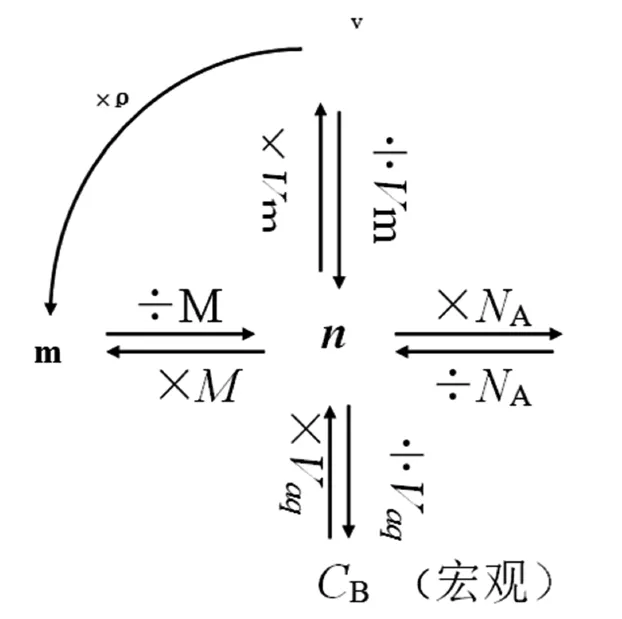
图1 各个单位之间的关系
微观粒子数与宏观质量之间的关系:
由n=N/NA=m/M →N= m/M×NA
微观粒子和宏观气体体积之间的关系:
n=N/NA=V/Vm→N= V/Vm×NA
微观粒子数与宏观溶液之间的关系:
n=N/NA=CB×V液→N= CB×V液×NA
CB=1000PW/M
可以推出:N=1000PW/M V液×NA
通过观察,这些物理量都是以物质的量为核心延伸的。可以归纳为一个概念和四关系。其中,物质的量起着桥梁的作用,若能把握他们的关系并能恰当运用,多做一些练习,学生就会发现这些问题实际上是比较简单的。
其实,如果我们学了后边的知识,最终会发现,对于微观的物质的量的学习还是比较简单容易的,因为它是客观的,不变的。但对于宏观的东西是随机变化的,就比如说,一个化学反应因为加的量不同或环境等不同反应产物就不同,也就是说要考虑可能影响反应的多种因素。这样在解题的时候就要具体问题具体分析。比如,高一学的钠和酸﹑碱﹑盐的反应。钠与酸反应,首先钠与酸反应,若钠过量还会和水反应;钠与碱反应实质是钠与碱溶液中的水反应;钠与盐反应,首先钠与水反应生成碱,生成的碱再与盐反应。以及后面讲的铝盐和强碱的反应,随着加入的强碱的量的不同会产生不同的结果。
AlCl3+3NaOH=3NaCl+Al(OH)3↓(NaOH少量)
Al(OH)3+NaOH=NaAlO2+2H2O (NaOH过量)
还有比如说碳酸氢钠和氢氧化钠的反应,碳酸氢钠的量不同,所生成产物也不同。
Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH [Ca(OH)2]过量
Ca(OH)2+2NaHCO3=Na2CO3+CaCO3↓+2H2O [NaHCO3]过量
物质的量概念形成之后,决不能让学生只仅仅满足死记硬背,一定要使学生通过计算,运用具体试题来掌握和巩固。在课后,老师要注意组织练习,有目的,有正对性的布置一部分有关物质的量的习题。使学生通过习题实践,巩固和增强学生应用概念的能力。使理论概念和计算相结合,使学与做相结合。
2 总结
通过以上简单的分析,最后不难发现,对于高一化学学习中的一些微观计算相对于化学中的宏观计算还是比较简单的。对于宏观化学的学习,所涉及的要点细节比较多,每一个小的细节都要仔细考虑。而关于微观量之间的计算比较固定,只要理清楚它们之间的关系,再熟记各个关系式并会进行简单的推导,这章学习中的困难就迎刃而解了。所以,对于刚进入高一的学生,特别是那些偏科的学生,或者因为物质的量没学好的学生,或者即将放弃化学学习的学生,进行一定的引导,他们就可能渐渐入门。掌握学习化学的一些方法,从而培养出对化学学习的浓厚兴趣,达到“山重水复疑无路,柳暗花明又一村”的境界。最终实现“会当凌绝顶,一览众山小”。

