扑草净、辛硫磷和亚甲基蓝制剂对凡纳滨对虾的急性毒性及组织病理改变
周桂娴,马荣荣,杨宗英,胡鲲,*
1. 上海海洋大学,国家水生动物病原库,上海 201306 2. 上海海洋大学,水产科学国家级实验教学示范中心,上海 201306 3. 农业部淡水水产种质资源重点实验室,上海 201306 4. 宁波大学,宁波 315000 5. 南昌市农业科学院,南昌 330038
扑草净是一种常见的三氯苯类除草剂,稳定性很强,易溶于有机溶剂,可用来去除阔叶草[1]。扑草净的半衰期较长,土壤中为12~18个月,地下水中达88 d,光照条件下河水中是263 d[2]。山东莱州湾近海水域中扑草净的残留浓度达到21.2 mg·L-1[3]。李如茵等[4]研究发现,近年来因具有清除水体中丝状藻类和水草的功能,扑草净也被频繁用于水产养殖中,导致水产品中的扑草净残留严重,极大影响了消费者的健康。
辛硫磷是一种常见的有机磷类杀虫剂,因具有高效、低毒等优点被用于农作物虫害防治。辛硫磷被胆碱酯酶代谢后抑制胆碱酯酶的活性,导致乙酰胆碱在突触内聚集,引起生物神经功能紊乱,从而引发中毒症状[5]。近些年来,辛硫磷不仅用于稻虾立体种养模式中农作物防虫,而且用于水产养殖中防治鱼类寄生虫病害[6]以及鱼类败血症[5]。辛硫磷对不同水产动物的安全浓度差异比较大,对虹鳟幼鱼的96 h安全浓度是0.407 μg·L-1,属于剧毒药物[7]。用辛硫磷杀虫风险高[8],因为它能够极大地影响罗非鱼的成活率。实验结果显示,辛硫磷对斑马鱼是一种高毒药物[5]。辛硫磷对凡纳滨对虾养殖的安全性没有相关的研究报道。
亚甲基蓝又名次甲基蓝,是一种噻嗪类的染料,近些年来作为孔雀石绿的替代品在水产养殖中经常使用,可以有效控制和治愈鱼类的疾病(如烂鳃病和烂皮病等)[9]。亚甲基蓝是潜在的高风险化合物,美国和日本等都不允许使用,尽管亚甲基蓝的毒性与孔雀石绿相比并不强,但仍然有可能对人类健康带来影响[10]。
凡纳滨对虾是我国普遍养殖的优良对虾品种之一,具有广盐度养殖、产量较高、养殖周期较短和肉质鲜美等优点。近年来随着对虾病害频繁发生、养殖水域环境的恶化、稻虾养殖模式的兴起,一些化学品如扑草净、辛硫磷和亚甲基蓝等在凡纳滨对虾养殖中被使用并后续在环境中被检出。虽然,这些化学品属于杀虫剂、消毒剂和除草剂,在水产养殖过程中也会被使用。在凡纳滨对虾养殖过程中,扑草净可以有效去除青苔及水草对养殖水体的影响,辛硫磷被用来防治对虾寄生虫,亚甲基蓝被用来治疗凡纳滨对虾的纤毛虫和黑鳃病,但扑草净、辛硫磷和亚甲基蓝对凡纳滨对虾的安全性方面却没有相关的研究报道。
本文以凡纳滨对虾幼虾为实验材料,得到了扑草净、辛硫磷和亚甲基蓝对凡纳滨对虾的48 h半数致死浓度(48 h-LC50)及安全浓度,并分析了随着时间延长3种药物对凡纳滨对虾的肝胰腺、肠道组织的影响,旨在探究3种药物对凡纳滨对虾的急性毒性,为3种药物在凡纳滨对虾养殖中合理使用和安全性评估提供参考。
1 材料与方法(Materials and methods)
1.1 实验材料
1.1.1 受试动物
实验所用凡纳滨对虾由上海农沧水产养殖公司提供,选择无病、规格均匀且活力较好的幼虾进行本次实验。平均体长(6.0±1) cm,平均体重(3.0+1) g,暂养后选取400尾进行实验。
1.1.2 实验方法
实验在室内进行,使用的水是由充分曝气无余氯残留的自来水和过滤消毒后的近海海水混合组成。将幼虾放入500 L塑料桶中暂养,用充气泵24 h连续打氧。将养殖水体水温稳定在(25±1) ℃,pH 8.5±0.5,溶解氧浓度>6.0 mg·L-1,盐度3‰。每日3次按照对虾总体重5%投喂配合饲料,暂养7 d。为防止水质污染,每日定时吸取桶底残饵粪便并换水10%,驯养期间死亡率不超过5%。实验前1 d停止投喂,对幼虾进行扑草净等3种化学品的急性毒性实验。急性毒性实验开始时,使用容积为20 L的塑料桶,实验水体为10 L,桶内放入连接打氧泵的气泡头以保证溶氧。为防止受试动物从桶中跳出,使用40目软尼龙网覆盖在桶面。在试验期间,每隔24 h换试验液一次。在用10% 48 h-LC50药物浓度处理对虾后,分别在0、2、4和6 d分离对虾肝胰腺及肠道做组织切片时,实验养殖容器为50 L的塑料桶,每桶50尾对虾。
1.1.3 供试试剂
扑草净:浙江中山化工集团股份有限公司生产,有效成分含量为40%的可湿性粉剂,产品标准号为GB23553—2009。辛硫磷:山东埃森化学有限公司生产,有效成分含量为40%的乳油制剂,产品标准号为GB9557—2008。亚甲基蓝:天津市北联精细化学品开发有限公司生产,有效成分含量为98.5%的标准品。饱和苦味酸:西陇化工股份有限公司,有效成分含量为99.8%。甲醛溶液:西陇化工股份有限公司,分析纯。乙酸:国药集团化学试剂有限公司,分析纯。
扑草净和辛硫磷采用了符合国标的农药商品制剂,扑草净商品制剂中60%其余成分主要是分散剂SD-8113、乙二醇、黄原胶和硅酸铝镁等助剂;辛硫磷商品制剂中60%的其他成分主要包含宁乳、乙二醇、黄原胶、有机硅消泡剂和水等,查阅相关文献,鲜有对凡纳滨对虾的毒性研究[11-12]。
1.1.4 仪器设备
NIKON Eclipse ci显微镜,NIKON digital sight DS-FI2成像系统,日本NIKON公司。
1.2 LC50的测定
正式实验之前先进行预实验,实验方法参考《水生生物毒性试验方法》[13],根据预实验的结果确定正式实验的药物浓度。正式实验药物浓度的确定依据预实验结果用对数等间距法在浓度范围中设置5~6个浓度梯度和自然状态下的空白对照组[14]。实验采用静水法,每种药物组设置1个空白对照组,每个实验浓度同时设置3个平行,每组10尾虾。实验期间定时观察虾体的存活状态、活力状态以及是否有中毒症状,及时捞出死亡的幼虾,统计并记录24 h和48 h的幼虾存活情况。将得到的实验数据用Excel 2016进行处理,得到药物浓度-死亡率的线性回归方程,来计算凡纳滨对虾幼虾暴露在药物中24 h和48 h的半致死浓度(24 h-LC50和48 h-LC50)以及相应的95%置信区间[15]。最后采用特伦堡(Turubell)公式计算实验药品的安全浓度(SC)[16],SC=48 h-LC50×0.3/(24 h-LC50/48 h-LC50)2。
1.3 组织切片的制作
在急性毒性实验结束后,找出各药物48 h-LC50,用10% 48 h-LC50药物浓度处理凡纳滨对虾并同时设置空白对照组。在0、2、4和6 d分离对虾肝胰腺和肠道,放入Bouin’s溶液固定24 h,随后放入浓度为75%的乙醇中保存。通过剖取组织,常规取材,脱水,包埋,制片,苏木精-伊红(HE)染色后,在光学显微镜下观察并描述,并拍摄对应主要描述中不同种类的病变部位。
2 结果(Results)
2.1 凡纳滨对虾的急性毒性
2.1.1 3种药物对凡纳滨对虾的急性毒性
扑草净、辛硫磷和亚甲基蓝对凡纳滨对虾的急性毒性结果如表1所示。实验期间,所有空白对照组均未发现死亡情况。凡纳滨对虾给药前期中毒症状主要是出现狂游、狂跳、不断碰撞箱壁的行为,随着中毒时间的增长对虾渐渐安静、运动能力减弱、出现侧卧或者直接死亡。观察死亡后的对虾状态,可以看出凡纳滨对虾在受到扑草净和亚甲基蓝的毒害死亡之后,虾体呈乳白色,头部发黑;辛硫磷中毒死亡的对虾,身体明显发红。凡纳滨对虾的死亡率与药物浓度和暴露时间呈正相关。相同药物浓度,暴露时间越长,凡纳滨对虾的死亡数量越高;在同一时间内,药物浓度越高则凡纳滨对虾死亡率也随着上升。随着实验时间的延长,低浓度药物组中的幼虾基本与空白对照组的幼虾状态一致,高浓度药物组中的幼虾在实验期间(48 h),3种供试药物的毒性随着药物浓度增大和实验时间延长呈现增强的趋势,有显著的剂量和时间效应。其中,扑草净、辛硫磷的研究结果只针对其商品化的制剂,不排除有联合毒性作用产生的可能。

表1 3种药物对凡纳滨对虾的急性毒性实验结果Table 1 The acute toxicity test results of three kinds of chemicals to Penaeus vannamei
2.1.2 3种药物对凡纳滨对虾的半致死浓度、安全浓度和回归方程
根据表1中急性毒性的实验结果,经过excel处理之后可以得到表2中回归方程、相关系数(r2)、半致死浓度(LC50)和安全浓度(SC)。扑草净对凡纳滨对虾的24 h-LC50和48 h-LC50为13.517 mg·L-1和5.050 mg·L-1,安全浓度为0.211 mg·L-1;辛硫磷对凡纳滨对虾的24 h-LC50和48 h-LC50为6.32 μg·L-1和1.03 μg·L-1,安全浓度为0.0083 μg·L-1;亚甲基蓝对凡纳滨对虾的24 h-LC50和48 h-LC50为5.769 mg·L-1和4.698 mg·L-1,安全浓度为0.935 mg·L-1。由表2可知,这3种药物对凡纳滨对虾的毒性为辛硫磷>亚甲基蓝>扑草净。
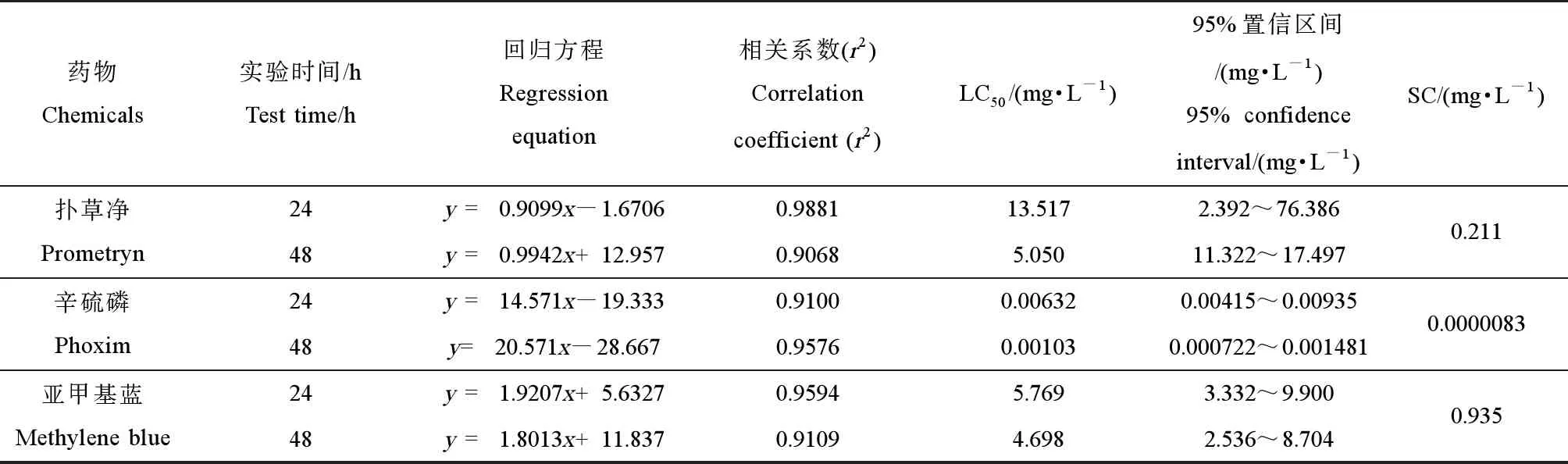
表2 3种药物对凡纳滨对虾的半致死浓度(LC50)和安全浓度(SC)Table 2 The values of median lethal concentration (LC50) and safe concentration (SC) of three kinds of chemicals to Penaeus vannamei
2.2 3种药物对虾组织病理学的影响
2.2.1 扑草净对凡纳滨对虾的组织病理学影响
2.2.1.1 肝胰腺组织病理变化
扑草净胁迫凡纳滨对虾0 d的肝胰腺组织结构如图1(a)所示,肝胰脏中肝管排列紧密,肝管壁由单层柱状细胞组成,主要为分泌细胞和吸收细胞,分泌细胞内可见大小不等的液泡,小管间隙有少量结缔组织及毛细血管,组织未见明显异常。扑草净处理0 d组(图1(a))和2 d组(图1(b))肝胰脏中肝管排列紧密,肝管壁由单层柱状细胞组成,主要为分泌细胞和吸收细胞,分泌细胞内可见大小不等的液泡,肝小管间隙有少量结缔组织及毛细血管。扑草净处理4 d组(图1(c)),肝小管排列紧密,但可以看到管壁细胞坏死,胞核固缩深染,少量小管结构破坏,管壁细胞缺失。扑草净处理6 d组(图1(d)),局部肝管排列疏松,间质增宽,间质内可见较多邻近组织脱落的细胞,可见部分炎性细胞浸润。
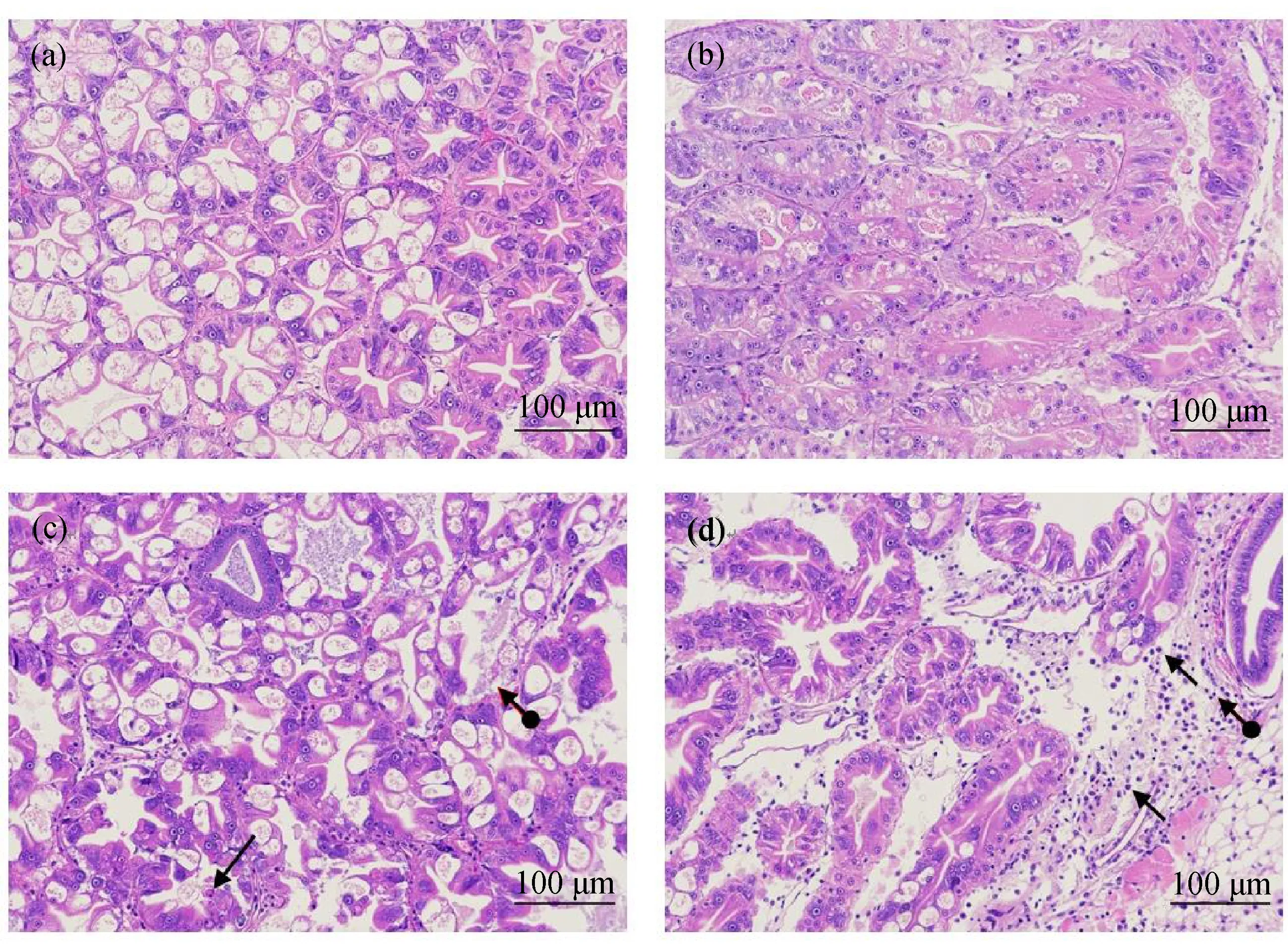
图1 扑草净胁迫对凡纳滨对虾的肝胰腺组织形态的影响注:(a)扑草净处理0 d组;(b)扑草净处理2 d组;(c)扑草净处理4 d组,管壁细胞坏死()或缺失();(d)扑草净处理6 d组,间质内可见较多邻近组织脱落的细胞()偶见炎性细胞浸润()。Fig. 1 Effect of prometryn stress on hepatopancreas morphology of Penaeus vannameiNote: (a) 0 d group of prometryn treatment; (b) 2 d group of prometryn treatment; (c) 4 d group of prometryn treatment, and the wall cells were necrotic () or absent (); (d) 6 d group of prometryn treatment, and more cells from adjacent tissues were observed in the interstitium () and occasionally inflammatory cell infiltration was observed ().
2.2.1.2 肠道组织病理变化
图2(a)所示,组织中黏膜层上皮细胞排列紧密,呈柱状,形态正常,上皮细胞内侧可见几丁质层,上皮外侧可见结缔组织层及肌层,组织整体未见明显异常。扑草净处理2 d组(图2(b))肠道组织的黏膜层上皮完整,上皮细胞排列紧密,肠腔内可见少量脱落的上皮样细胞,与0 d相比基本无异常;扑草净处理4 d组(图2(c)),黏膜层局部上皮缺失,肠腔内明显可见大量脱落的上皮细胞,较多上皮细胞肿胀,胞质疏松淡染;扑草净处理6 d组(图2(d)),黏膜层大量上皮细胞脱落入管腔,较多上皮细胞肿胀,胞质呈空泡状。
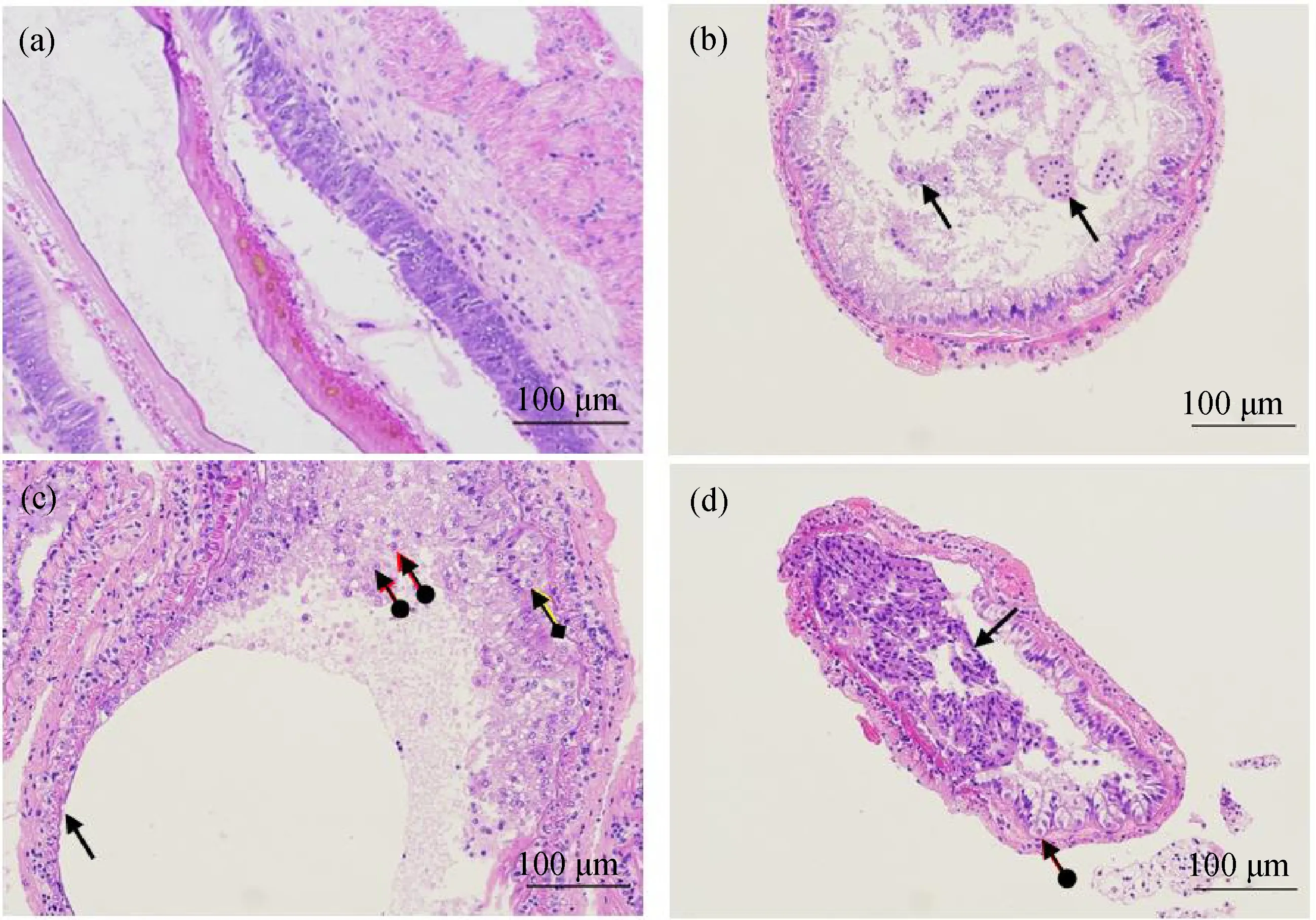
图2 扑草净胁迫对凡纳滨对虾的肠道组织形态的影响注:(a)扑草净处理0 d组;(b)扑草净处理2 d组,少量上皮细胞脱落();(c)扑草净处理4 d组,上皮缺失(),肠腔内有脱落的上皮细胞(),上皮细胞胞质疏松();(d)扑草净处理6 d组,上皮细胞大量脱落入管腔(),胞质呈空泡状()。Fig. 2 Effect of prometryn stress on gut morphology of Penaeus vannameiNote: (a) 0 d group of prometryn treatment; (b) 2 d group of prometryn treatment, a small number of epithelial cells were shed (); (c) 4 d group of prometryn treatment, epithelial deletion (), detached epithelial cells () in the lumen, and loose cytoplasm of epithelial cells (); (d) 6 d group of prometryn treatment, epithelial cells were shed into lumen (), and cytoplasm was vacuolized ().
2.2.2 辛硫磷对凡纳滨对虾的组织病理学变化
2.2.2.1 肝胰腺组织病理变化
辛硫磷胁迫凡纳滨对虾0 d的肝胰腺组织结构如图3(a)所示,肝胰腺中肝管排列紧密,肝管壁由单层柱状细胞组成,主要为分泌细胞和吸收细胞,分泌细胞内可见大小不等的液泡,小管间隙有少量结缔组织及毛细血管,组织未见明显异常。与辛硫磷处理0 d相比,2 d组(图3(b))肝管排列紧密,少量管壁细胞脱离基底膜,并可见管壁断裂,管壁细胞脱落。辛硫磷处理4 d组(图3(c)),肝管排列紧密,少量管壁细胞脱落入管腔,较多管壁上皮细胞脱离基底膜,部分管壁细胞肿胀,胞质疏松淡染。辛硫磷处理6 d组(图3(d)),局部肝管排列疏松,间质增宽,少量管壁上皮细胞脱离基底膜,少量管壁不完整,细胞缺失,少量管壁细胞脱落入管腔。
2.2.2.2 肠道组织病理变化
如图4(a)所示,组织中黏膜层上皮细胞排列紧密,呈柱状,形态正常,上皮细胞内侧可见几丁质层,上皮外侧可见结缔组织层及肌层,组织整体未见明显异常。与辛硫磷处理0 d相比,2 d组(图4(b))组织黏膜层少量上皮细胞脱落,上皮细胞肿胀,胞质呈空泡状;辛硫磷处理4 d组(图4(c)),组织局部黏膜上皮细胞缺失,肠腔内可见少量脱落的上皮细胞,上皮细胞肿胀,胞质空泡状。辛硫磷处理6 d组(图4(d)),肠组织大面积溶解,局部可见上皮细胞脱落。
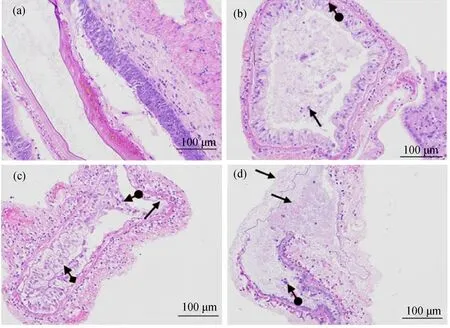
图4 辛硫磷胁迫对凡纳滨对虾的肠道组织形态的影响注:(a)辛硫磷处理0 d组;(b)辛硫磷处理2 d组,上皮细胞脱落()胞质呈空泡状();(c)辛硫磷处理4 d组,上皮细胞缺失(),肠腔内有脱落的上皮细胞(),胞质空泡状();(d)辛硫磷处理6 d组,肠组织大面积溶解(),局部可见上皮细胞脱落()。Fig. 4 Effect of phoxim stress on gut morphology of Penaeus vannameiNote: (a) 0 d group of phoxim treatment group; (b) 2 d group of phoxim treatment group, the epithelial cells were exfoliated () and the cytoplasm was vacuolar (); (c) 4 d group of phoxim treatment group, epithelial cells were absent (), epithelial cells were shed in the lumen (), and cytoplasmic vacuoles () were observed; (d) 6 d group of phoxim treatment group, large area of intestinal tissue was dissolved (), and epithelial cells were shed locally ().
2.2.3 亚甲基蓝对凡纳滨对虾的组织病理学变化
2.2.3.1 肝胰腺组织病理变化
亚甲基蓝胁迫凡纳滨对虾0 d的肝胰腺组织结构如图5(a)所示,肝胰腺中肝管排列紧密,肝管壁由单层柱状细胞组成,主要为分泌细胞和吸收细胞,分泌细胞内可见大小不等的液泡,小管间隙有少量结缔组织及毛细血管,组织未见明显异常。与亚甲基蓝处理0 d相比,2 d组(图5(b))少量肝管上皮变薄,管腔扩大,液泡破裂,偶见管壁断裂,少量管壁细胞脱落;亚甲基蓝处理4 d组(图5(c)),组织内肝管排列疏松,部分肝管结构破坏,不完整,细胞缺失,并可见管壁细胞脱离基底膜,少量管壁细胞坏死,胞核固缩深染或碎裂溶解;亚甲基蓝处理6 d组(图5(d)),小范围肝管排列疏松,间隙增宽,少量肝管结构不完整,管壁细胞缺失,并可见细胞脱落。
2.2.3.2 肠道组织病理变化
如图6(a)所示,组织中黏膜层上皮细胞排列紧密,呈柱状,形态正常,上皮细胞内侧可见几丁质层,上皮外侧可见结缔组织层及肌层,组织整体未见明显异常。与亚甲基蓝处理0 d相比,2 d组(图6(b))肠组织,黏膜层为单层柱状上皮,上皮向肠腔内突起形成皱襞,黏膜下结缔组织中可见较多毛细血管,结缔组织外为肌层,肠腔内可见少量脱落的细胞;亚甲基蓝处理4 d组(图6(c)),肠组织大面积溶解,大量上皮细胞消失,肠腔内可见少量脱落的上皮细胞;亚甲基蓝处理6 d组(图6(d)),黏膜层上皮完全丧失,肠腔内可见少量脱落的上皮细胞。
3 讨论(Discussion)
3.1 扑草净对凡纳滨对虾的急性毒性效应
扑草净对水生环境和生物都有一定的影响,不仅能够直接对水生生物产生毒性,还可以通过对水体中的藻类、水草类的清除作用间接影响水生动物生长。据有关报道,2019年上旬,为控制青苔爆发,多家渔药企业推出杀青苔的药物,杀青苔的同时导致人工种植的水草大面积死亡,养殖虾蟹大量死亡,这种除青苔的药物主要成分就是扑草净[17]。扑草净对鱼类也有很大影响,长期暴露在扑草净中的鲤鱼免疫指标超氧化物歧化酶(SOD)和谷胱甘肽还原酶(GR)的活性有一定变化[18]。扑草净对虹鳟鱼的急性毒性实验结果显示,96 h-LC50为2.9 mg·L-1[19],属于高毒药物。在本实验中得到扑草净对凡纳滨对虾的安全浓度为0.211 mg·L-1,是高度药物,需谨慎使用。在研究中,使用了扑草净的商品化制剂,其他成分没有相关毒性作用研究结果,不能排除联合毒性作用的可能。
根据实验结果,暴露在扑草净试液中的凡纳滨对虾的肝胰腺组织随着暴露时间的增长,损伤越来严重。在暴露4 d和6 d后肝胰腺出现了少量小管结构破坏、管壁细胞缺失等症状。扑草净对凡纳滨对虾肠道组织也有一定的影响,随着暴露时间的增长,肠道粘膜层的上皮细胞溶解量增多,胞质呈空泡状。在水产养殖过程中直接投入扑草净、稻虾养殖中用扑草净清除稻田中的杂草可能导致扑草净残留,这都可能对凡纳滨对虾健康产生影响。
3.2 辛硫磷对凡纳滨对虾的急性毒性效应
辛硫磷是目前广泛使用、高效和低毒的有机磷制剂,尽管有相关研究证明其对水生动物有一定的毒性,但水产养殖中常被用来防治寄生虫类[20]。辛硫磷对斑马鱼的毒性实验表明,扑草净对斑马鱼胚胎、幼鱼和成鱼的48 h-LC50是45.72(28.79~129.4)、1.27(0.94~1.89)和1.38(0.97~2.91) mg·L-1;96 h-LC50是26.48(18.33~45.53)、0.89(0.61~1.18)和1.01(0.77~1.45) mg·L-1,属于中高毒药物[21]。在实验中,辛硫磷对凡纳滨对虾的24 h-LC50和48 h-LC50为6.32 μg·L-1和1.03 μg·L-1,安全浓度为0.0083 μg·L-1,表明凡纳滨对虾对辛硫磷极为敏感。研究实验中,使用了辛硫磷乳油商品制剂,所以并不排除其他成分与辛硫磷产生联合毒性的可能。
观察经过一定浓度的辛硫磷处理后的凡纳滨对虾肝胰腺组织可知,凡纳滨对虾肝胰腺组织的损伤与辛硫磷浓度和暴露时间有紧密的关联,在暴露4 d和6 d后的肝胰腺组织有肝管排列疏松,间质增宽,少量管壁上皮细胞脱离基底膜,少量管壁不完整,细胞缺失,少量管壁细胞脱落入管腔等现象;肠道组织也出现了大面积溶解,局部可见上皮细胞脱落等不良现象。辛硫磷对鱼虾都有很强的毒性,且对虾的毒性要比鱼类更强,在水产养殖中应谨慎使用辛硫磷,以免造成不必要的损失。
3.3 亚甲基蓝对凡纳滨对虾的毒性效应
亚甲基蓝是一种抗菌药物,和孔雀石绿和结晶紫一样,可以用于治疗鱼类的腐皮病等[22],近年来也被用于治疗对虾纤毛虫病和黑鳃。但是由于亚甲基蓝可能会对人体健康产生危害,所以在美国和日本等国家已经被禁用,在中国还没有相关的明确规定。亚甲基蓝对鳑鲏鱼幼鱼的安全浓度为0.96 mg·L-1[23],属于高毒药物;亚甲基蓝对团头鲂的安全浓度是8.84 mg·L-1[24]。亚甲基蓝对凡纳滨对虾溞状幼体、糠虾和仔虾的安全浓度分别为0.025、0.029和0.073 mg·L-1[25],亚甲基蓝对凡纳滨对虾的安全浓度随着虾体成长而增大,本实验得到幼虾的安全浓度是0.935 mg·L-1。
随着暴露时间增长,凡纳滨对虾肝胰腺和肠道组织都出现了更严重的病变。在暴露4 d和6 d后可以看出肝胰腺组织的部分肝管结构破坏,细胞缺失,少量管壁细胞坏死,胞核固缩深染或碎裂溶解;在暴露6 d后,肠道组织黏膜层上皮完全丧失,肠腔内可见少量脱落的上皮细胞。亚甲基蓝对凡纳滨对虾的毒性机制尚未有相关的研究成果,但从组织切片结果来看,对肝胰腺组织和肠道都有一定的损伤,所以在养殖过程中还需谨慎使用。

