高湿度贮藏环境保持香梨表皮蜡质延缓衰老进程
江 英,王 月,毛惠娟,吕云皓,陈国刚
高湿度贮藏环境保持香梨表皮蜡质延缓衰老进程
江 英,王 月,毛惠娟,吕云皓,陈国刚
(石河子大学食品学院,石河子 832000)
为了探讨相对湿度对库尔勒香梨表皮蜡质的影响及与耐贮性的关系,该文设置3个不同相对湿度(25 ℃,40%~45%、60%~65%和80%~85%),研究不同湿度贮藏下香梨表皮蜡质含量和化学组分的变化及与贮藏品质的相关性。通过气相色谱-质谱联用技术(gas chromatography-mass spectrometer, GC-MS)对不同湿度贮藏香梨表皮蜡质的化学组分进行比较分析,同时测定好果率、失重率、表观色泽、硬度、可溶性固形物含量、可滴定酸含量、乙烯释放速率和呼吸强度等贮藏品质参数,最后对蜡质含量、化学组分及贮藏参数做相关性分析。结果表明:对照组(相对湿度40%~45%)和处理组的蜡质均由烷烃、烯烃、脂肪酸、醇类、醛类、酯类和萜类组成,但所含具体物质种类和含量略有差异。不同湿度贮藏条件对蜡质含量和各化学组分均有影响,与对照组相比,相对湿度80%~85%贮藏可显著保持蜡质含量、烷烃和醛类物质,延缓脂肪酸和醇类物质增加(<0.05)。蜡质化学组分及采后衰老之间存在密切相关性,各蜡质组分中,酯类和萜类物质对贮藏品质影响最大,其次是烷烃和醇类物质,其中:酯类物质与失重率、硬度和好果率极显著相关(<0.01);萜类物质与失重率和好果率极显著相关(<0.01);烷烃物质与失重率极显著相关(<0.01)。总体来看,在贮藏过程中,高湿度贮藏环境通过保持表皮蜡质含量和化学组分延缓香梨衰老进程,维持稳定的蜡质化学组成对采后香梨贮藏品质的保持具有正向作用。
贮藏;品质控制;库尔勒香梨;相对湿度;蜡质组分;相关性分析
0 引 言
库尔勒香梨(Red)是新疆的特色果品,因其优良的营养品质和卓越的贮藏性能,深受广大消费者的喜爱。目前香梨贮藏保鲜技术成熟,但耐贮性本质尚未得到深入的研究,相关学者推测其可能与香梨表皮蜡质的存在有关[1-3]。
植物表皮蜡质是一层覆盖于植物花、茎、叶以及果实最外层的疏水性脂质混合物[4],通常由超长链(very-long-chain, VLC)脂肪族化合物(如脂肪酸、烷烃、烯烃、醇、醛和酯)、环状化合物(如三萜类化合物)和其他微量次生代谢物(如类黄酮)等组成[5]。植物蜡质从结构上可分为两层,内蜡镶嵌于角质膜层内部,外蜡附着于角质膜层表面[6],特殊的生理结构和化学组成赋予其不同的功能,可为植物抵御生物或非生物胁迫[7]、降低紫外线辐射和机械损伤、维持植物表面清洁[8]、避免植物被病菌侵害[9]以及防止器官融合,尤其可减少植物组织内水分非气孔性散失[10]。Fernández等[11]对“Calrico”桃的研究发现,去除表皮蜡质的桃较未除蜡的桃失水率更高,贮藏效果更差;Nadakuduti等[12]研究发现,由于表皮蜡质生物合成的减少和较低比例的长链烷烃,突变体的番茄较野生型番茄果皮更具弹性且有光泽;Curry[13]对苹果的研究发现,采后苹果在冷藏期间出现表皮油腻化现象可能与表皮蜡质的化学组分有关,尤其是醇类物质。由此可知,植物表皮蜡质会随不同的贮藏条件(如温度)、发育阶段及品种存在差异,从而对果实采后贮藏品质起到调控作用。
相对湿度是影响采后果蔬品质的重要贮藏环境因素。相关学者对植物蜡质的研究表明,相对湿度可能会影响植物表皮蜡质含量、化学组成以及结构的变化,从而影响植物的品质。例如Baker[14]对布鲁塞尔芽菜()研究发现,相对湿度的降低会导致豆芽表皮蜡质的大量沉积,改变蜡质的结构。然而,目前鲜有对香梨贮藏湿度、表皮蜡质及果实贮藏品质相关性的研究。因此,本研究以库尔勒香梨为研究对象,测定其在相对湿度40%~45%、60%~65%和80%~85%贮藏条件下蜡质含量和化学组成的变化,结合贮藏品质参数进行相关性分析,探讨不同湿度条件下香梨表皮蜡质与贮藏品质的关系,揭示蜡质对果实贮藏保鲜的作用,为植物蜡质对果蔬贮藏保鲜作用原理补充新内容,也可为进一步利用蜡质和其特性开发高效果蔬涂膜保鲜剂提供新思路。
1 材料与方法
1.1 材料及处理
试验用库尔勒香梨于2018年9月采摘于新疆生产建设兵团第二师28团(41°45′N,86°8′E),采后选择果形整齐、成熟度相对一致、无机械损伤的商业成熟果实,经烤白纸包果、外套网袋、装箱后运至实验室。将库尔勒香梨果实随机分为3组,分别贮藏于常温不同相对湿度环境中,无其他预处理,每个处理试验量约90 kg。相对湿度设置参照库尔勒香梨贮藏最适湿度[15-16]并据实际情况调整,以贮藏环境自然湿度(25 ℃,相对湿度40%~45%)为对照(CK),设置2个不同梯度的湿度环境(25 ℃,相对湿度60%~65%和80%~85%)对香梨进行贮藏试验,湿度由加湿器加湿进行调控,试验期间由温湿度记录仪监测湿度变化。以15 d为1个周期,定期测定3组香梨果实表皮蜡质含量、化学组分变化及贮藏品质参数(好果率、失重率、表观色泽、硬度、可溶性固形物含量、可滴定酸含量、呼吸强度和乙烯释放速率)。
1.2 试剂与仪器
三氯甲烷、二氯甲烷、三氟化硼-甲醇溶液(体积分数为14%)、正庚烷(均为色谱纯),天津市光复精细化工研究所;二十四烷标准品(色谱纯),上海阿拉丁生化科技股份有限公司。
RE-3000旋转蒸发仪,上海科晓科学仪器有限公司;BZY-1精密电子天平,德国赛多利斯科技有限公司;WZS-1手持折光仪,上海仪田精密仪器有限公司;GX-4手持式硬度计,上海亚荣生化仪器厂;岛津GC-16A气相色谱仪,杭州格图科技有限公司;Trace-DSQ气相色谱-质谱联用仪,美国安捷伦公司;亚都SC-D052AE加湿器,北京亚都环保科技有限公司;德图testo 608H1数显温湿度记录仪,郑州良表仪器设备有限公司;美能达CM-700d色差仪,广州卓谐仪器设备有限公司。
1.3 香梨表皮蜡质测定
1.3.1 蜡质提取及含量测定
蜡质提取参考李珍慈等[17]的方法。库尔勒香梨果实用蒸馏水洗净,自然风干。提取溶剂为三氯甲烷和二氯甲烷体积比为2:1(165+82.5 mL)的混合溶剂,提取时间为75 s,提取温度为25 ℃,料液比为1:2.5 g/mL,在通风橱中浸泡香梨(=5)以提取蜡质,在提取后的溶液中加入100L(1g/L)二十四烷作为内标物进行定量分析,将含有内标物的溶液经旋转蒸发仪浓缩后用氮气流干燥,称量并记录,蜡质提取进行3次独立重复试验。蜡质含量计算方法如式(1)所示:

式中0为空烧杯质量,g;1为烧杯及提取蜡质质量,g;为香梨果实表面积,m2,表面积测定参考Clayton等[18]的方法。
1.3.2 蜡质化学组分测定
在进行气相色谱-质谱联用技术分析之前,需将蜡质样品进行甲酯化处理。准确称取50 mg蜡质样品和5 mL体积分数为14%三氟化硼-甲醇溶液于50 mL磨口三角瓶中,连接冷凝回流装置,70 ℃水浴回流5 min,使蜡质样品充分甲酯化,从冷凝器上端加入5 mL正庚烷继续回流1 min,取出三角瓶,待溶液冷却后,加入5 mL饱和氯化钠溶液(超纯水配制),静置分层,取上清液于盛有0.4 g无水硫酸钠(预先50 ℃烘干)的具塞比色管中,待用。
气相色谱条件:HP-5石英毛细柱(30 m×0.25 mm,0.25m);载气(He)流速1.1 mL/min,线速度40 cm/s;进样量:1.0L,不分流进样;进样口温度:250 ℃;检测室温度:300 ℃;升温程序:初始温度80 ℃,以4 ℃/min升至290 ℃,恒温30 min。质谱条件:电离方式为电子电离(electronicionization,EI)源;电子能量70 eV;传输线温度220 ℃;离子源温度230 ℃;激活电压1.5 V;质量扫描范围m/z 35~600。表皮蜡质中化学组分定性分析参考NIST 2013库,以二十四烷烃为内标物进行定量分析。
1.4 香梨采后贮藏品质参数测定方法
1.4.1 好果率测定
贮藏前,3组各随机选择40个香梨用于测定好果率,清晰标号,随后每隔15 d对标号香梨逐个检查,操作过程中需动作轻柔,避免造成机械损伤。以果实表面无腐烂、软褐现象为标准记为好果,好果率以好果数占总果数的百分率表示,至好果率低于70%终止试验。
1.4.2 失重率测定
香梨失重率采用差重法测定。贮藏前,3组各随机抽取30个香梨进行称量并清晰标号,随后每隔15 d进行一次称量。

1.4.3 色泽测定
贮藏前,3组各随机选择10个香梨用于测定色差,在香梨赤道部位等距3个位置进行清晰标记,用手持式色差仪(美能达CM-700d色差仪,广州卓谐仪器设备有限公司)测定标记部位果皮色差。
1.4.4 硬度测定
随机抽取3个香梨,在香梨赤道部位等距3个位置去除果皮(约1 mm厚),用手持式硬度计(GX-4手持式硬度计,上海亚荣生化仪器厂)测定香梨果肉硬度。
1.4.5 可溶性固形物含量测定
随机抽取3个香梨,在香梨赤道部位等距3个位置去除果皮,切下果肉,挤取果汁,用手持折光仪测定香梨可溶性固形物含量。
1.4.6 可滴定酸含量测定
香梨可滴定酸含量采用酸碱滴定法[19]测定。取果肉10.0 g,置于研钵中磨成匀浆,转移至100 mL容量瓶,定容后静置30 min提取过滤。以酚酞为指示剂,用已标定的氢氧化钠溶液滴定至溶液初显粉色并在30 s内不退色时为终点,记录氢氧化钠滴定液的用量1。以蒸馏水代替滤液进作空白滴定,记录空白试验消耗体积0。

式中为提取液总体积,mL;s为滴定时所取滤液体积,mL;为氢氧化钠溶液浓度,mol/L;为样品质量,g;0.067为折算系数,以苹果酸计。
1.4.7 呼吸强度测定
香梨呼吸强度测定采用静置法[20]。取1 kg香梨果实与20 mL 0.4 mol/L氢氧化钠溶液置于密闭干燥器中1 h,后加入5.0 mL饱和BaCl2溶液和2滴酚酞指示剂,以0.1 mol/L的草酸溶液滴定氢氧化钠溶液滴定至溶液变色,记录消耗草酸体积2,以同样方法作空白滴定,记录空白试验消耗体积3。
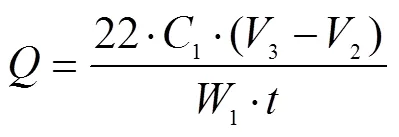
式中为呼吸强度,mg/(kg·h);1为草酸溶液浓度,mol/L;1为样品质量,kg;为静置时间,h;22为测定中NaOH与CO2的质量转换数。
1.4.8 乙烯释放速率测定
香梨乙烯释放速率测定参照曹建康等[20]的方法,条件设置略作修改。取10个香梨果实置于已知固定体积的密封罐中,密闭1 h后,顶空抽取100L气体,用气相色谱法测定果实乙烯释放量,以保留时间定性,以外标标准曲线峰面积定量。气相色谱条件:氢火焰离子化检测器(FID),GDX-502填充柱(2 mm×2 m),载气(N2)流速为60 mL/min;燃气(H2)流速为30 mL/min;空气流速为400 mL/min,不分流进样。进样温度120 ℃,柱温100 ℃,检测温度150 ℃。

1.5 数据处理
试验中指标测定均进行3次独立重复试验,数据以平均值±标准误差表示。使用IBM SPSS Statistics 24.0进行单因素方差分析,采用Duncan的多范围检验进行均值的比较分析,<0.05表示差异显著,<0.01表示差异极显著,采用Origin 2018进行统计和绘图。
2 结果与分析
2.1 不同相对湿度贮藏对香梨贮藏品质的影响
2.1.1 好果率和失重率的变化
好果率是评估贮藏效果和商品价值的重要指标,由于贮藏环境的差异,香梨在贮藏过程中发生不同程度的腐烂。贮藏至90 d时,对照组好果率为69.17%(图1a),腐烂果实已超总果数的30%,不再进行贮藏试验,相对湿度贮藏组好果率分别为75.83%(60%~65%)和80.83%(80%~85%),差异显著(<0.05)。失重率是影响果实品质状况的重要因素,由图1b可知,高湿度可有效延缓果实的质量损失,贮藏结束时,对照组果实失重率分别是相对湿度60%~65%和80%~85%贮藏果实的1.21倍和2.19倍,低环境湿度造成果实水分快速散失和糖、有机酸和风味物质等营养物质的消耗[21],导致果实出现干耗现象。

注:图中大写字母表示同一贮藏时间不同处理间的差异性,小写字母表示同一处理不同贮藏时间的差异性(P<0.05),下同。
2.1.2 色泽和硬度的变化
在CIE Lab表色系中,a值代表颜色红绿,+a表示偏红色,-a表示偏绿色。在贮藏过程中,香梨果实表皮颜色由鲜绿转红黄,a值逐渐增加。由图2a可知,贮藏结束时,3组a值分别增加5.50(40%~45%)、3.96(60%~65%)和3.33(80%~85%)。与对照组相比,80%~85%高湿度环境贮藏可显著延缓香梨果实a值的增加(<0.05),这是因为高湿度环境延缓香梨果实的后熟进程[16]。硬度是直接影响水果口感与质地的重要指标。香梨果实贮藏前硬度为74.77 N/cm2,贮藏结束时,对照、相对湿度60%~65%和相对湿度80%~85% 3组硬度分别为48.31、48.20和55.17 N/cm2(图2b),高湿度环境可减少细胞壁的呼吸速率和酶促降解速率[22],从而减轻果实软化程度,有效延缓果实硬度下降。

图2 不同湿度贮藏对香梨a*值和硬度的影响
2.1.3 可溶性固形物含量和可滴定酸含量的变化
可溶性固形物含量和可滴定酸含量是评估果实感官性状和营养品质的重要指标。如图3a所示,随着贮藏时间延长,香梨可溶性固形物含量呈先增后减趋势,贮藏结束时,80%~85%处理组香梨的可溶性固形物含量(10.99%)是对照组(10.10%)的1.10倍。贮藏前期,果实中大分子淀粉转化为小分子糖导致可溶性固形物含量增加,贮藏后期可溶性固形物含量的减少可能与呼吸代谢有关[23]。有机酸可作为果实呼吸的基质,为细胞的生化反应提供中间代谢产物,同时影响果实的风味与品质。3组香梨的可滴定酸含量从初始时持续降低,至贮藏结束时,对照组可滴定酸含量(0.051 4%)与80%~85%组(0.088 8%)间差异显著(<0.05)(图3b)。高湿度环境可延缓可溶性固形物含量和可滴定酸含量降低。

图3 不同湿度贮藏对香梨可溶性固形物含量和可滴定酸含量的影响
2.1.4 呼吸强度和乙烯释放速率的变化
香梨是典型的呼吸跃变型果实,在采收之后仍会进行代谢作用,因此呼吸强度和乙烯释放速率是研究果蔬采后贮藏保鲜效果的重要指标。由图4可知,与对照组相比,高湿度贮藏可使香梨CO2和乙烯释放量显著(<0.05)降低,延缓呼吸高峰和乙烯释放高峰的出现,其中相对湿度80%~85%作用更突出。果蔬的呼吸代谢与多种有机大分子物质的合成、分解代谢过程密切相关,为果蔬采后生命活动提供能量和必要的中间物质,同时呼吸作用会消耗果蔬体内积累的有机养分,降低果蔬食用品质和贮藏性。高湿度环境可有效降低果实呼吸速率,延缓果实衰老进程并延长贮藏期。
2.2 不同相对湿度贮藏对总蜡质含量和蜡质组分的影响
2.2.1 总蜡质含量的变化
香梨表皮蜡质经氯仿提取而得,蜡质含量变化如图5所示。研究结果表明,处理组和对照组香梨总蜡质含量均呈先升后降的趋势,这是由于香梨是典型的的呼吸跃变型果实,在采收之后仍会进行自身代谢,不断产生新的蜡质;然而在贮藏后期,香梨表皮蜡质逐步降解,出现油渍化现象,产生黏腻的触感。贮藏环境的不同导致3组香梨蜡质含量峰值到达的时间和含量均有差异,对照组香梨总蜡质含量在30 d达到峰值(10.826 7 g/m2),相对湿度60%~65%(11.782 2 g/m2)和80%~85%(12.738 2 g/m2)贮藏的香梨总蜡质含量在45 d达到峰值,这是由于40%~45%的低空气湿度刺激香梨产生蜡质来应对环境胁迫,结果与Bondada等[24]对棉花叶片的研究一致,当环境湿度降低或干旱胁迫时,棉花()叶片上的表皮蜡质会大量的积累。贮藏结束时,80%~85%高湿度处理香梨的总蜡质含量(6.380 3 g/m2)是对照组含量(5.094 3 g/m2)的1.25倍,差异显著(<0.05),表明不同湿度贮藏条件对总蜡质含量确有影响,高湿度环境能更好保持蜡质,对香梨贮藏起到有益作用。

图4 不同湿度贮藏对香梨呼吸强度和乙烯释放速率的影响
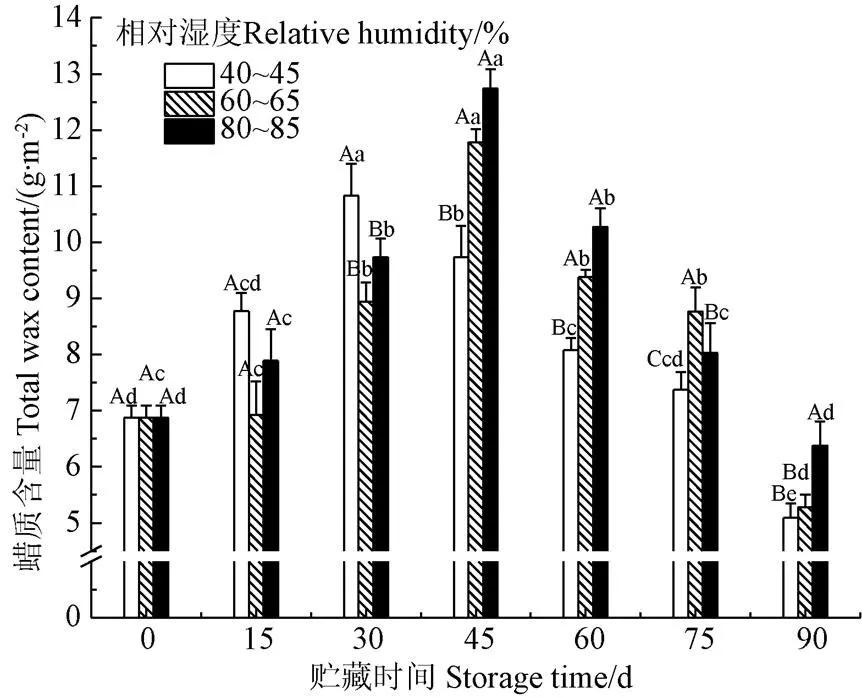
图5 不同湿度贮藏对香梨总蜡质含量的影响
2.2.2 蜡质组成及成分变化
蜡质组分由GC-MS分析测定,香梨蜡质组分含量变化如图6所示。研究结果表明,对照组和处理组的蜡质均由烷烃、烯烃、脂肪酸、醇类、醛类、酯类和萜类组成,但所含具体物质种类和含量略有差异。贮藏结束时,对照组中脂肪酸(1.274 6 g/m2,25.02%)含量最高,其次是醇类(1.037 7 g/m2,20.37%),而相对湿度80%~85%贮藏香梨表皮蜡质中烷烃(2.466 0 g/m2,38.65%)含量最高,其次是醛类物质(1.039 4 g/m2,16.29%)。此外,随着贮藏时间的延长,表皮蜡质物质种类大幅减少,对照组表皮蜡质物质种类由87种减少为52种(46种原物质,6种新物质),相对湿度60%~65%贮藏香梨表皮蜡质物质减少为59种(52种原物质,7种新物质),80%~85%贮藏香梨蜡质物质减少为63种(53种原物质,10种新物质)。由此可得,与对照组相比,湿度处理可更大程度保留蜡质的种类,其中80%~85%的高湿度效果最好。
烷烃在植物水分保持方面发挥重要作用,库尔勒香梨中主要是C14-C35的烷烃化合物(表1)。相比贮藏前,结束贮藏时3组烷烃相对含量均降低(图6),其中对照组(0.930 2 g/m2)下降最明显,仅为80%~85%贮藏条件(2.466 0 g/m2)的37.72%。二十九烷(C29)和三十一烷(C31)是其中最主要的烷烃,这与梨[25]、柠檬[26]、柑橘[27]、苹果[28]和番茄[29-31]的研究结果相似。烷烃含量可影响植物表皮蜡质渗透性及保水性,Nadakuduti等[12]研究番茄发现,与野生型番茄相比,突变体番茄由于长链烷烃含量较低,表皮渗透性更差;Rios等[32]研究发现C29正构烷烃的含量可能与甜樱桃的抗裂性有关。高湿度环境贮藏香梨果实失水率低可能是因为高湿度环境延缓烷烃物质的减少,减少水分的散失。蜡质中烯烃物质含量较低,与贮藏前相比,贮藏后香梨表皮蜡质中烯烃物质略有降低,分别由0.421 4 g/m2下降至0.255 7 g/m2(相对湿度40%~45%),0.113 6 g/m2(相对湿度60%~65%)和0.128 2 g/m2(相对湿度80%~85%),诱虫烯和豆甾-3,5-二烯是香梨表皮蜡质中较丰富的烯烃(表1)。

图6 不同湿度贮藏对香梨蜡质组分含量的影响
脂肪酸是表皮蜡质中种类最丰富的一类物质,也是对照组(1.2746 g/m2,25.02%)中占比最多的蜡质组分。随着贮藏时间的延长,脂肪酸含量逐渐增加,其中对照组脂肪酸含量最高,是60%~65%处理组(1.082 0 g/m2)和80%~85%处理组(0.994 7 g/m2)1.18和1.28倍,这是由于在贮藏过程中烷烃和酯类物质逐步水解,使游离脂肪酸增加。值得注意的是,贮藏结束时80%~85%贮藏条件下香梨表皮蜡质中9,12,15-十八碳三烯酸(亚麻酸)的含量为初始时的6倍,这与Isobel等[33]的研究结果一致。随着贮藏时间延长,香梨表皮蜡质中醛类物质逐渐降低,这可能是由于醛类物质被还原成伯醇[34]。较高的环境湿度可延缓醛类物质的变化,对照组和相对湿度60%~65%处理组含量最高的醛类物质是十二醛二甲缩醛,相对湿度80%~85%处理组含量最高的是十八醛。
醇类物质的浓度的差异可使水果表面呈现不同的光泽度和油腻感[35-36],产生不同的贮藏效果。贮藏结束后,对照组(1.037 7 g/m2)醇类物质含量上升最明显,同时表皮粘腻感最强,其次是相对湿度60%~65%(0.963 1 g/m2),最后是相对湿度80%~85%(0.955 1 g/m2),这表明湿度处理可在一定程度减缓香梨表皮的油腻化和衰老。邻苯二甲酸二辛酯是对照组中含量最高的酯类物质,处理组含量最高的酯类物质是单反油酸甘油酯。
除脂肪族化合物外,从库尔勒香梨中检测出-生育酚、-生育酚、-生育酚、-香树脂、羊毛甾醇、谷甾醇乙酸酯和羽扇豆醇乙酸酯等7种萜类化合物,-生育酚和羊毛甾醇是香梨表皮蜡质中含量较高的萜类物质。在贮藏过程中,萜类物质浓度逐渐增加,相对湿度80%~85%处理组(0.498 9 g/m2)萜类物质浓度较其他两组略微增加,但3组间无明显差异。

表1 不同湿度贮藏条件下香梨表皮蜡质主要组成物质含量
注:-表示未检出。各物质含量为占总蜡质的百分数。
Note: - indicates that it has not been detected. The content of each substance is the percentage of total wax.
2.3 相关性分析
对相对湿度40%~45%、60%~65%和80%~85%贮藏条件下香梨表皮蜡质含量、化学组分以及相关贮藏参数进行相关性分析(表2)。经对比分析发现,3组中烷烃物质的含量均与失重率呈显著的负相关关系(<0.01),这与Bourdenx[37]对拟南芥表皮蜡质中超长链烷烃的研究一致,烷烃与植物的失水率有密切关系。同样在辣椒研究中也发现,失水率与烷烃含量之间存在显著的负相关关系,这可能是因为简单的直链脂肪族成分比复杂的化合物更易形成不可渗透的蜡质层屏障[38]。此外,3组中酯类物质的含量均与失重率呈显著的负相关关系,与硬度和好果率呈显著的正相关关系(<0.01);3组中萜类物质含量与失重率呈正相关关系,与好果率呈显著负相关关系;烯烃类物质和醛类物质与各贮藏指标均无显著相关关系(>0.05)。总体来看,表皮蜡质各化学组分中,酯类物质和萜类物质对香梨贮藏品质影响最大,其次是烷烃物质和醇类物质。相关性分析表明在不同相对湿度贮藏条件中,除烯烃和醛类物质,其余蜡质化学组分的变化对香梨贮藏品质均有影响,尤其对失重率、硬度和好果率的影响最为显著。
研究发现不同湿度贮藏环境影响香梨表皮蜡质代谢,这表明表皮蜡质合成途径受环境湿度调控影响。不同的是,对照组脂肪酸含量与硬度呈显著负相关(<0.01),相关系数为−0.976;可溶性固形物含量和硬度与烷烃和酯类呈显著的正相关关系,与萜类物质呈显著负相关关系。对照组和相对湿度60%~65%贮藏香梨蜡质中的醇类物质均与失重率和a值呈正相关关系,与可滴定酸含量和好果率呈负相关关系(<0.01),酯类物质与可溶性固形物含量呈正相关关系;蜡质含量均与呼吸强度呈正相关关系,推测不同相对湿度贮藏环境可能通过影响香梨的呼吸模式进而对蜡质含量的变化产生影响。在相对湿度80%~85%贮藏组中,可滴定酸含量与酯类含量呈显著正相关关系,与萜类物质含量呈显著负相关关系,相关系数分别为0.909和−0.886。试验表明,不同梯度相对湿度贮藏环境使香梨表皮蜡质组分种类和含量产生差异,并对贮藏品质产生影响,其中高湿度贮藏环境中香梨蜡质含量和组分变化相对缓慢,香梨果实表皮的疏水性保持良好,进而影响各贮藏参数的变化,使香梨贮藏品质保持较好。
表皮蜡质是植物与外界接触的第一道屏障,对采后果实贮藏起着重要作用。蜡质的变化是一个动态过程,其成分和含量在果实贮藏过程中不断发生变化,对果实贮藏品质产生一定的影响。试验结果表明,不同湿度贮藏条件会造成蜡质含量的变化,并可能通过生理代谢改变香梨表皮蜡质的化学组分含量和种类,从而在一定程度上影响香梨果实的贮藏品质。

表2 不同湿度贮藏条件下香梨表皮蜡质与贮藏参数的相关性分析
注:* 在< 0.05,相关性显著;** 在<0.01,相关性显著。
Note: * Significant correlation at<0.05; ** Significant correlation at<0.01.
3 结 论
本试验研究了3个不同相对湿度(25 ℃,40%~45%、60%~65%和80%~85%)贮藏条件下库尔勒香梨表皮蜡质含量和化学组分的变化及与贮藏品质的相关性,得出以下结论:
1)蜡质中检测出的主要化学组分包括烷烃、烯烃、脂肪酸、醇类、醛类、酯类和萜类。与对照组(相对湿度40%~45%)相比,相对湿度80%~85%的高湿度环境能显著(<0.05)保持香梨表皮的蜡质含量(6.380 3 g/m2)、烷烃(2.466 0 g/m2)和醛类物质(1.039 4 g/m2),同时延缓脂肪酸(0.994 7 g/m2)和醇类物质(0.955 1 g/m2)含量的上升。与对照组相比,相对湿度80%~85%的高湿度环境可有效抑制失重率和*值的增加,延缓硬度、可溶性固形物含量、可滴定酸含量和好果率的降低,推迟乙烯释放高峰和呼吸跃变高峰出现。
2)香梨在不同湿度环境贮藏过程中伴随着蜡质含量和组分的变化,且蜡质化学组分及采后贮藏衰老之间存在密切相关性。各组分中,酯类物质和萜类物质对香梨贮藏品质影响最大,其次是烷烃物质和醇类物质。其中:酯类物质与失重率、硬度和好果率极显著相关(<0.01);萜类物质与失重率和好果率极显著相关(<0.01);烷烃物质与失重率极显著相关(<0.01)。
3)在贮藏过程中,高湿度贮藏环境通过更好保持蜡质含量和化学组分来延缓香梨成熟衰老进程,因此,维持稳定的蜡质化学组成对于采后香梨贮藏保鲜具有重要意义。
本研究仅考察不同相对湿度贮藏对室温贮藏期库尔勒香梨表皮蜡质变化的影响,香梨果实出库后货架期阶段蜡质的变化规律以及调控蜡质变化的措施还有待进一步探索。此外,蜡质含量与化学组成影响库尔勒香梨贮藏品质的分子机理尚不清楚,有待进一步研究。
[1]Lara I, Belge B, Goulao L. The fruit cuticle as a modulator of postharvest quality[J]. Postharvest Biology and Technology, 2014, 87: 103-112.
[3]Wu X, Yin H, Shi Z, et al. Chemical composition and crystal morphology of epicuticular wax in mature fruits of 35 pear () cultivars[J]. Frontiers in plant science, 2018, 9: 679-693.
[4]Li D, Cheng Y, Guan J. Effects of 1-methylcyclopropene on surface wax and related gene expression in cold-stored “Hongxiangsu'” pears[J]. Journal of The Science of Food And Agriculture, 2019, 99(5): 2438-2446.
[4]董晓庆,饶景萍,朱守亮,等. 气调包装与1-MCP结合抑制苹果蜡质成分降低[J]. 农业工程学报,2013,29(16):269-277.
Dong Xiaoqing, Rao Jingping, Zhu Shouliang, et al. Combination of modified atmosphere packaging and 1-methylcyclopropene treatment suppress decreasing of wax composition of apples during cold storage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 29(16): 269-277. (in Chinese with English abstract)
[5]Heng W, Huang H, Li F, et al. Comparative analysis of the structure, suberin and wax composition and key gene expression in the epidermis of “Dangshansuli” pear and its russet mutant[J]. Acta Physiologiae Plantarum, 2017, 39(7): 150-163.
[6]李灵之,马杰,向建华,等. 植物角质层内外蜡质的差异及其与抗逆性的关系[J]. 植物生理学报,2011,47(7):680-684.
Li Lingzhi, Ma Jie, Xiang Jianhua, et al. Composition differences of epicuticular and intracuticular wax layers and the relationship between cuticle and plant stress tolerance[J]. Plant Physiology Journal 2011, 47(7): 680-684. (in Chinese with English abstract)
[7]Eva D, Jesús C, Antonio H. An overview on plant cuticle biomechanics[J]. Plant Science, 2011, 181(2): 77-84.
[8]Trevor H, Jocelyn K. The formation and function of plant cuticles[J]. Physiologia Plantarum, 2013, 163(1): 5-20.
[9]Li F J, Min D D, Song B C, et al. Ethylene effects on apple fruit cuticular wax composition and content during cold storage[J]. Postharvest Biology and Technology, 2017, 134: 98-105.
[10]Yu H Y, Zhang Y S, Xie Y, et al. Ethephon improved drought tolerance in maize seedlings by modulating cuticular wax biosynthesis and membrane stability[J]. Journal of Plant Physiology, 2017, 214, 123-133.
[11]Fernández V, Khayet M, Montero P, et al. New insights into the properties of pubescent surfaces: Peach fruit as a model[J]. Plant Physiology, 2011, 156(4): 2098-2108.
[12]Nadakuduti S, Pollard M, Kosma D, et al. Pleiotropic phenotypes of the sticky peel mutant provide new insight into the role of cutin Deficient2 in epidermal cell function in tomato[J]. Plant Physiology, 2012, 159(3): 945-960.
[13]Curry E. Effects of 1-MCP applied postharvest on epicuticular wax of apples () during storage[J]. Journal of the Science of Food and Agriculture, 2008, 88(6): 996-1006.
[14]Baker Ea. The influence of environment on leaf wax development in brassica oleracea var. gemmifera[J]. New Phytologist, 1974, 73(5): 955-966.
[15]陈国刚,任雷厉,江英,等. 湿度对库尔勒香梨锈斑酶活性的影响研究[J]. 食品工业科技,2012,33(11):348-351.
Chen Guogang, Ren Leili, Jiang Ying, et al. Study on enzyme activity of Korla pear rust in different atmosphere humidity[J]. Food Industry Technology, 2012(11): 348-351. (in Chinese with English abstract)
[16]邓冰,韩云云,韩艳文,等. 库尔勒香梨缓慢降温后适宜温湿度条件的研究[J]. 包装工程,2016,37(7):45-50.
Deng Bing, Han Yunyun, Han Yanwen, et al. Optimal temperature and humidity conditions of korla fragrant pear under slow cooling[J]. Packaging Engineering. 2016, 37(7): 45-50. (in Chinese with English abstract)
[17]李珍慈,江英,秦婕,等. 库尔勒香梨表皮蜡质提取条件研究及成分分析[J]. 中国酿造,2016,35(4):158-162.
Li Zhenci, Jiang Ying, Qin Jie, et al. Extraction conditions and component analysis of epicuticular wax of Korla fragrant pears[J]. China Brewing, 2016, 35(4): 158-162. (in Chinese with English abstract)
[18]Clayton M, Amos N D, Banks N H, et al. Estimation of apple fruit surface area[J]. New Zealand Journal of Crop and Horticultural Science, 1995, 23(3): 45-349.
[19]Premakumari S. Official methods of analysis of the association of official analytical chemists[J]. The Indian Journal of Nutrition and Dietetics, 1989, 26(10): 312.
[20]曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2007.
[21]宿胜男. 不同贮藏条件下香梨蜡质结构和成分的变化与其耐贮性关系的研究[D]. 石河子:石河子大学,2018.
Su Shengnan. Study on the Relationship Between the Changes of Waxy Structures and Components and Their Storability of Korla Fragrant Pear Under Different Storage Conditions[D]. Shihezi: Shihezi University, 2018. (in Chinese with English abstract)
[22]Wei J M, Qi X D, Guan J F, et al. Effect of cold storage and 1-MCP treatment on postharvest changes of fruit qualityand cell wall metabolism in sweet cherry[J]. Journal of Food, Agriculture & Environment, 2011, 9(3): 118-122.
[23]Petriccione M, De S F, Pasquariello M S, et al. The effect of chitosan coating on the quality and nutraceutical traits of sweet cherry during postharvest life[J]. Food and Bioprocess Technology, 2015, 8(2): 394-408.
[24]Bondada B R, Osterhuis D M, Murphy J B, et al. Effect of water stress on the epicuticular wax composition and ultrastructure of cotton () leaf, bract, and boll[J]. Environmental and Experimental Botany, 1996, 36(1): 61-69.
[25]Yin Y, Bi Y, Chen S J, et al. Chemical composition and antifungal activity of cuticular wax isolated from Asian pear fruit[J]. Scientia Horticulturae, 2011, 129(4): 577-582.
[26]Edward A B, John P, Grace M. Hunt the cuticles of citrus species composition of leaf and fruit waxes[J]. Journal of the Science of Food and Agriculture, 1975, 26(8): 1093-1101.
[27]Cajuste J F, Gonzcllez C L, Veyrat A, et al. Epicuticular wax content and morphology as related to ethylene and storage performance of “Navelate” orange fruit[J]. Postharvest Biology and Technology, 2010, 55(1): 29-35.
[28]Li F J, Min D D, Ren C T, et al. Ethylene altered fruit cuticular wax, the expression of cuticular wax synthesis-related genes and fruit quality during cold storage of apple fruit[J]. Postharvest Biology and Technology, 2019, 149: 58-65.
[29]Yeats T H, Buda G J, Wang Z H, et al. The fruit cuticles of wild tomato species exhibit architectural and chemical diversity, providing a new model for studying the evolution of cuticle function[J]. Plant Journal, 2012, 69(4): 655-666.
[30]Kosma D K, Parsons E P, Isaacson T, et al. Fruit cuticle lipid composition during development in tomato ripening mutants[J]. Physiologia Plantarum, 2010, 139(1): 107-117.
[31]Halinski L P, Kalkowska M, Kalkowski M, et al. Cuticular wax variation in the tomato () related wild species and their interspecific hybrids[J]. Biochemical Systematics and Ecology. 2015, 60: 215-224.
[32]Rios J C, Robledo F, Schreiber L, et al. Association between the concentration of n-alkanes and tolerance to cracking in commercial varieties of sweet cherry fruits[J]. Scientia Horticulturae, 2015, 197: 57-65.
[33]Isobel M, Francis B. Composition of the surface waxes of apple fruits and changes during storage[J]. Journal of the Science of Food and Agriculture, 1973, 24(11): 1331-1339.
[34]Kolattukudy P E, Liu T Y. Direct evidence for biosynthetic relationships among hydrocarbons, secondary alcohols and ketones in Brassica oleracea[J]. Biochemical and Biophysical Research Communications, 1970, 41(6): 1369-1374.
[35]Veraverbeke E A, Lammertyn J, Saevels S, et al. Changes in chemical wax composition of three different apple (.) cultivars during storage[J]. Postharvest Biology and Technology, 2001, 23(3): 197-208.
[36]Dong X Q, Rao J P, Huber D J, et al. Wax composition of “Red Fuji” apple fruit during development and during storage after 1-methylcyclopropene treatment[J]. Horticulture, Environment and Biotechnology, 2012, 53(4): 288-297.
[37]Bourdenx B, Bernard A, Domergue F, et al. Overexpression of Arabidopsis eceriferum1 promotes wax very-long-chain alkane biosynthesis and influences plant response to biotic and abiotic stresses[J]. Plant Physiology, 2011, 156(1): 29-45.
[38]Eugene P, Parsons, Gregory T, et al. Fruit cuticle lipid composition and fruit post-harvest water loss in an advanced backcross generation of pepper[J]. Physiologia Plantarum, 2012, 146(1): 15-25.
Delaying the aging process of pears by maintaining cuticular waxes under high humidity storage conditions
Jiang Ying, Wang Yue, Mao Huijuan, Lü Yunhao, Chen Guogang
(832000)
Cuticular wax is an important factor that affects storage quality and commercial value of fruits and vegetables after postharvest. Previous studies have shown that cuticular wax of pears undergoes significant changes during storage. However, there are few studies on the effects of different humidity environments storage on the wax changes and the correlation with storage quality. In this paper, the total wax content, chemical composition and the relationship between the wax and storage quality of Korla pear stored at different relative humidity (40% - 45%, 60% - 65%, 80% - 85%) were determined. After extracting cuticular wax by chloroform extraction, chemical compositions were determined by gas chromatography-mass spectrometry (GC-MS). Eight quality parameters (e.g. qualified fruits percentage, weight loss, apparent colour, hardness, soluble solids content, titratable acidity content, ethylene evolution rate and respiratory intensity) were measured and correlation analysis were performed between total wax content, chemical compositions and storage parameters. The results showed that the compositions of fruit wax under different humidity environments were quite similar, mainly including alkanes, olefins, fatty acids, aldehydes, alcohols and esters. Nevertheless, the amount and type of each composition varied. The substances of the primary components with higher contents were nonacosane, hentriacontane, (9Z)-9-tricosene, palmitic acid, oleic acid, docosanol, 1,1-dimethoxydodecane and lanosterin. At the end of storage, the highest cuticular wax content was observed in 80%-85% relative humidity storage and the lowest in 40%-45% relative humidity storage. Compared with the control, high humidity environment delayed the aging process of pear, reduced the decrease of weight loss, hardness, soluble solids content, titratable acid content, and qualified fruits percentage, postponed the peak of respiratory and ethylene release, the 80%-85% treatment was remarkable. Different humidity environment had certain influence on wax content and chemical composition of postharvest pear. The relative humidity of 80%-85% could better maintain the total wax content, alkane and aldehydes, and delay the increase rate of fatty acids and alcohols. Among the components, esters and terpenoids have the greatest influence on storage parameters, followed by alkanes and alcohols. The results showed that the chemical composition of cuticular wax were changed under different humidity environments during storage, at the same time, there was significant correlation(<0.01) between total wax content, chemical composition and postharvest senescence. In summary, most of the aging process were delayed due to the total wax content and chemical composition were maintained in high humidity environment, manifesting that stable chemical composition of cuticular wax play an important role in keeping good quality of postharvest pear. Overall, to understand the changes of cuticular wax in different humidity environment could provide sufficient information for further study on the effect of cuticular wax on postharvest storage performance. In this paper, the effect of storage in different humidity on the cuticular wax of Korla pear was studied. The change of cuticular wax during shelf life period of pear fruits after storage and control measures to regulate cuticular wax compositions need to be further explored. In addition, the molecular mechanism between cuticular wax chemical compositions and storage quality of Korla pear is not clear, which needs further study.
storage; quality control; Korla pear; relative humidity; wax compositions; correlation analysis
江 英,王 月,毛惠娟,吕云皓,陈国刚. 高湿度贮藏环境保持香梨表皮蜡质延缓衰老进程[J]. 农业工程学报,2020,36(3):287-295.doi:10.11975/j.issn.1002-6819.2020.03.035 http://www.tcsae.org
Jiang Ying, Wang Yue, Mao Huijuan, Lü Yunhao, Chen Guogang. Delaying the aging process of pears by maintaining cuticular waxes under high humidity storage conditions[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(3): 287-295. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.03.035 http://www.tcsae.org
2019-10-22
2020-01-30
国家自然科学基金资助项目(31560470);国家自然科学基金资助项目(31560468)
江 英,博士,教授,主要从事果蔬贮藏与加工研究。Email:715jy@sohu.com
10.11975/j.issn.1002-6819.2020.03.035
TS255.3
A
1002-6819(2020)-03-0287-09

