细粒棘球蚴感染小鼠肝脏模型的构建
王二强,刘坪,徐小丹,孟娟娟,王仙,侯隽,吴向未,陈雪玲*
(1 石河子大学医学院,新疆 石河子 832002;2 石河子大学医学院第一附属医院肝胆外科,新疆 石河子 832008)
棘球蚴病(echinococcosis)是由棘球绦虫的幼虫寄生于宿主体内引起的人兽共患疾病[1],又称包虫病。细粒棘球蚴病其特征是囊性病变,最常见于肝脏,约占病例的50%~70%[2]。许多研究者通过对受感染的人和动物的研究,初步建立了继发感染动物模型[3]。继发性感染主要包括腹腔、皮下以及肝脏穿刺注射原头蚴等多种途径,大部分动物模型集中在腹腔注射头节造模[4-8]。细粒棘球蚴感染约70%寄居在肝脏,所以从腹腔感染再迁移到肝脏,对细粒棘球蚴感染的研究具有一定的局限性。本研究旨在通过肝被膜下注射细粒棘球蚴头节,形成细粒棘球蚴感染小鼠肝脏模型,更好的研究包虫病,为进一步研究提供实验基础。
1 材料与方法
1.1 耗材与仪器
主要试剂耗材:1 mL/50 mL注射器购自KDL/康德莱。伊红和HE染色试剂盒索莱宝,天狼猩红染色染色液来自上海舜田生物科技有限公司,胎牛血清来自gibico,1640培养基,PBS来自生工,青链霉素混合液和中性树胶来自索莱宝,水合氯醛(目录号:C804539)来自Macklin公司,1.5 mLEP管和吸头来自中国biosharp公司,100 mm培养皿和75 mm培养瓶来自美国康宁公司。手术缝合针来自Polyamide(3/8,3*10),无水乙醇、95%乙醇和二甲苯来自天津富宇精细化工有限公司。
主要仪器:德国徕卡全自动轮转式切片机(Leica RM2265),蔡司生物显微镜(Axio Imager 2),自动组织脱水机(Leica PELORIS II),移液器来自德国eppendorf公司,CO2的培养箱购自美国赛默飞公司(Heracell 240i)。
1.2 原头蚴的提取以及体外培养
从新疆昌吉屠宰场购买有肝包虫囊肿的羊肝脏,流水冲洗3~5遍,然后在肝脏表面喷洒75%乙醇消毒。消毒后的的羊肝,用50 mL注射器提取囊泡中含头节的囊液,然后移到高压好的玻璃瓶。将装有提取好的头节和囊液的混合物的瓶子经75%酒精消毒后,移到无菌操作台,弃去上清液,留下底层白色头节沉淀层,然后倒入PBS,摇晃瓶子混匀,待大部分头节沉淀后,弃去上清液,重复30次左右后,用加样枪吸取头节,移入100 mm培养皿。加入10 mL左右的PBS,用移液器吹打混匀,然后弃去上清液,如果看到囊皮,用移液器吸住,然后弃入废液缸,重复洗涤10次以上,直至沉淀后的上清液呈无色透明。然后培养皿留5 mL左右的液体,倾斜培养皿30°左右,待虫子在中间形成1条白色沉淀带,静止10 s后,轻微摇晃,用移液器吸走沉淀带上层容易上下漂浮的大颗粒(状态不佳或者已死亡的虫子),重复10次左右,直至大部分头节容易沉淀且颜色纯白色(若颜色发黄,则提示没有洗好,需要重新洗)。多次洗头节主要是为了减少污染的风险以及提高头节的活性保证接种的成功率。将购买的成品1640培养基,然后按照8%胎牛血清,1%双抗配置成完全培养基,洗好的头节用移液器移入75 mm的培养瓶中,加入完全培养基,充分混匀,在37 ℃和5%CO2的培养箱中连续培养。
1.3 头节活性的测定
用移液器混匀含细粒棘球蚴头节的培养基,吸取50 μL至玻片上,加入5 μL伊红,混匀,静止10 s,在显微镜的低倍镜下计数,全部深染红色的头节为死亡的头节,计数3个视野下虫子的测算其存活率。
1.4 手术的准备
6~8周龄雌性C57小鼠,体重18~22 g,购买自新疆医科大学动物实验中心,本实验已通过石河子大学第一附属医院实验动物伦理审查。
将含有头节的培养基用加样枪吹打混匀,吸出50 μL混合物滴加在玻片上,然后加入5 μL伊红染液,均匀涂抹在玻片上,计数虫子数目及活性≥90%的头节,然后分别吸取3 000个头节,5 000个头节,PBS放置于不同的1.5 mL的EP管中。
手术器械的准备:取0号(规格为3/8,3*10)手术缝合针,穿入缝合线(规格为5-0,线长30 cm),打1个小结,然后放入75%乙醇溶液中,准备好碘伏,棉棒,经过高压灭菌处理的手术器械(包括眼科钳,眼科镊,2个持针器,钝性分离器)以及手术操作台(手术操作前,用75%乙醇溶液擦拭,并用紫外灯照射30 min),麻醉药的量每只老鼠按照体重乘以0.01 mL的5%水合氯醛,腹腔注射。
1.5 实验步骤
从动物实验中心取回小鼠,右手抓住鼠尾提起,置于鼠笼或实验台上,用左手的拇指、食指和中指抓住小鼠两耳后项背部皮毛,以无名指及小指夹住鼠尾,左手操作注射器,腹腔注射0.2 mL左右的5%水合氯醛。已麻醉好的小鼠固定在手术操作台上,腹中线附近的皮肤依次经过碘伏和酒精消毒。用眼科镊夹起表层皮肤,眼科剪剪出小口,插入钝性分离器,分离表层皮肤和内层皮肤,用眼科剪沿腹中线,依次剪开表层皮肤和内层皮肤。用干棉签拨动肝左叶,彻底暴露肝左叶,然后拿着带有虫子的1 mL注射器,倒置然后待头节沉积于针头附近,平放在操作台上。左手手持棉签抵住肝左叶使其形成一个平面,右手手持注射器针头平肝被膜穿刺然后沿着被膜深入约0.5 cm,推动注射器活塞,肝脏被膜白色凸起,棉签压住进针处,拔针,棉签继续按压10 s。使用持针器单纯连续缝合内层皮肤和外层皮肤,最后用棉签擦除血渍,待其苏醒。
1.6 HE染色
苏木素染液为碱性染料,主要使细胞核和核糖体染色成紫蓝色,伊红为酸性染料,主要使细胞质和细胞外基质中的成分着红色,伊红染色液中加入0.2%的冰醋酸。4%多聚甲醛固定24 h后的肝脏组织,石蜡包埋,然后切片4 μm,经过二甲苯脱蜡,梯度酒精脱水之后,苏木素和伊红染色,脱水,透明,封片显微镜观察。
1.7 天狼星红染色
4 μm厚的石蜡切片,经过二甲苯脱蜡,梯度酒精脱水之后,天狼星红饱和苦味酸染色1 h,然后苏木素染色,脱水,透明,封片,显微镜拍照系统采样。
2 结果
2.1 细粒棘球蚴头节活性的测定
在光学显微镜下观察细粒棘球蚴头节,细粒棘球蚴头节未被伊红染色为活性较好的头节(图1A),而有些虫子吸盘部分被红染是活性较好的头节(图1B),而着色为深红色的头节是已经凋亡的头节(图1B、图1C)。

图1 3个不同视野下细粒棘球蚴头节伊红染色(40×)
2.2 细粒棘球蚴头节感染肝脏的形态学观察
肝脏的形态学,细粒棘球蚴头节感染小鼠肝脏30 d时,3 000头节组有乳白色囊泡形成且稍有凸起,而5000头节组乳白色囊泡凸起并向周围扩散。感染后60 d,3 000头节组,小白泡在扩大且凸起,而5 000头节组囊泡进一步扩大和凸起,并且在周围可以看到有透光性增加的囊泡形成。感染后90 d,3 000头节组和5 000头节组的囊泡大部分趋于透明,并且5 000头节组比3 000头节组囊泡更多。感染后120 d和150 d,囊泡的数量增多同时体积也增大,5 000头节组比3 000头节组更明显(图2)。这些反应了细粒棘球蚴感染的严重程度跟注射的头节数量有关,并且随着时间的延长,感染的病灶向周围扩散,呈迁延、进展性疾病,为后续疾病不同的发展的阶段提供了研究基础。
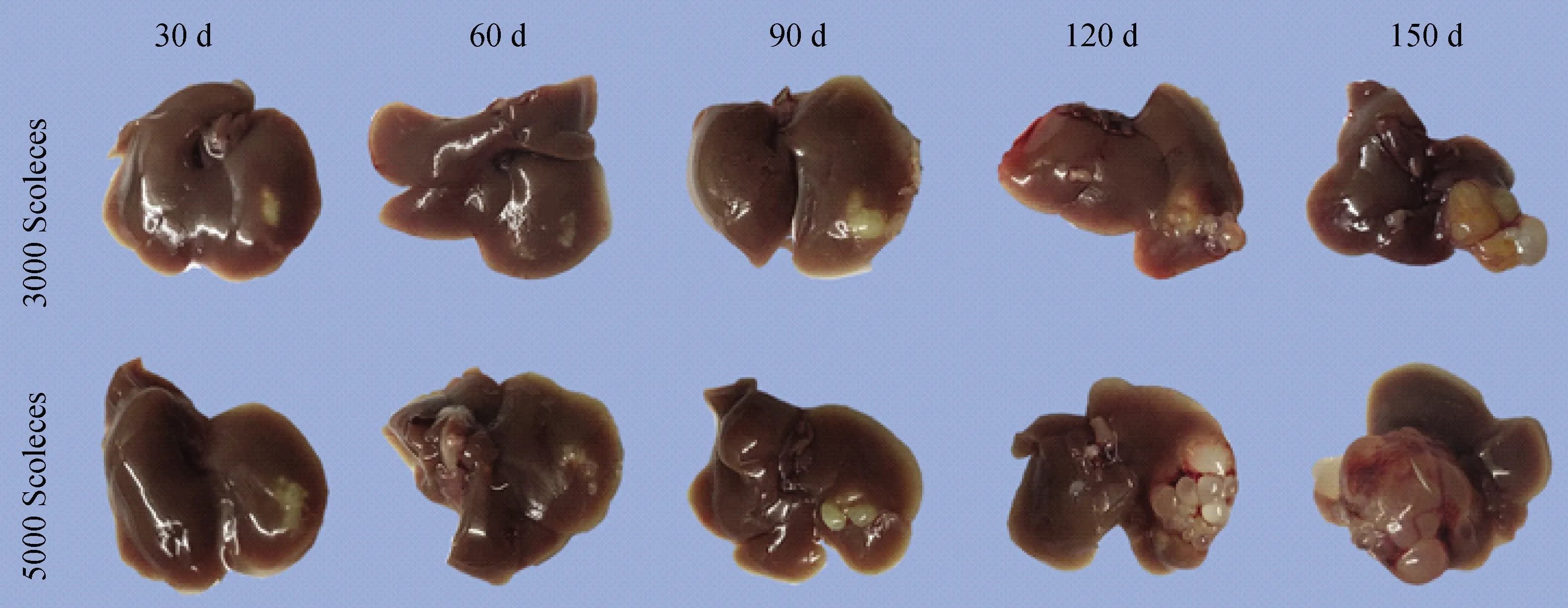
图2 细粒棘球蚴感染后的小鼠肝脏
2.3 HE切片观察
HE的结果显示造模30 d,3 000头节和5 000头节感染的小鼠,感染灶大量淋巴细胞浸润伴嗜酸性粒细胞。感染后60 d,淋巴细胞在病灶浸润程度减轻,囊周有嗜酸性细胞的存在。90 d可以看到有多核巨、异物巨细胞以及上皮样细胞的存在。120 d和150 d囊周淋巴细胞减少,上皮样细胞紧密排列伴角质层的存在,且病灶周围的肝脏组织有大量的红细胞(图3)。
HE染色结果提示细粒棘球蚴感染肝脏的炎症反应程度呈下降的趋势,且感染120 d后有组织淤血的表现。

图3 细粒棘球蚴感染小鼠肝脏后HE染色(40×)
2.4 天狼猩红染色
3 000头节组和5 000头节组在感染30 d时,天狼星红染色显示有疏松的纤维组织形成,60 d纤维组织增多并且有致密化的趋势,而在90 d有一层致密的纤维组织形成,而到了120 d有多层的致密的纤维组织形成,150 d纤维组织增厚且致密化(图4)。
这些提示细粒棘球蚴感染小鼠肝脏过程中,纤维组织增多并且向致密化发展,提示肝脏抗纤维化的治疗也是包虫病的治疗的重要方面。

图4 细粒棘球蚴感染小鼠肝脏后天狼星红染色(40×)
3 讨论
全球估计有120万人受到细粒棘球蚴感染的影响,对人类的生命健康和财产安全带来了威胁[9],因此研究细粒棘球蚴感染肝脏的研究显得十分重要。包虫囊泡向外由无细胞的角质层组成,这些角质层产生育囊和原头蚴(PSC)[10]。角质层由高度糖基化的糖蛋白网组成,在中间宿主的间胚层的免疫逃逸中起关键作用[11]。本实验中可以看到淋巴细胞在30 d大量细胞浸润,随着感染时间的延长,淋巴细胞减少,上皮样细胞和多核巨增多,炎症反应呈现减弱的趋势,在感染后120 d和150 d角质层形成,可能与文献[9-11]描述的一致,角质层与免疫逃逸相关。
细粒棘球蚴感染过程中,由于炎性细胞浸润和纤维化的发展,导致肝脏构架的严重破,肝包虫病的囊性形式,在肝脏中形成寄生虫肉芽肿和在囊肿中发生不可逆的纤维化有关[12]。本实验中,小鼠肝脏组织天狼星红染色显示细粒棘球蚴感染过程中,囊周的纤维组织由疏松到致密,纤维组织的量呈持续性增加,与临床符合,为后续肝包虫病相关纤维化的研究,提供了研究基础
细粒棘球蚴感染模型主要集中在腹腔接种或者肝脏注射。Labsi M等[12]通过在C57小鼠腹腔接种2000头节,感染3个月后可以在肝脏看到非常少量的囊泡,囊泡定位于肝脏,且继发性感染至肝脏的成功率为67%。Patricia E等[13]通过腹腔给与1500头节,5个月后然后用药物治疗,观察囊泡情况,而本实验中,通过在肝脏注射细粒棘球蚴头节3个月之后,可以看到囊泡已经浸润肝叶大部分,形成囊泡,这样用药更能符合细粒棘球蚴寄居宿主部位,更贴近临床实际情况,具有更好的临床参考价值。腹腔接种限制了对肝脏包虫的研究,感染后对淋巴细胞的影响不足以准确反映细粒棘球蚴感染对肝脏的影响。
其他研究对肝脏直接注射细粒棘球蚴头节,稍有欠缺。叶建蔚等[14]注射细粒棘球蚴头节到小鼠的肝脏,他们观察周期为6个月,对造模过程的描述不尽详细,并且感染的周期较长和感染率较低。王慧等[15]通过体外培养60 d形成微囊,然后种植在肝脏,虽然成功率比较高,但是长时间的细粒棘球蚴头节体外培养容易污染,限制了后续的研究。
前期本实验对小鼠的肝脏注射1000/2000头节组,造模40只,只有极个别成功建立继发性感染模型,成功率仅为10%。后期,通过改进注射方法,将头节的注射量提升到3000/5000头节,感染造模成功率达到90%以上且小鼠存活率符合造模的要求,为后续进一步研究细粒棘球蚴的感染提供了研究基础。综上所述,本实验从肝脏组织形态评价了细粒棘球蚴感染小鼠肝脏模型的构建,并且更高的造模成功率,为肝包虫病相关的纤维化以及免疫逃逸机制的研究提供更好的研究基础。

