钠碱盐析结晶法生产亚硫酸钠工艺研究
张 惠,岳国海,贾云雪,谭 刚
(辽宁新华龙大有钼业有限公司, 辽宁 锦州 121013)
0 引 言
我国二氧化硫污染严重影响人民的健康生活[1]。烟气脱硫在我国工业生产中已经不可或缺,按照脱硫产物是否回收,烟气脱硫可以分为抛弃法和回收法,前者将脱硫产物直接排放,后者将脱硫产物以硫酸、硫磺或硫酸盐的形式回收[2-3]。我国许多矿产资源都是以硫化物的形式存在,如辉钼矿、硫铁矿、闪锌矿等。这些矿石资源在火法冶炼过程中都会产生大量的SO2烟气[4-5],如果利用抛弃法进行烟气脱硫,不但会造成二次污染,而且会浪费大量的硫资源。
1 钠碱盐析结晶法工业应用的优缺点
钠碱盐析结晶法生产亚硫酸钠,是近年来新研究开发的一种回收烟气中二氧化硫的新方法[6-7]。钠碱脱硫盐析结晶法具有投资小,脱硫效果稳定,可保证烟气稳定达标排放,而且环保效益优异,副产品亚硫酸钠的用途广,因为产品为固体,相比副产硫酸具有便于运输、便于储存等诸多优点。
钠碱脱硫盐析结晶法的缺点有:1)中和结晶时会产生多余的水分,使整个系统的水量增加,增加的水量需要利用烟气的温度,把多余的水分在淋洗塔中淋洗时带出系统,才能保证系统的水平衡。2)由于淋洗塔是采用Na2SO3饱和溶液做吸收液,烟气带走水分后会产生固体结晶,大量的固体结晶会堵塞淋洗塔。3)钠碱脱硫盐析结晶法在实际生产过程中还会产生少量的Na2SO4副产物。
2 钠碱盐析结晶法理论分析
基于以上问题,本文对钠碱脱硫盐析结晶法进行了理论分析,并提供了具体的解决办法。钠碱脱硫盐析结晶法是用Na2SO3饱和溶液做吸收液,通过喷淋吸收尾气中的二氧化硫,生成溶解度较大的NaHSO3,NaHSO3与NaOH反应后又生成溶解度较小的Na2SO3,并从溶液中析出,经离心机进行固液分离,得到含有一定水分的Na2SO3滤饼,最后通过干燥、包装后成为产品,而离心后的饱和亚硫酸钠溶液又回到吸收系统做下一轮吸收。此方法比钠碱蒸发浓缩结晶生产Na2SO3的工艺节省蒸汽用量,降低了生产成本。
在钠碱脱硫盐析结晶法生产亚硫酸钠过程中主要发生以下反应:
Na2SO3+ SO2+ H2O =2NaHSO3
(1)
NaHSO3+ NaOH = Na2SO3
(2)
副反应为:Na2SO3+1/2O2= Na2SO4
(3)
现对以上3个反应过程进行理论分析。
2.1 中和盐析结晶反应分析
因为Na2SO3溶液是二氧化硫的吸收液,取40 ℃时溶解度为28 g/100 mL的Na2SO3的饱和液作为吸收液,亚硫酸钠的溶解度见表1。
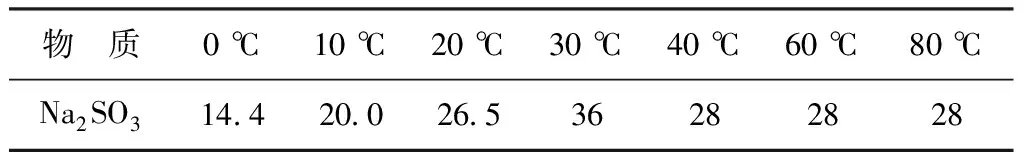
表1 亚硫酸钠的溶解度
下面以128 g(水100 g,Na2SO328 g) Na2SO3溶液,浓度为21.88%,对盐析结晶反应过程进行计算。
2.1.1 吸收
Na2SO3+ SO2+ H2O = 2 NaHSO3
126.04 64.06 18.02 2×104.06
28 14.23 4.00 46.23
2.1.2 盐析结晶
NaHSO3+ NaOH = Na2SO3+ H2O
104.06 40.00 126.04 18.02
46.23 17.77 55.99 8.01
2.1.3 物质衡算
通过化学反应方程式计算
起始物质: Na2SO3:28 g,H2O:100 g
终止物质:Na2SO3:55.99 g,H2O:100 g
8.01-4.00 = 4.01 g
17.77 g(使用50%的液碱,耗17.77 gNaOH带入17.77 g水)
H2O合计: 121.78 g
121.78 g水可以溶解Na2SO3的克数:121.78/100×28=34.10 g
盐析结晶出的亚硫酸钠克数 :55.99-34.10=21.89 g;
结晶占料浆质量百分比:21.89/﹙121.78﹢55.99﹚=12.31%;
结晶后剩余物质:Na2SO334.10 g H2O 121.78 g;
可做循环吸收液的物质:Na2SO328 g H2O 100 g;
需要处理的物质: Na2SO36.10 g H2O 21.78 g;
中间过程NaHSO3浓度46.23/(46.23+100-4.00)=32.50%。
从计算情况看,结晶出21.89 g亚硫酸钠就会剩余27.88 g亚硫酸钠溶液(Na2SO36.10 g,H2O 21.78 g)。
2.2 吸收反应分析
现以128 g溶解度为28的Na2SO3溶液,溶解度为42的NaHSO3溶液进行以下计算。
设128 g饱和Na2SO3溶液中参与反应的Na2SO3为X,得:
Na2SO3+ SO2+ H2O = 2 NaHSO3
126.04 64.06 18.02 2×104.06X
反应生成NaHSO3的量为:
208.12X/126.04=1.65X
反应消耗的水为:
18.02X/126.04=0.143X
剩余的水为:
100-0.143X
剩余的水可以溶解的NaHSO3的量为:
(100-0.143X)×0.42
如果剩余的水可以溶解的NaHSO3的量正好等于生成NaHSO3的量,则:
1.65X=(100-0.143X)×0.42
解得X=24.56 g
以上计算说明,28 g的Na2SO3只能反应掉24.56 g,剩下的3.44 g将会在吸收反应过程中析出。根据中和结晶反应分析,28 g的Na2SO3可以盐析结晶出21.89 gNa2SO3,也就是每盐析生产1 t的Na2SO3,吸收塔就会结晶析出0.157 t的Na2SO3固体。如果采用加水溶解析出固体料的方法,那么根据中和结晶反应分析,28 g的Na2SO3可以生成46.23 g的NaHSO3,但100 g水中只能溶解42 g NaHSO3,剩余的4.23 g NaHSO3需要加10 g的水来溶解,即每盐析生产1 t的Na2SO3,需向一级吸收塔中补加0.46 t的水。
2.3 副反应热力学分析
在钠碱盐析结晶法生产亚硫酸钠的过程中,会有一部分的Na2SO3被氧化成Na2SO4,降低了产品质量,发生的副反应为:Na2SO3+1/2O2= Na2SO4。
由于在三级吸收塔中吸收液主要显碱性,在一级吸收塔中吸收液主要显酸性,现对副反应在酸、碱性条件下进行热力学分析如下:
2.3.1 酸性条件
① O2+ 4H++ 4e = 2H2O
φ1θ= 1.229
② SO42-+2H++2e=SO32-+H2O
φ2θ= 0.172
Δφθ=φ1θ- φ2θ= 1.057
φ1= φ1θ+ (RT/nF)ln[H+]2
φ2= φ2θ+ (RT/nF)ln[SO42-][H+]2/[ SO32-]
Δφ = φ1θ- φ2θ= 1.057+ (RT/nF)ln[ SO32-]/[SO42-]
从上式可见,在酸性范围内,温度越高,反应推动力越大,但pH值对反应没什么影响。
2.3.2 碱性条件
① O2+2H2O+4e = 4OH-
φ2θ= 0.401
② SO42-+H2O+2e = SO32-+2OH-
φ1θ= -0.93
Δφθ= φ1θ- φ2θ= 1.331
φ1= φ1θ+ (RT/nF)ln1/[OH-]2
φ2= φ2θ+ (RT/nF)ln[SO42-]/[ SO32-][OH-]2
Δφ = φ1θ- φ2θ= 1.331 + (RT/nF)ln[SO32-]/[SO42-]
从上式可见,在碱性范围内,温度越高,反应推动力越大,pH值对反应也没什么影响。
对比酸性与碱性电势差计算结果表明,温度越高,反应推动力越大;碱性条件下反应推动力大于酸性条件下反应推动力,即三级吸收塔氧化程度大于一级吸收塔,且随着温度升高,副反应程度增大。
3 钠碱盐析结晶法工艺改进措施
通过对钠碱盐析脱硫生产亚硫酸钠过程中的吸收反应、中和反应及副反应分析,得出每盐析生产1 t的Na2SO3,吸收塔就会结晶析出0.157 t的Na2SO3固体,同时为了使系统的水分平衡,烟气会带走一部分水分,析出更多的Na2SO3固体,为了淋洗塔不堵塞,需要在淋洗塔下部增加悬浮泵,同时要保障Na2SO3固体结晶在淋洗塔中低于一定比例,不然会产生大量泡沫,影响生产的连续性,也可以采用在淋洗塔下增加沉降池,把固体料沉降到池底,定期清理池底料。相比较而言,采用沉降池的方法更节省用电,具有成本优势。副反应主要发生在三级吸收塔,且温度越高,副反应程度越大,可采用让饱和Na2SO3溶液先经过外面池子冷却后再进入三级吸收塔,从而减少副反应的发生。
4 结 论
本文通过对钠碱盐析脱硫生产亚硫酸钠实践过程中出现的问题进行理论分析,找到了问题产生的原因,结合生产实践,对本工艺进行了一系列的技术改造后,钠碱盐析结晶法在钼精矿焙烧烟气脱硫的工艺过程已经十分顺畅,实现了稳定工业化生产。本方法具有投资成本低、烟气处理效果好、产品储存运输方便、销路广等优点。

