孕酮对绵羊输卵管上皮细胞β-防御素-1 mRNA表达的影响
王东阳,杨燕燕,白萨日娜,纳仁高娃,包图雅
(1.内蒙古医科大学 基础医学院,呼和浩特 010110;2.内蒙古农牧科学院,呼和浩特 010031)
防御素作为抗菌肽的主要成分,能够抵御外来病原体的感染,在免疫、预防生殖道感染及胎儿正常发育等方面起到重要作用[1]。山羊乳腺炎使β-防御素-3的表达量增加,说明β-防御素-3在乳腺炎发生和发展的过程中起重要作用[2]。在绵羊体内有两种β-防御素的表达,包括β-防御素-1 (SBD-1)和β-防御素-2(SBD-2)[3],主要分布在生殖、消化、呼吸等各大系统[4-6]。在绵羊的阴道黏膜上皮、子宫颈、输卵管等组织内均存在SBD-1的广泛表达。雌性生殖系统中β-防御素具有中和内毒素活性、抑制补体系统和抵御病毒感染等多种功能[7]。而生殖系统内β-防御素的表达与生理周期有关,主要受孕酮(P4)和雌二醇(E2)的调控[8]。P4具有调节输卵管上皮细胞分泌的活性,同时也能够促进胚胎分裂及发育,为正常妊娠提供一个良好的环境[9],P4可通过作用于LPS受体、TLR信号通路影响抗菌肽的表达[10]。研究发现P4对输卵管上皮细胞SBD-2的表达主要通过核受体途径和膜受体途径介导,据此笔者推测P4影响SBD-1的表达也可能与这两种途径有关,进而调节自身免疫和预防生殖道感染。
国内外已有研究证实SBD-1在输卵管上皮细胞表达[6,11],但P4对绵羊输卵管上皮细胞SBD-1基因表达的调控及相关信号通路的研究较少。因此,本试验通过体外培养绵羊输卵管上皮细胞,探究P4对SBD-1mRNA表达的影响,并用蛋白激酶A(PKA)、蛋白激酶C(PKC)及孕酮核受体(PR)信号通路的阻断剂研究P4在SBD-1mRNA表达过程中的作用,以明确P4调节SBD-1mRNA表达的具体信号通路。
1 材料与方法
1.1 材料
1.1.1 实验动物 在呼和浩特市屠宰场获得间情期健康成年母绵羊。
1.1.2 主要试剂 DMEM/F12,Thermo公司产品;孕酮、RU-486(P4核受体阻断剂)、H-7(PKC通路阻断剂)、H-89(PKA通路阻断剂),Sigma公司产品;极速抽提总RNA试剂盒RNAfast200,上海联迈生物工程有限公司产品;RNA反转录试剂盒Prime ScriptTMRT Regent Kit、实时荧光定量PCR试剂盒SYBR Premix ExTaqTMKit,宝生物工程(大连)有限公司产品;引物由上海生工生物工程技术服务有限公司合成。
1.2 方 法
1.2.1 绵羊输卵管上皮细胞培养 将屠宰后的绵羊迅速解剖并采集输卵管组织,放入无Ca2+的PBS溶液,并在2 h内转运到无菌实验室,进行如下处理:用无菌玻片轻轻刮除输卵管周围组织,去除输卵管内黏液,用体积分数为70%乙醇冲洗纵向剖开的输卵管管腔,然后用PBS溶液洗涤3次,将输卵管放入2%青霉素-链霉素的培养基上,用无菌刀片轻刮,取下输卵管内面组织,用吸管轻轻分散细胞形成单细胞悬液,置于离心机中离心5 min (1 000 r/min),用PBS溶液洗涤2次,重复离心,移除上清液,置于DMEM/F12培养液中,将细胞悬液以10×105mL-1的浓度接种在25 cm2培养瓶中,在37 ℃、φ=95%空气、φ=5% CO2条件下培养,每2~3 d更换1次培养基,肉眼观察细胞形态及生长情况。
1.2.2 细胞干预试验 原代细胞融合至80%~90%,换无血清培养液培养24 h。然后在细胞培养液中添加10-8mol/L P4[12],分别记录不同时间(0 h、2 h、6 h、12 h、24 h、48 h)细胞的生长情况并收集细胞,分别提取总RNA。用无血清DMEM/F12洗涤传代细胞,继续培养24 h,各处理组分别添加10-6mol/L RU-486、50 μmol/L H-7和50 μmol/L H-89信号通路阻断剂。将绵羊输卵管上皮细胞用信号通路阻断剂预处理 1 h,确保每种通路阻断剂的有效性,然后根据P4诱导SBD-1mRNA表达的最佳时间处理细胞,并设P4+阻断剂组、阻断剂组、P4组和对照(Control)组,均置于“1.2.1”所述条件下培养,研究SBD-1mRNA的表达水平。
1.2.3 引物设计 根据GenBank上公布的绵羊SBD-1基因和内参基因β-肌动蛋白(β-actin)序列(U75250,U39357),设计引物见表1。

表1 引物序列Table 1 Primer sequence
1.2.4 总RNA提取和cDNA的合成 按照RNAfast200试剂盒说明提取总RNA,然后按照Prime ScriptTMRT Regent Kit说明书反转录合成cDNA。基因组DNA的去除反应体系:gDNA Eraser 1 μL,5×gDNA Eraser 2 μL,RNase free dH2O 6 μL,总RNA 1 μL。反应条件为42 ℃ 2 min,然后置于4 ℃。进行反转录,反应体系:5×Prime script buffer 2(for real time) 4 μL,Prime Script RT enzyme Mix 1 μL,RT Prime Mix 0.5 μL,RNase Free dH2O 4 μL,基因组DNA的去除反应液10 μL。反应条件为37 ℃ 15 min,85 ℃ 5 s。cDNA产物置于-20 ℃保存,备用。
1.2.5 qPCR 按照SYBR Premix ExTaqTMKit的操作步骤,以cDNA产物为模板,利用iCycleriQTM5实时荧光定量PCR检测系统(美国Bio-Rad公司)检测基因的相对表达量,每个样品重复3次,反应体系20 μL:cDNA模板2 μL,SYBR Premix ExTaqTM10 μL,上游引物(10 μmol/L)与下游引物(10 μmol/L)各0.4 μL,RNase Free dH2O 7.2 μL。反应条件:95.0 ℃ 1 min;95.0 ℃ 10 s,63.0 ℃20 s,72.0 ℃10 s,读板,40个循环;72 ℃延伸7 min。测定熔解曲线:初始温度为70 ℃,每6 s增加0.5 ℃,直至95 ℃。
1.2.6 数据处理 使用IBM SPSS Statistics 19.0(美国IBM公司)中单因子方差(One -way ANOVA)中的最小显著差数法(Least significant difference,LSD)程序分析数据,采用2-△△Ct公式计算基因的相对表达量。结果以“平均值±标准差”表示。
2 结果与分析
2.1 P4对 SBD-1 mRNA表达的影响
在绵羊输卵管上皮细胞中添加10-8mol/L P4,培养2 h、6 h、12 h、24 h、48 h,探究P4对SBD-1mRNA诱导表达的影响。结果显示(图1):2 h时,SBD-1mRNA的表达量与对照组无显著性差异(P>0.05);6 h时,SBD-1mRNA的表达量达到最高峰(P<0.01),为SBD-1mRNA最大诱导量;12 h时,SBD-1mRNA表达量有所下降(P<0.05);24 h与48 h时,SBD-1mRNA的表达量持续下降,与对照组比较,SBD-1mRNA的表达量均无显著性差异(P>0.05)。
2.2 RU-486对输卵管上皮细胞 SBD-1 mRNA表达的影响
使用P4核受体阻断剂RU-486预处理培养细胞1 h,然后添加10-8mol/L P4,6 h后观测SBD-1mRNA的表达量,探究RU-486对P4诱导SBD-1mRNA表达的作用。结果显示:P4组与对照组比较,SBD-1mRNA的表达量显著增加(P<0.05)。RU-486+P4组与P4组比较,SBD-1mRNA的表达量显著下调(P<0.05),表明SBD-1的表达与孕酮核受体有关。RU-486组与对照组比较,SBD-1mRNA的表达量无显著性差异(P>0.05),表明RU-486未参与单独诱导SBD-1mRNA的表达(图2)。

不同字母表示差异显著(P<0.05),下同
Different lowercase letters cindicate significant difference,P<0.05,the same below
图1 绵羊输卵管上皮细胞通过孕酮不同处理时间影响SBD-1mRNA的表达
Fig.1 Effect of progesterone on expressions ofSBD-1mRNA in ovine oviduct epithelial cells at different processing times

图2 绵羊输卵管上皮细胞通过RU-486影响 SBD-1 mRNA的表达Fig.2 Effect of RU-486 on the SBD-1 mRNA expressions in ovine oviduct epithelial cells
2.3 H-89对输卵管上皮细胞中 SBD-1 mRNA表达的影响
用PKA通路阻断剂H-89预处理细胞1 h,再添加10-8mol/L P4,确定PKA信号通路是否参与P4诱导的SBD-1mRNA表达。6 h后结果显示:与P4组比较,H-89+P4组SBD-1mRNA的表达量下调(P<0.05),表明P4诱导SBD-1表达与PKA通路激活有关。H-89组与对照组比较,SBD-1mRNA的表达量无显著性差异(P>0.05),表明H-89单独存在并不能诱导SBD-1mRNA的表达(图3)。
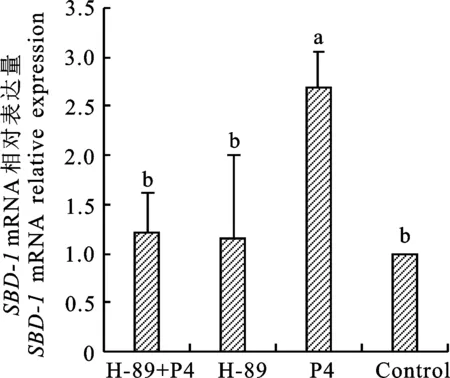
图3 绵羊输卵管上皮细胞通过H-89影响 SBD-1 mRNA的表达Fig.3 Effect of H-89 on the SBD-1 mRNA expressions in ovine oviduct epithelial cells
2.4 H-7对输卵管上皮细胞中 SBD-1 mRNA表达的影响
用PKC通路阻断剂H-7预处理细胞1 h,然后添加10-8mol/L P4,6 h后检测SBD-1mRNA的表达量,确定PKC途径是否介导P4诱导的SBD-1mRNA表达。结果显示:H-7+P4组与P4组比较,SBD-1mRNA表达量无显著性差异(P>0.05),表明H-7不参与SBD-1mRNA的表达,P4上调SBD-1mRNA的表达与PKC通路无关。H-7组与对照组比较,SBD-1mRNA的表达水平上调(P<0.05),表明单独应用H-7可能会诱导SBD-1mRNA的表达(图4)。
2.5 不同信号通路阻断剂对P4诱导 SBD-1 mRNA表达的影响
与对照组相比,10-8mol/L P4可显著上调输卵管上皮细胞SBD-1mRNA的表达(P<0.05);与P4组相比,H-89+P4组SBD-1mRNA相对表达量显著低于P4组(P<0.05),说明H-89抑制P4对SBD-1mRNA的上调作用;RU-486+P4组SBD-1mRNA的相对表达量显著低于P4组 (P<0.05),表明RU-486可抑制P4对SBD-1mRNA的上调表达,且抑制效果为H-89> RU-486(图5)。而H-7+P4组与P4组SBD-1mRNA的表达量无显著性差异(P> 0.05),表明P4对SBD-1mRNA的诱导可能不存在PKC 通路。

图4 绵羊输卵管上皮细胞通过H-7影响 SBD-1 mRNA的表达Fig.4 Effect of H-7 on the SBD-1 mRNA expressions in ovine oviduct epithelial cells

图5 不同信号通路阻断剂影响孕酮诱导 SBD-1 mRNA的表达Fig.5 Effect of various antagonists on SBD-1 mRNA transcription induced by progesterone
3 讨 论
防御素作为抗菌肽的主要成分,对原核、真核病原体及病毒具有较强的杀菌活性[13],可在适应性免疫启动前控制感染,也可作为获得性免疫的中介,刺激抗原发生特异性免疫反应[14-15]。在哺乳动物生殖系统中P4对β-防御素表达的调控成为近年研究的新热点。P4可以降低脂多糖介导的炎性因子的释放,能够上调绵羊输卵管上皮细胞防御素的表达[16-17],其具体调控机制有待研究,本研究通过使用P4处理体外培养细胞,添加相应信号通路阻断剂,进而检测SBD-1mRNA的表达,以明确P4调节SBD-1mRNA表达的具体信号通路。
P4与孕酮受体(PR)结合,主要通过基因组途径(核受体途径)和非基因组途径(膜受体途径)两种主要机制作用于其靶细胞。在基因组途径中,P4的生物学作用由核受体转录因子超家族的PR介导[18-19]。P4与核受体结合后使其构象发生变化,引发寡聚复合体的分离、易位,并与靶基因的孕酮应答元件(PRES)结合调控目的基因的转录[20]。而细胞内多种信号通路及蛋白激酶介导膜受体途径,从而调控P4对输卵管上皮细胞SBD-1mRNA的表达,与基因组途径相比,非基因组途径作用迅速,这和信号级联蛋白激活第二信使和激酶,以及P4与膜受体(mPR)的相互作用有关[21]。P4通过激活腺苷酸环化酶提高cAMP含量,从而激活PKA通路,这个过程涉及到Ca2+的内流[22]。
本研究发现绵羊输卵管上皮细胞存在SBD-1mRNA的表达,P4能显著增加SBD-1mRNA的表达量,并且P4诱导其表达呈时间依赖性,在6 h时SBD-1mRNA的表达量最高,随后表达上调水平逐渐下降(图1)。在未添加P4的培养细胞中仍能检测到SBD-1mRNA的表达,这说明β-防御素是生殖系统先天性免疫系统的成分,P4并不是使其分泌的唯一因素,但加入P4后可以上调SBD-1mRNA的表达水平。
本研究中不同信号通路阻断剂在培养6 h时对比发现,单独加入P4能显著增加SBD-1mRNA的表达;RU-486+P4组与P4组相比,SBD-1mRNA的表达显著下调,阻断P4核受体后,RU-486显著抑制P4对SBD-1mRNA表达的上调作用(P<0.05),而与对照组相比,RU-486组SBD-1mRNA的表达无显著性差异(P>0.05)(图2)。这表明RU-486对SBD-1mRNA表达本身无明显影响,但可通过阻断孕酮核受体抑制P4对SBD-1mRNA表达的上调作用。P4的生理作用是通过与孕酮核受体(PR)结合,激活PR基因表达,从而调控相关蛋白质的生物合成。RU-486能够使P4下调白细胞蛋白酶抑制剂(SLPI)的作用降低[23],P4能有效抑制TLR-4的表达,而添加RU-486后这种抑制作用减弱,这种抑制作用可能与P4作用于糖皮质激素受体和孕酮核受体有关[24]。阻断PKA信号通路后P4对SBD-1mRNA的表达水平明显下调(P<0.05);而PKC阻断剂H-7对SBD-1mRNA的表达无影响(图3、图4)。这可能与P4和膜受体结合,通过cAMP激活丝裂原活化蛋白激酶调控蛋白质的表达有关[25]。以上结果表明,P4对绵羊输卵管上皮细胞SBD-1mRNA的表达调节作用不仅受孕酮核受体信号通路作用,而且也受孕酮膜受体的影响。PKA信号通路可能参与SBD-1mRNA的表达,PKC信号通路不参与SBD-1mRNA的表达,而有研究报道HBD-2的表达受PKC途径的调控[26]。
图5显示,对P4诱导SBD-1mRNA表达的阻断效果为H-89优于RU-486,而H-7影响最小。P4膜受体阻断剂通过非基因组途径起到快速的调节作用,而P4与核受体结合后需要经过转录和翻译的过程,而转录mRNA及合成蛋白质的过程需要数小时,这可能是6 h时膜受体阻断剂的阻断效果更好的原因[27-28]。
综上所述,绵羊输卵管上皮细胞β-防御素的表达受激素水平的调节,而P4对输卵管上皮细胞SBD-1mRNA的表达也受不同时间的影响,其调控机制主要涉及核受体途径(PR)和膜受体途径(PKA)。本研究结果为进一步探索防御素表达的信号通路及机制提供基础,同时为合理使用生殖相关药物提供依据。

