基于测序技术探究卡介菌生物制剂核酸物质基础
周云喜 胡亚磊 杨胜梅 谢安 赵李剑 黄胜 童春义

〔摘要〕 目的 明確免疫调节剂卡介菌多糖核酸注射液中起免疫增强作用的核酸物质基础。方法 (1)核酸提取:试剂盒法分离提取卡介菌及卡介菌多糖核酸注射液的核酸部分;(2)测序:采用第三代测序技术和第二代宏测序技术分别对卡介菌基因组和注射液核酸片段序列进行测序,获得核酸序列;(3)数据分析:统计分析核酸序列中免疫功能的含胞嘧啶-磷酸-鸟嘌呤(cytosine-phosphoric acid-guanine,CpG)的典型CpG基序数量及分布情况;(4)免疫活性分析:采用酶联免疫法分析提取核酸刺激细胞释放免疫因子TNF-α效果。结果 注射液核酸片段中平均每拷贝含有4 000个典型CpG基序,占总基因组的0.5%;富含CpG基序核酸片段刺激细胞释放TNF-α浓度显著强于无CpG基序核酸片段(P<0.01),显示了较强的免疫调节作用。结论 卡介菌多糖核酸注射液核酸物质中富含CpG基序而表现较强的免疫活性,为进一步开发新型免疫调节制剂提供理论基础。
〔关键词〕 卡介菌;CpG;生物信息学;测序;物质基础
〔中图分类号〕R927.11 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.04.008
Exploration of Nucleic Acid Material Basis of BCG Biological Preparation Based on
Sequencing Technology
ZHOU Yunxi1, HU Yalei2,3, YANG Shengmei1, XIE An2, ZHAO Lijian3*, HUANG Sheng2, TONG Chunyi2,3
(1. Hunan Siqi Biopharmaceutical Co., Ltd., Changsha, Hunan 410205, China; 2. Jiuzhitang Co., Ltd., Changsha, Hunan 410021, China; 3. College of Biology, Hunan University, Changsha, Hunan 410082, China)
〔Abstract〕 Objective To clarify the nucleic acid material basis of immunomodulator BCG polysaccharide nucleic acid injection for immune enhancement. Methods(1) Nucleic acid extraction: the nucleic acid part of BCG and BCG polysaccharide nucleic acid injection were isolated and extractedby kit method; (2) Sequencing: the third-generation sequencing technology and second-generation macro-sequencing technology were used respectively to sequence the BCG genome and the injection nucleic acid fragment sequences to obtain the nucleic acid sequence; (3) Data analysis: statistical analysis was performed for the typical cytosine-phosphoric acid-guanine (CpG) motif quantity and distribution of CpG containing immune function in nucleic acid sequence; (4) Immunoactivity analysis: Enzyme linked immunoassay was used to analyze the effect of extracted nucleic acid to stimulate cells to release immune factor TNF-α. Results There were about 4000 typical CpG motifs in each copy on average in injection nucleic acid fragments, accounting for 0.5% of the total gene group. Nucleic acid fragments rich in CpG motifs stimulate cells to release TNF-α at a concentration that is significantly stronger than nucleic acid fragments without CpG motifs, showing a stronger immunomodulatory effect. Conclusion The nucleic acid fractions of BCG polysaccharide nucleic acid injection are rich in CpG motif and show strong immune activity, which provides theoretical basis for further development of new immunomodulatory agents.
〔Keywords〕 BCG; cytosine-phosphoric acid-guanine; bioinformatics; sequencing; substances
卡介菌多糖核酸注射液是在卡介苗素基础上,通过改进工艺生产得到的一种新型非特异性免疫调节剂,主要由核酸及多糖等多种免疫活性物质组成,解决了其它免疫调节剂大分子蛋白清除不彻底等问题,更易于吸收,减少了过敏反应,副作用更小[1]。20世纪 70年代我国开始对卡介菌多糖核酸提取物进行免疫活性的研究,80年代末将其用于临床,现在相关的注射液产品已经畅销国内外30年,是免疫调节剂产品中的明星产品。卡介菌多糖核酸能双向调节机体细胞免疫和体液免疫功能, 具有抗感染、抗变态反应、抗肿瘤等作用[2-3]。除广泛应用于慢性支气管炎、哮喘和反复呼吸道感染的防治外,在肿瘤免疫治疗等领域的应用也取得了一些新的进展[4-5]。
卡介菌多糖核酸产品的免疫调节作用得到众多临床医生的病例验证[6-7],然而,产品作用机制未得到合理的、系统的解释。针对其中的核酸物质,本文通过调研文献,发现一类核酸结构,即含未甲基化的胞嘧啶-磷酸-鸟嘌呤(cytosine-phosphoric acid-guanine,CpG)二核苷酸的核酸片段与卡介菌多糖核酸产品适应证——超敏类疾病密切相关[8-10]。CpG核酸片段在细菌和病毒基因组含量是人体的20倍,可显著引起人体做出免疫应答,刺激释放大量免疫细胞和免疫因子。近年研究表明CpG主要是通过识别和结合人体的Toll受体TLR9[11-12],激活DC等多种免疫活性细胞,刺激多种免疫活性细胞分泌免疫活性分子(趋化因子、黏附分子和共刺激分子)而发挥其免疫作用。因此,卡介菌多糖核酸产品的免疫作用可能与该类核酸的免疫效应有关。本文针对核酸物质的研究特点,应用第三代测序技术进行全基因组快速测定和第二代宏测序技术对卡介菌注射液核酸片段进行测序,再利用生物信息学技术进行分析探讨,结合文献报道,分析具有免疫活性的CpG结构在基因组和产品中的存在情况,以阐述产品核酸物质基础,为进一步开发相关产品提供理论基础。
1 材料与方法
1.1 实验材料与试剂
卡介菌菌体以及卡介菌多糖核酸制剂[注射制剂,批号分别为20170601(A),20170642(B),20170661(C),20170682(D),20170691(E)和20180110(a)]由湖南斯奇生物制药有限公司提供;RAW264.7细胞购于中南大学细胞库;Biospin细菌基因组DNA提取试剂盒:杭州博日科技有限公司;小鼠TNF-α ELISA試剂盒:欣博盛生物科技有限公司;PCR引物:生工生物工程(上海)股份有限公司;2×Power Taq PCR MasterMix:北京百泰克生物技术有限公司;溶菌酶:生工生物工程(上海)股份有限公司。
1.2 主要仪器
MiSeq二代测序仪(美国illumina公司);PacBio Sequel三代测序仪(美国PacBio公司);细胞培养箱(美国Eppendorf公司);YP1002N型电子分析天平(上海精密科学仪器有限公司);THD-0506型恒温水槽(宁波天恒仪器厂);5418R/5702R型台式冷冻离心机(德国Eppendorf公司);NanoDrop2000型超微量紫外分光光度计(美国Thermo公司);Tanon3500型凝胶成像系统(上海天能科技有限公司)等。
1.3 样品核酸提取与纯化
核酸提取参照试剂盒说明进行。取注射液样品溶液加BA缓冲液混合均匀,转移至核酸纯化柱高速离心,弃去接液管中液体,然后向核酸纯化柱加入G Binding Buffer后高速离心,弃去接液管中液体,之后向核酸纯化柱加入Wash Buffer后高速离心,弃去接液管中液体,再次将核酸纯化柱高速离心,并将纯化柱转移至新的1.5 mL离心管,最后向纯化柱中加Elution Buffer,室温温育2 min,于10 000×g离心2 min并弃去纯化柱,1.5 mL离心管中液体即为纯化核酸得到的DNA样品。
1.4 卡介菌基因组和注射液核酸片段测序
1.4.1 第三代测序技术对卡介菌基因组测序 将从卡介菌菌体提取的全基因组核酸进行电泳检测,合格后上第三代测序仪测序,获得测序原始数据。接着基于测序数据进行基因组的从头组装,首先使用Falcon软件进行原始数据的自我矫正及基因组初步组装,基于Overlap-Layout-Consensus算法初步组装得到一致性序列,之后采用GenomicConsensus软件基于其中的Arrow算法以原始数据为辅助再次对一致性序列进行校正,再使用Sprai程序矫正过的原始序列作为辅助数据将组装出来的一致性序列进行Circulator环化处理[13-14],得到最终的基因组序列数据。
1.4.2 第二代宏测序技术对注射液核酸片段测序 将注射液分离提取的DNA进行电泳检测,合格后进行测序建库。检测合格的DNA样品先经过 Covaris 随机打断成350~500 bp的片段,采用TruSeq DNA LT Sample Prep kit试剂盒进行建库,DNA片段经过末端修复、加poly A尾、加测序接头、纯化、PCR扩增等步骤,最终完成文库构建。文库检验合格后利用测序仪进行双端测序,获得所有片段的核酸序列信息。测序下机获得原始测序数据后进入生物信息分析,主要通过对测序错误率、数据量、比对率、覆盖度等进行统计,评估建库测序是否达到了标准[15-17],符合标准则获得注射液核酸片段的测序数据。
1.5 测序数据分析与统计
将获得的基因序列数据转化为excel 格式,应用MATLAB软件分析,撰写分析函数程序,提取和寻找数据中CpG和CpG基序的位置及出现频次,构建频次曲线及位置-频次曲线。
1.6 免疫因子TNF-α检测实验
首先将培养瓶中的巨噬细胞RAW264.7细胞800×g离心5 min,弃上清,加新鲜培养基重悬细胞,计数并调整细胞浓度为1×106/mL,之后将细胞接种于24孔培养板内,然后置37 ℃、5%CO2、95%湿度的培养箱内培养。将细胞分以下几组:A组代表从注射液中提取总核酸刺激细胞组;CpG组代表以注射液核酸为模板,PCR扩增得到富含CpG序列的核酸片段刺激细胞组;No-CpG组代表以注射液核酸为模板,PCR扩增得到不含CpG序列的核酸片段刺激细胞组;No-primer组代表扩增时未加引物的PCR体系(为CpG扩增的阴性对照)刺激细胞组;control:未做任何处理空白组。不同细胞组分别加入相同体积的核酸样品,然后将24孔板置于37 ℃、5% CO2、95%湿度的培养箱内培养12 h后,1 000×g离心20 min,取上清进行检测。免疫因子TNF-α检测实验参照小鼠TNF-α ELISA试剂盒说明书进行。提前将小鼠TNF-α ELISA试剂盒从4 ℃冰箱取出以平衡至室温,设置空白孔加标准品和标本通用稀释液以减除显色液的吸光度空白,其余孔中加不同浓度TNF-α标准品以及上清样品。封胶板纸封住反应孔孵育,洗板之后,空白孔加入生物素化抗体稀释液,其余孔加生物素化抗体工作液,封板孵育。然后洗板,空白孔加酶结合物稀释液,其余孔加入酶结合物工作液,封板孵育,洗板5次,加入显色底物避光孵育,之后再加入终止液,混匀之后即刻使用酶标仪测量OD450值。将6批次产品核酸设置为6个平行孔,以计算平均值。以标准品组测定的OD值与空白孔的OD值差值为纵坐标,标准品浓度为横坐标,绘制标准曲线,样品测定OD值从标准曲线计算得出TNF-α浓度。
2 结果
2.1 核酸物质分离纯化
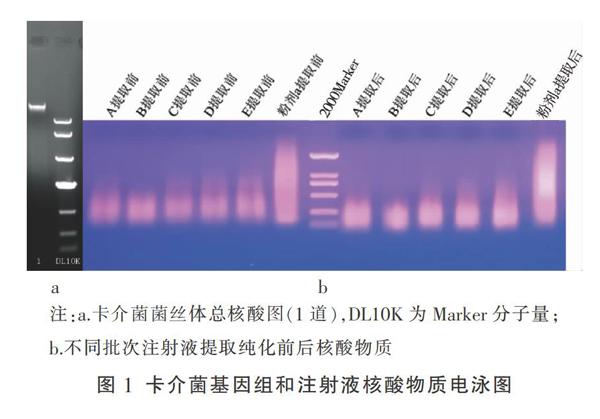
2.1.1 卡介菌菌体全基因组分离提取 卡介菌菌丝体提取总核酸,电泳结果如图1a,从图中可以看出,提取的总核酸条带清晰,无弥散带,满足第三代快速测序。
2.1.2 注射液核酸物质分离提取 产品中核酸物质分离纯化后,DNA浓度得到进一步富集,使用超微量紫外分光光度计检测核酸,可发现260/280值也得到显著提高(从1.6提高到1.9),证明DNA得到纯化,蛋白质和多糖杂质降低。电泳结果(图1b)显示,经过过滤提纯后,不同批次注射液核酸物质条带亮度增加,表明核酸物质经过离心过滤之后得到显著富集,但条带呈现弥散状态,不适用于第三代测序,而适用于第二代宏测序。故注射液中核酸物质采用第二代宏测序技术进行序列测定。
2.2 卡介菌基因组测序及注射液核酸宏测序
2.2.1 卡介菌基因组测序情况 测序获得卡介菌完整基因组总长为4 326 779 bp,CpG含量為65.64%,与美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中卡介菌基因组数据基本一致。
2.2.2 注射液核酸序列宏测序情况 核酸序列测序获得9 311 544个读数片段,解读出1 350 520 724 bases,有效解读率达92%以上,与测序基因组比对发现,覆盖率达99.22%,说明注射液核酸中99.22%以上来自卡介菌菌体基因组,其他部分为未解读部分(片段太小未读出)或来源不明。
2.3 卡介菌全基因组免疫核酸序列分布和定位分析
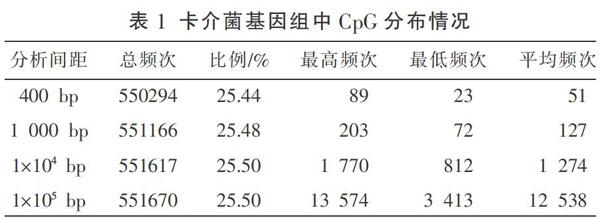
2.3.1 卡介菌基因组中CpG含量及分布分析 以测序获得的基因组序列为数据源,分析了基因组中“CpG”出现的频次、分布图(见图2)和分布情况(见表1)。采用400 bp、1 000 bp、1×104 bp和1×105 bp 4种分析间隔分析基因组中CpG的出现频次,由表1、图2可知,卡介菌基因组中CpG出现总次数达5.5×105余次(不同分析间隔出现次数差异为分段引起),CpG占总基因组比例达25.5%左右,结果表明卡介菌基因组中富含CpG基元,容易形成大量满足要求的CpG片段,起到免疫作用。进一步对CpG组在基因组位置分布进行分析,结果显示CpG在整个基因组中每个区段均有分布,整体较平均,但也有部分区域比例偏高。
2.3.2 基因组中CpG 基序频次及分布分析 CpG分析可知卡介菌基因组中含有大量的CpG组,但核酸免疫往往以基序(6~20个核酸碱基组成的功能序列)的形式展现其免疫功能,因此对基序的分析更为重要。以对人特异免疫的4种CpG基序(GACGTT、AACGTT、GTCGTT、TTCGTT)为研究对象,分析了卡介菌基因组中这4种基序的频次分布情况,结果如图3,CpG基序在基因组中非常丰富,出现频次也非常多,4种基序在整个基因组中出现总频次为3 631次,占整个基因组的0.5%,其中GACGTT和GTCGTT分布出现1 337和1 336次,各占总频次的37%,是4种基序的主要形式。对基序在基因组中的分布和定位发现,基序在基因组分布较为均匀,也有部分集中的区域。
2.4 注射液核酸物质与基因组比对及CpG基序分析
2.4.1 注射液核酸片段序列与基因组比对结果
注射液核酸物质测序共得到9 311 544个大小片段为300~500 bp的测量数,测量得到总碱基数为1 350 520 724 bases,按照卡介菌全基因组含4.32×106 bases,则测量结果可大致为282个拷贝(基因组)的碱基信息结果。
将注射液核酸测序结果与卡介菌基因组测序结果进行比对发现,注射液核酸序列有99.22%以上均能在基因组中找到,而基因组中每个碱基覆盖1次和10次的概率均为100%,说明注射液中的核酸均来自卡介菌基因组。进一步对基因组各区域碱基的覆盖次数进行比对,如图4所示,注射液核酸片段在整个基因组中都出现较高程度的覆盖和重复,平均重复次数在280次左右,与测序基因组拷贝数282个一致,说明注射液中核酸片段均来源于卡介菌基因组,且各片段的保留程度差异不大。同时从频次数据可以看出,核酸片段在部分区段(第4.0×105~4.5×105、第3.6×106~3.8×106碱基处)显著增多,说明这些区段核酸保留地较为丰富,但也有部分区域(第1.4×106~1.45×106碱基处)显著低于平均值,说明可能有部分核酸的缺失。
2.4.2 注射液核酸CpG基序保留情況及分布分析 进一步对注射液核酸中保留的4种CpG基序进行分析,分别以10 000和100 000为间距进行统计分析,如图5,发现产品核酸中保留了大量的CpG基序,除少数几个显著升高的区域,在全基因组中分布也较为平均。从出现频次可以看出,在282个全基因组数据中保留了1 085 216次,相当于每个卡介菌中保留了3 848次,该数据略高于从全基因组分析得到的3 631次,说明注射液产品中核酸物质活性基序得到一定程度的富集。
进一步对4种CpG基序出现频次比较,四种基序出现概率分别为GACGTT和GTCGTT各占37%、AACGTT占12%、TTCGTT占14%,与从全基因组分析得到的结果几乎一致。其中,CpG基序中的GACGTT基序在整个产品核酸中出现频次最高,且在部分区域表现出显著升高,最高可达到4 247/1.0×105次碱基,表现出极高的比例。通过对CpG基序分布定位,有望找到富含CpG基序区域,为挖掘CpG免疫核酸制剂提供基础和数据资源。
2.5 注射液中核酸物质刺激细胞释放免疫因子能力初探
为进一步考察卡介菌多糖核酸注射液中核酸物质是否具有免疫刺激活性,以免疫细胞因子TNF-α为检测细胞因子,研究了提取核酸及以提取核酸为模板克隆得到的含CpG和不含CpG核酸片段刺激巨噬细胞释放细胞因子的能力。结果如图6所示,从卡介菌注射液提取核酸物质(A)能够提高TNF-a释放,证明了卡介菌注射液中核酸物质能够增强细胞因子释放。使用GraphPad Prism 5软件通过T检验分析方法发现,相对于无CpG的核酸片段和克隆缓冲液,克隆得到的富含CpG的核酸片段显著刺激了细胞因子释放,证明细胞因子释放能力主要通过CpG起作用,而通过对卡介菌基因组测序有望筛选得到强免疫刺激能力核酸基序组合,为开发新产品提供依据。
3 结论
卡介菌多糖核酸注射液核酸物质中丰富的CpG基序序列和片段,通过对核酸进行宏测序,获得了详细的核酸序列情况,与卡介菌基因组比对发现,产品核酸绝大部分来自卡介菌基因组,基因组覆盖率达100%。注射液在制备过程中,基因组发生断裂形成核酸片段,但具有免疫刺激作用的CpG基序在注射液核酸中保留完整,还呈现略有富集增加的趋势,免疫因子刺激实验也证明了注射液中丰富的CpG基序保证了产品的免疫刺激能力。实验结果为阐述产品免疫功能及进一步建立产品质控标准提供了理论基础。
参考文献
[1] 国家药典委员会.中国人民共和国药典(第3部)[S].北京:中国医药科技出版社,2015:400-402.
[2] 商 艳,胡振林,李 强,等.卡介苗及其衍生物与支气管哮喘的治疗[J].中华结核和呼吸杂志,2003,26(3):169-171.
[3] 乔飞鸿,吕英军,张晓裕,等.卡介菌多糖核酸体外抗病毒活性试验研究[J].中国农业大学学报,2011,16(3):133-139.
[4] YAN Q, LIU H, CHENG Z, et al. Immunotherapeutic effect of BCG-polysaccharide nucleic acid powder on Mycobacterium tuberculosis-infected mice using microneedle patches[J]. Drug Delivery, 2017, 24(1):1648-1653.
[5] XIONG C, LI Q, LIN M, et al. The efficacy of topical intralesional BCG-PSN injection in the treatment of erosive oral lichen planus: a randomized controlled trial[J]. Journal of Oral Pathology & Medicine. 2009, 38(7):551-558.
[6] 刘 梅,林俊萍,高兴华,等.卡介菌多糖核酸治疗慢性荨麻疹临床疗效观察[J].中国皮肤性病学杂志,2003(3):216-216.
[7] 王成秀,符 州,周 娟,等.卡介菌多糖核酸和特异性免疫治疗对哮喘儿童免疫功能的影响[J].免疫学杂志,2005,21(1):61-63.
[8] MA G, LIU H, DU M, et al. A genetic variation in the CpG island of pseudogene GBAP1 promoter is associated with gastric cancer susceptibility[J]. Cancer, 2019,125(14):2465-2473.
[9] DENG T, ZHU ZI, ZHANG S, et al. HMGN1 modulates nucleosome occupancy and DNase I hypersensitivity at the CpG island promoters of embryonic stem cells[J]. Molecular and Cellular Biology, 2013,33(16):3377-3389.
[10] KLIMEK L, SCHENDZIELORZ P, MUELLER P, et al. Immunotherapy of allergic rhinitis: new therapeutic opportunities with virus-like particles filled with CpG motifs[J]. American Journal of Rhinology and Allergy, 2013,27(3):206-212.
[11] VOLLMER J, KRIEG A M. Immunotherapeutic applications of CpG oligodeoxynucleotide TLR9 agonists[J]. Advanced Drug Delivery Reviews, 2009,61(3):195-204.
[12] KRIEG A M. Therapeutic potential of Toll-like receptor 9 activation[J]. Nature Reviews Drug Discovery, 2006, 5(6): 471-484.
[13] CHIN C S, PELUSO P, SEDLAZECK F J, et al. Phased diploid
genome assembly with single-molecule real-time sequencing[J]. Nature Methods, 2016,13(12):1050-1054.
[14] HUNT M, SILVA N D, OTTO T D, et al. Circlator: automated circularization of genome assemblies using long sequencing reads[J]. Genome Biology, 2015,16(1):294.
[15] CHEN S F, ZHOU Y Q, CHEN Y R, et al. Fastp: an ultra-fast all-in-one FASTQ preprocessor[J]. Bioinformatics, 2018,34(17): i884-i890.
[16] LI H, DURBIN R. Fast and accurate short read alignment with Burrows-Wheeler transform[J]. Bioinformatics, 2010,25(5):1754-1760.
[17] LI H, HANDSAKER B, WYSOKER A, et al. The Sequence Alignment/Map (SAM) Format and SAM tools[J]. Transplantation Proceedings, 2009,19(1/2):1653-1654.
〔收稿日期〕2019-11-14
〔基金項目〕湖南省战略性新兴产业科技攻关项目[湘财企指(2015)96号2015GK1024]。
〔作者简介〕周云喜,男,执业药师,研究方向:生物制剂研制与生产。
〔通讯作者〕*赵李剑,女,高级实验师,E-mail:zhaolj6926648@163.com。

