重组蛋白牛防御素5微球对BCG免疫小鼠的影响
刘一朵 , 于国际 , 张 硕 , 梁正敏 , 孙星雅 , 赵德明 , 周向梅
(1.中国农业大学动物医学院 , 北京 海淀 100193 ; 2. 北京市动物疫病预防控制中心 , 北京 大兴 102629)
据统计,2018年全球新增约50万利福平耐药结核病病例(其中78%为耐多药结核病)[1]。牛结核病是一种由牛分枝杆菌(Mycobacteriumbovis,M.bovis)引起的人兽共患病,在很多发展中国家,其仍是人类健康的巨大威胁之一。而已有共识认为卡介苗(Bacilli-calmette-guerin,BCG)对于儿童抗结核具有有效的保护作用,但随着年龄的增长保护效果逐渐减弱乃至消失[2]。因此,亟需开发新型抗结核药物或者有效的疫苗策略。
牛防御素5(Bovine neutrophils β-defensins 5,BNBD5)为一种牛源β-防御素类抗菌肽,已证实其在体外有直接抗分枝杆菌活性,本实验室前期已成功构建表达重组蛋白BNBD5的毕赤酵母菌株[3]。聚乳酸-羟基乙酸(Poly lactic-co-glycolicacid,PLGA)作为一种由乳酸和乙醇酸共聚而成的无刺激、无毒的高分子聚合物,不仅生物相容性好,而且可在体内降解,是一种绿色高分子材料[4]。
本试验将获得的牛防御素5作为模型药物,以PLGA为载体材料,制备牛防御素5-聚乳酸-羟基乙酸缓释微球(BNBD5-PLGA),进行动物试验观察其对BCG免疫小鼠的影响。
1 材料与方法
1.1 试验材料
1.1.1 菌株及实验动物 已插入重组质粒mBNBD5-pPIC9K的毕赤酵母菌株GS115、NTSE-2(牛分枝杆菌M.bovis)菌以及BCG,均由中国农业大学国家动物海绵状脑病实验室保存;7~8周龄的SPF级BALB/c雌性小鼠,购自北京维通利华实验动物技术有限公司。
1.1.2 主要试剂与材料 PLGA(美国Sigma公司);鼠抗6×His·tag单克隆抗体和羊抗鼠单克隆抗体(Solarbio公司);ELISA试剂盒(Neobioscience公司);二氯甲烷、乙酸乙酯、聚乙烯醇;抗酸染色试剂盒(Solarbio公司);7H9、7H11 Middiebrook系列培养基和OADC增菌液(BD Biosciences公司)。
1.2 方法
1.2.1 重组蛋白牛防御素5(BNBD5)纯化表达及鉴定 根据实验室已建立的方法,表达和纯化重组蛋白BNBD5[3]。鉴定蛋白BNBD5,进行Tricine-SDS-PAGE凝胶电泳,并进行Western Blot检测,将凝胶转到PVDF膜上,后于5%脱脂奶粉室温下孵育1 h,洗涤,鼠抗6×His·tag单克隆抗体4 ℃摇床孵育过夜,羊抗鼠单克隆抗体37 ℃孵育1 h,洗涤后曝光采集图像。
1.2.2 BNBD5-PLGA微球的制备 称取0.163 g PLGA,溶于4.5 mL乙酸乙酯,振荡混匀直至完全溶解,向其中加入0.5 mL蛋白溶液;将上一步制得的溶液在冰浴条件下超声乳化制备初乳,超声条件为40 W, 4 min,工作2 s,停止3 s;制备预复乳,将初乳倒入10 mL的1%PVA溶液中,冰浴条件下超声乳化,超声条件为40 W,6 min,工作2 s,停止3 s;将制得的预复乳倒入10 mL的0.5%PVA溶液中,制得复乳;室温搅拌4 h,挥发油相;离心,蒸馏水洗涤2次, 4 ℃保存隔天即用或真空冷冻干燥机干燥得微球粉末。
1.2.3 小鼠免疫 将SPF级小鼠随机分为5组,分别为正常对照组(8只)、BCG免疫组(8只)、BCG+BNBD5组(8只)、BCG+BNBD5-PLGA组(8只)和攻毒组(5只)。除正常对照组和攻毒组外,其余组对小鼠用1×106CFU的BCG进行皮下接种。接种4周后,BCG+BNBD5组和BCG+BNBD5-PLGA组滴鼻BNBD5(300 μg/只)或BNBD5-PLGA(300 μg/只),而正常对照组与攻毒组滴鼻100 μL PBS,连续3次,每次间隔2周,最后一次滴鼻后4周,每组剖杀3只小鼠(攻毒组除外),取肺泡灌洗液和血清。
1.2.4 ELISA检测细胞因子及抗体 剖杀小鼠,取肺泡灌洗液,取血分离血清,-80 ℃保存。按试剂盒说明书检测血清中TNF-α、IL-1β、IL-10、抗体IgG水平和肺泡灌洗液IgA水平。
1.2.5 小鼠攻毒 最后一次滴鼻给药后4周,除正常对照组外,其他组剩余小鼠滴鼻感染牛分枝杆菌M.bovis,攻毒剂量为1 000 CFU/只,攻毒后观察小鼠状态并记录体重,3周后剖杀小鼠,取肺脏、肝脏、脾脏。
1.2.6 病理学观察及载菌量检测 小鼠剖杀后,取完整肺脏称重,剪下右肺以进行载菌量检测,剪下小片左肺于福尔马林溶液中保存固定,进行石蜡切片制作以及苏木精-伊红(Hematoxylin-eosin,H.E.)染色,并且按试剂盒说明书进行抗酸染色。载菌量检测方法:将取下的小鼠右肺放于1 mL的PBS中研磨,研磨均匀后用PBS稀释103倍,取50 μL于7H10培养基中涂布均匀,培养2~3周观察菌落生长情况并计数。
1.2.7 统计学分析 运用GraphPad Prism 8.0软件对试验数据进行分析,结果以平均值±标准误(Mean ± SEM)表示,在分析差异时,*表示差异显著(P<0.05),**表示差异完全显著(P<0.01),***表示差异极显著(P<0.001),****表示差异极其显著(P<0.000 1)。
2 结果
2.1 重组蛋白牛防御素5(BNBD5)的鉴定 将纯化获得的目的蛋白牛防御素5(含有His-tag标签)分别进行考马斯亮蓝染色和Western Blot检测,其中Western Blot检测使用的一抗为鼠抗6×His·tag单克隆抗体。结果显示,纯化透析后的重组蛋白BNBD5显示与目的蛋白大小一致的蛋白条带,纯度较高(图1A);Western Blot检测重组蛋白样品有单一条带(图1B)。
2.2 BNBD5-PLGA微球制备 在扫描电镜下观察微球形貌并放入Zeta Potential检测仪中,运用Malvern Instrument软件分析数据。结果显示:冷冻干燥得到的白色微球粉末松散,制备的微球大部分圆滑规整,尺寸均为均一,粘连性低,符合预期(图2A);纳米粒度仪测得的微球Zeta电位为-41.9 mV,说明制备的微球较为稳定,平均粒径约为207.9 nm,粒径集中在247 nm左右,多分散系数(PDI)为0.225,表明制备的微球分散性良好、粒径集中(图2B)。
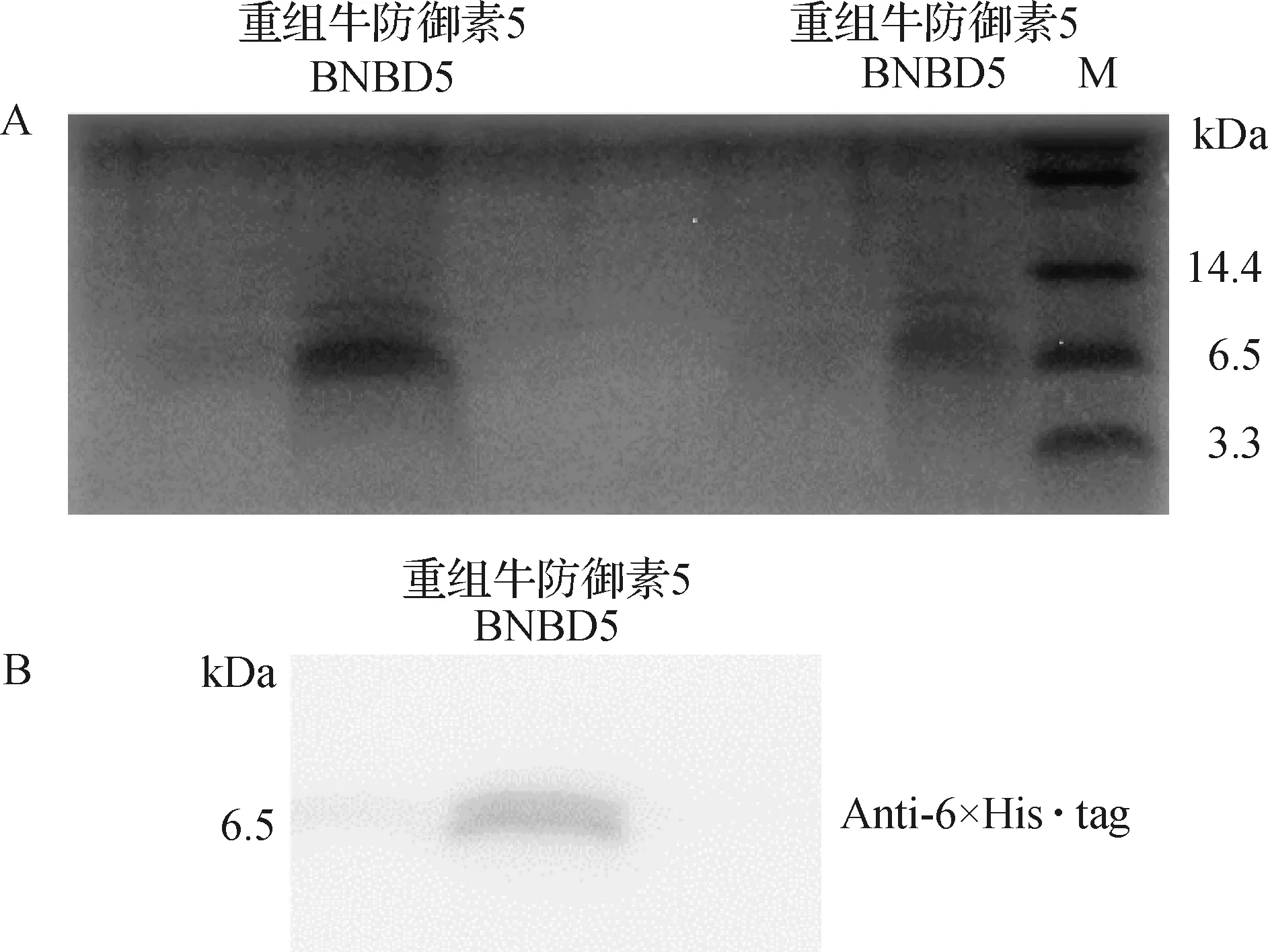
图1 重组蛋白BNBD5的Tricine-SDS-PAGE分析及Western Blot分析
2.3 小鼠免疫后血清中细胞因子和抗体水平 通过ELISA方法检测,分析末次滴鼻给药后4周小鼠血清细胞因子TNF-α、IL-1β、IL-10和抗体IgG水平以及肺泡灌洗液IgA水平。
细胞因子检测结果发现:(1)BCG+BNBD5-PLGA组小鼠血清中TNF-α水平显著高于BCG免疫组和BCG+BNBD5组(P<0.001,图3A);(2)BCG+BNBD5组和BCG+BNBD5-PLGA组IL-1β水平显著高于BCG组(P<0.05,P<0.01),而BCG+BNBD5组较BCG+BNBD5-PLGA组又有明显提高(P<0.05,图3B);(3)除正常对照组外,其余各组小鼠血清中IL-10水平均有显著性降低(P<0.001),但BCG免疫组、BCG+BNBD5组和BCG+BNBD5-PLGA组间无明显差异(图3C)。
抗体检测结果显示:(1)BCG免疫组、BCG+BNBD5组和BCG+BNBD5-PLGA组抗体IgG水平高于正常对照组,BCG+BNBD5组和BCG+BNBD5-PLGA组略高于BCG免疫组(图3D);(2)与BCG免疫组对比,BCG+BNBD5组和BCG+BNBD5-PLGA组小鼠肺泡灌洗液IgA水平有显著性提高,其中BCG+BNBD5-PLGA组又显著高于BCG+BNBD5组(P<0.01,图3E)。
结果显示,牛防御素5及牛防御素5-PLGA纳米微球可以增强小鼠先天性免疫,BCG+BNDB5组和BCG+BNDB5-PLGA微球组小鼠血清中非特异性细胞因子(TNF-α和IL-1β)水平和抗体IgA水平显著提高。
2.4 攻毒后各组小鼠的体重变化和肺脏指数 末次接种微球后4周攻毒剩余小鼠,观察小鼠状态,记录体重并在3周后剖杀小鼠,取脏器。
结果显示:(1)与攻毒组相比,处理组体重减轻比率显著低,而与BCG免疫组比较,BCG+BNBD5-PLGA组体重减轻比率更少(图4A);(2)虽然BCG+BNBD5-PLGA组和BCG+BNBD 5组肺脏指数略低于BCG免疫组,但组间无显著差异(图4B)。
2.5 肺脏载菌量及病理组织学观察 H.E.染色观察:攻毒组小鼠左肺形成严重的炎性灶和组织损伤,处理组小鼠左肺病变程度均有所减轻(见封三彩版图5A);抗酸染色观察:攻毒组病变组织内可发现大量红染的分枝杆菌,与BCG免疫组相比,BCG+BNBD5组和BCG+BNBD5-PLGA组病变部位红染的细菌有所减少,且分枝杆菌被局限在炎性灶内,减少了细菌向周围扩散(见封三彩版图5B);载菌量结果显示:BCG+BNBD5组和BCG+BNBD5-PLGA组与BCG免疫组相比左肺载菌量有所减少,但不显著(见封三彩版图5C)。

图2 BNBD5-PLGA微球表征
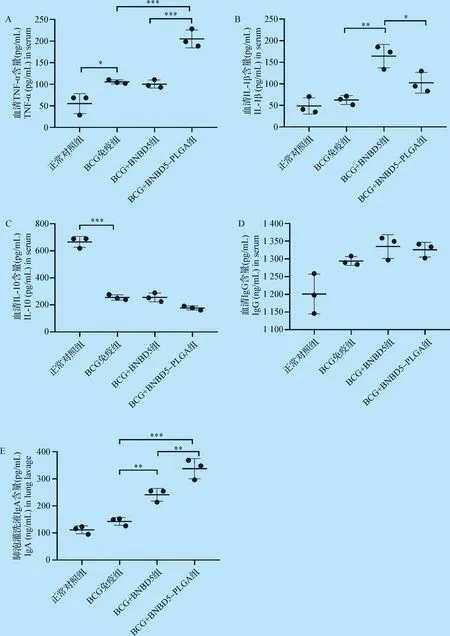
图3 小鼠接种PLGA微球后不同细胞因子和抗体水平
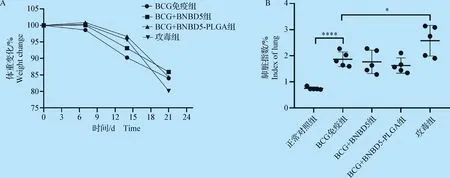
图4 感染后小鼠体重变化及肺脏指数
3 讨论
牛防御素5是一种牛源β-防御素,属于阳离子型抗菌肽。β-防御素一般含有6个半胱氨酸和3个二硫键,二硫键的存在使得防御素不易被酶水解,这也是其抑菌活性强于其他抗菌肽的原因之一[5]。牛源防御素类抗菌肽在体内的分布广泛,本试验所使用的BNBD5可分布于气管、肺泡的中性粒细胞和单核巨噬细胞等[6]。
抗菌肽的非特异性多效作用机制和独特的免疫调节作用优于传统抗生素,激发了医药市场的兴趣。目前已有多种抗菌肽在结核防治方面的方法研究:Khara等[7]合成了α-螺旋肽,证实其与利福平联用具有良好的抗结核分枝杆菌作用;Rekha等[8]发现苯基丁酸酯(PBA)可以诱导促炎型抗菌肽LL-37分泌,从而促进杀伤胞内结核分枝杆菌;Silva等[9]将抗菌肽LLKKK18包在纳米凝胶中用于结核治疗,效果良好。
但也有发现,外源性抗菌肽给药有以下缺点:口服或全身给药后快速降解甚至可能产生毒性、体液稳定性低、在高浓度下可能存在不良副作用(肿瘤,血管增生等)、化学合成成本高等[10]。通过PLGA载体缓释给药,可以保护抗菌肽不被快速降解,并且由于PLGA纳米颗粒良好的靶向性,抗菌肽可以向特定器官持续不断的递送,提高疗效[11]。已有研究发现,PLGA与蛋白类抗原制备的颗粒疫苗可诱导机体产生有效的黏膜免疫[12]。
现在普遍认为,机体抗结核感染时的特异性免疫应答以细胞免疫为主,多种细胞因子参与,体液免疫为辅,但这不能全面反映体内免疫应答的复杂性。TNF-α是一种前炎症细胞因子,可参与巨噬细胞活化、增强吞噬作用,参与肉芽肿形成,从而在感染中发挥作用[13]。已有研究表明,PLGA载体材料可引起小鼠体内TNF-α表达水平上升[14]。IL-1β是单核巨噬细胞分泌的一种促炎细胞因子,可与抗原协同作用,刺激多种不同的间质细胞释放蛋白水解酶[13]。
IgG是机体特异性免疫分泌的主要抗体,IgA是机体黏膜免疫分泌的主要抗体。气管黏膜组织是结核杆菌通过气溶胶传播入侵机体和定居的第一场所,因此黏膜免疫对于抗结核感染具有重要意义。
本试验所表达的重组蛋白BNBD5和制备的微球BNBD5-PLGA通过滴鼻给药的方式在气管黏膜上皮能发挥非特异性免疫诱导作用,促进细胞因子TNF-α和IL-1β以及抗体IgA的表达。纳米载药颗粒由于其更易被宿主抗原递呈细胞(Antigen present cell,APC)摄取的特性能增强免疫应答[15],这也与本试验结果相符,微球BCG+BNBD5-PLGA组相比蛋白BCG+BNBD5组能更有效的诱导黏膜免疫,促进分泌抗体IgA。

