碳化反沉淀法去除硫酸锰浸出液中钙、镁的研究①
陈晓亮, 王海峰, 王家伟
(1.贵州大学 材料与冶金学院,贵州 贵阳550025; 2.贵州省冶金工程与过程节能重点实验室,贵州 贵阳550025; 3.贵州省电池用锰材料工程技术研究中心,贵州 铜仁554300)
硫酸锰为锰系锂电池正极中最基础、最重要的锰源材料[1],若硫酸锰材料中钙、镁离子等杂质含量过高,将直接降低电池的比容量以及充放电次数等关键性能[2]。 基于我国锰矿贫矿多、富矿少,矿石中杂质含量高等特点[3],在净化硫酸锰溶液时普遍存在钙镁离子杂质含量高、除杂工艺复杂、溶液很难达标等问题[4]。 因此,研究出一种简单、经济、高效的方法去除硫酸锰体系中钙、镁离子杂质的方法尤为重要[5-7]。
用碳化法除杂操作简单、安全且成本低。 本文以99.995%的CO2为碳化剂,将CO2通入硫酸锰溶液中,与硫酸锰反应生成碳酸锰沉淀,再将沉淀物反溶以去除钙、镁离子杂质。
1 实 验
1.1 实验原料
实验原料取自贵州铜仁电解锰企业经初级净化除杂后的硫酸锰溶液,利用ICP-MS 测定溶液成分,结果见表1。
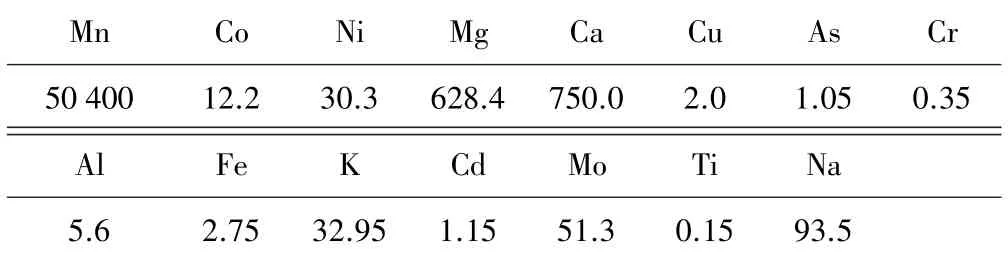
表1 硫酸锰溶液元素分析结果(单位:mg/L)
从样品分析结果可以看出,溶液主要成分为硫酸锰,其中Ca、Mg 含量分别为0.75 g/L、0.628 4 g/L。
粗除杂后的硫酸锰结晶产品ICP 分析结果如表2所示,EDS 分析结果如图1 和表3 所示。

表2 硫酸锰结晶产品ICP 成分分析结果(单位:mg/kg)

图1 硫酸锰结晶产品微区扫描能谱图
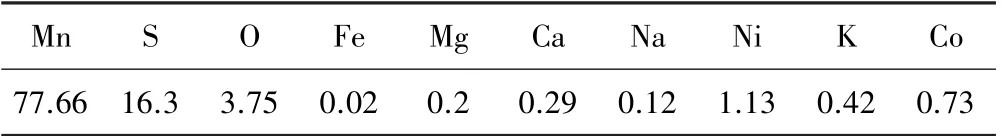
表3 硫酸锰结晶产品EDS 成分分析结果(质量分数)/%
1.2 实验设备
实验设备如表4 所示。
表4 实验设备
1.3 实验方法
CO2碳化实验装置主要包括CO2气瓶、恒温水浴锅、释放器、温度计和pH 计。 实验装置如图2 所示。
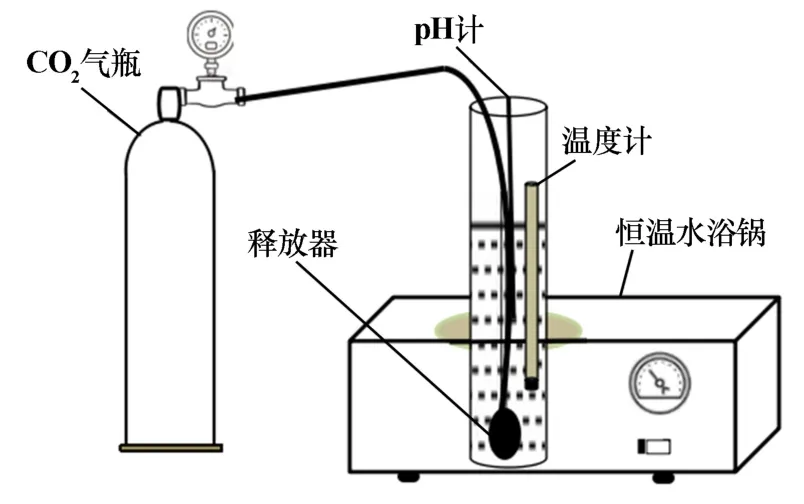
图2 CO2 碳化硫酸锰溶液实验装置
实验过程:取定量的样品注入反应器中,打开高纯CO2气瓶阀门,向其中通入一定流量的CO2气体,由于气流具有搅拌作用,故只通过恒温水浴锅控制温度。同时为控制pH 值保持恒定,向反应器中缓慢滴加pH调节剂。 搅拌反应一段时间后,停止加入调节剂并停止通入CO2,随后继续搅拌一段时间。 反应后的溶液经过滤和多次洗涤后,将获得的碳酸锰沉淀用硫酸返溶得到硫酸锰溶液。
在碳化过程中,硫酸锰溶液中的钙、镁离子及锰离子发生如下反应:
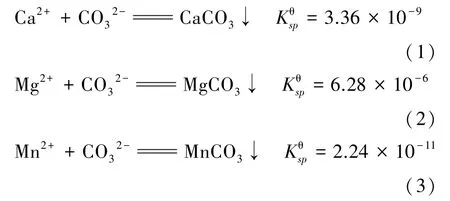
由式(1)~(3)可知,当硫酸锰溶液中通入CO2从而产生CO32-时,Mn2+会比Ca2+和Mg2+优先生成沉淀。原料中c(Ca2+)=1.875×10-2mol/L、c(Mg2+)=2.62×10-2mol/L、c(Mn2+)=0.91 mol/L,由式(1)~(3)计算可得Mn2+完全沉淀时,CO32-浓度为:
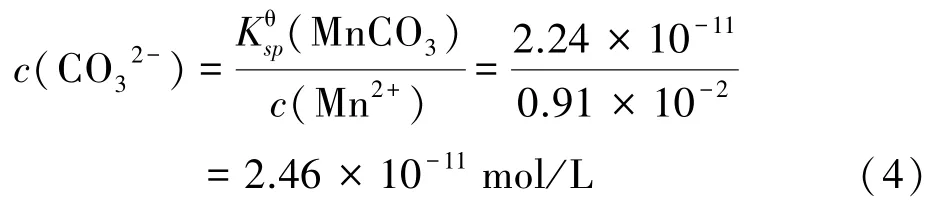
Ca2+完全沉淀时,CO32-浓度为:
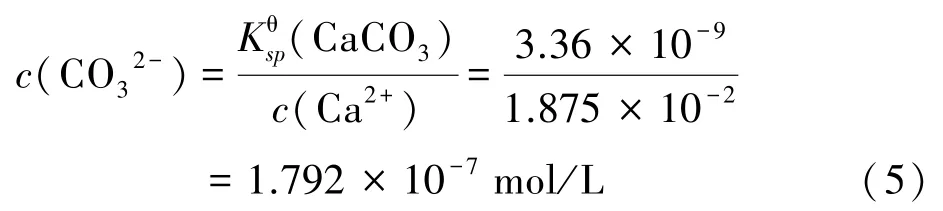
Mg2+完全沉淀时,CO32-浓度为:
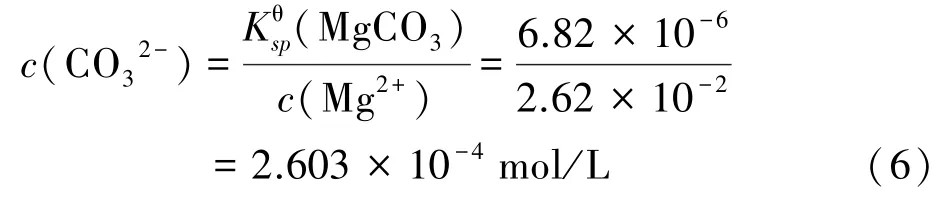
根据上述计算可知,碳化过程中优先生成碳酸锰沉淀,当溶液中c(Mn2+)降至1.792×10-7mol/L 时,系统中持续补给CO32-时才会依次产生碳酸钙和碳酸镁沉淀,因此可以通过控制反应时间来减少钙镁杂质进入沉淀中,从而将Mn2+以碳酸锰沉淀的形式从原溶液中分离出来,再将得到的沉淀物反溶,以达到去除钙、镁离子目的。
2 实验结果及讨论
2.1 CO2 流量
常温下取锰含量为30 g/L 的硫酸锰溶液1 L,控制pH=7.0、反应温度25 ℃、反应时间45 min,研究了CO2流量对硫酸锰溶液中钙、镁净化效果及锰沉淀率的影响,结果如图3 所示。 由图3 可知,随着CO2流量增加,锰沉淀率一直升高,CO2流量2.7 L/min 时锰沉淀率达到89.9%。 碳化产物中钙、镁杂质的含量随着CO2流量增加而下降,在2.7 L/min 时降到最低。 综合考虑锰沉淀率和碳化产物中钙、镁杂质的含量,取适宜的CO2流量为2.7 L/min,此时钙、镁含量分别为220.0 mg/kg 和100.0 mg/kg。
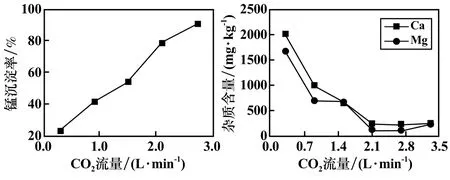
图3 CO2 流量对锰沉淀率及杂质去除效果的影响
2.2 pH 值
CO2流量2.7 L/min,其他条件不变,研究了pH 值对硫酸锰溶液中钙、镁净化效果及锰沉淀率的影响,结果如图4 所示。 由图4 可知,随着pH 值升高,锰沉淀率先迅速升高,在pH 值达到6.9 以后,锰沉淀率增加缓慢。 碳化产物中钙、镁杂质含量在pH =6 ~6.5 附近下降,在pH>7 之后,钙、镁杂质在碳化产物中的含量迅速上升。
25 ℃时,Mn2+、Ca2+、Mg2+在硫酸锰溶液中的理论沉淀pH 值如表5 所示[9]。
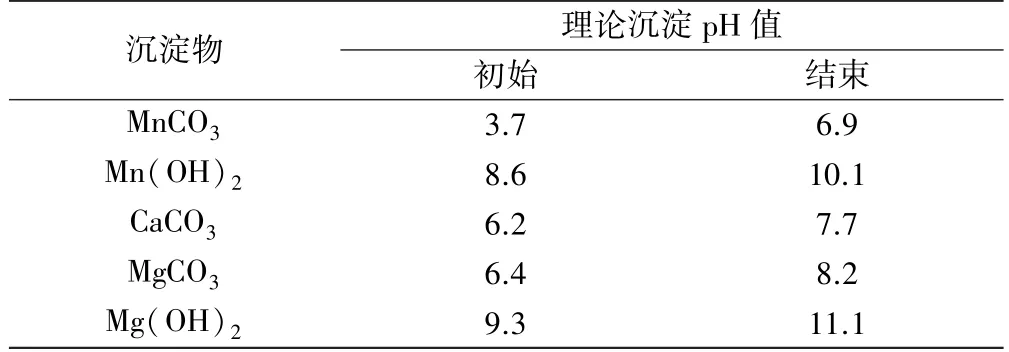
表5 25 ℃理论沉淀pH 值
由表5 可知,锰沉淀率应在pH =7 左右达到最佳值。 在pH>6.5 之后,碳化产物中钙、镁杂质含量会略微上升,Ca2+、Mg2+分别在pH 值为7.7 和8.2 时达到沉淀平衡,因此在pH>7.0 之后,碳化产物中钙、镁杂质的含量会迅速升高。
综合考虑锰沉淀率和碳化产物中钙、镁杂质含量,取适宜的pH 值为7.0,此时钙、镁含量分别为256.6 mg/kg和339.0 mg/kg。
2.3 反应温度
pH=7.0,其他条件不变,研究了反应温度对硫酸锰溶液中钙、镁净化效果及锰沉淀率的影响,结果如图5 所示。 由图5 可知,随着温度升高,锰沉淀率增加,45 ℃时锰沉淀率达到97.79%。 钙、镁杂质在碳化产物中的含量先急剧增加,后趋于平缓。
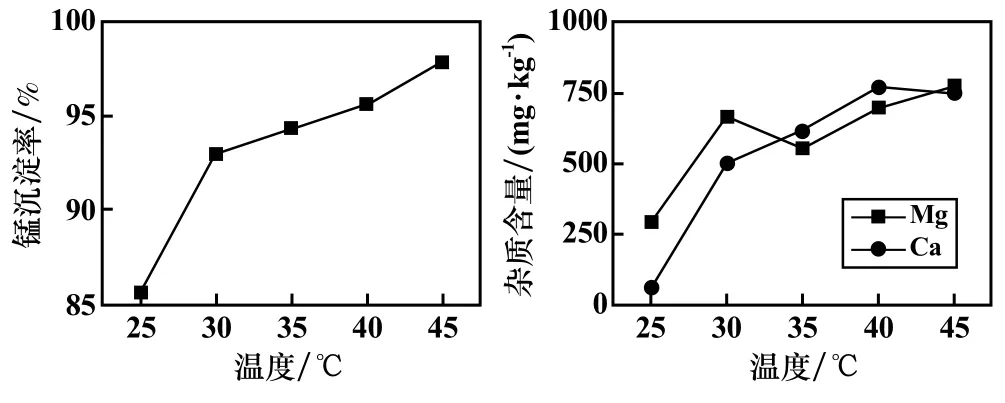
图5 反应温度对锰沉淀率及杂质去除效果的影响
从热力学角度分析,碳化硫酸锰溶液的过程可简化为:
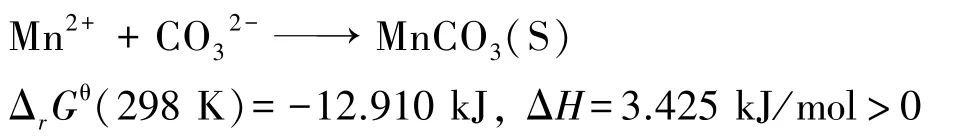
可知,该过程为吸热反应,温度升高有利于二氧化碳的溶解和碳酸锰沉淀的生成[10]。 随着温度升高,反应ΔrGθ负值越大,反应平衡常数k 值越大,反应自发进行的趋势越大,进行得更彻底,理论产量越高,因此锰沉淀率会随着温度升高而增加。
综合考虑锰沉淀率和碳化产物中钙、镁杂质含量,取适宜的反应温度为45 ℃,此时钙、镁含量分别为772.9 mg/kg 和750.0 mg/kg。
2.4 反应时间
反应温度45 ℃,其他条件不变,研究了反应时间对硫酸锰溶液中钙、镁净化效果及锰沉淀率的影响,结果如图6 所示。 由图6 所知,随着反应时间增加,锰沉淀率升高,但在反应时间60 min 之后略微下降。 碳化产物中钙、镁杂质含量随反应时间增加呈先下降后上升的趋势,在45~60 min 趋于平缓。
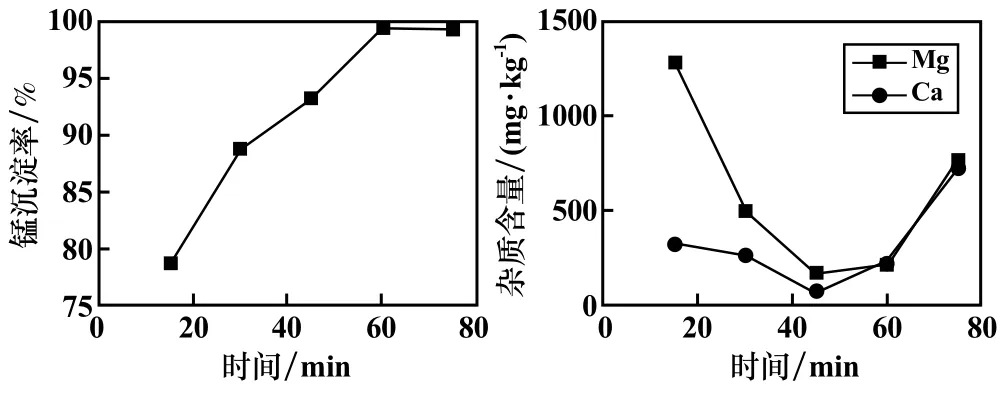
图6 反应时间对锰沉淀率及杂质去除效果的影响
由双膜理论中传质速率公式可知,碳化效果与反应时间成正比,反应时间越长,粒子间反应越充分,锰沉淀率也随之升高。 当反应时间增加到60 min后,体系中参与反应的Mn2+、CO32-浓度较低,分子间碰撞的几率较小,反应基本趋于平稳,接近反应终点[11]。 考虑到过长的反应时间不仅会增加运行成本,也会富集碳酸锰沉淀中杂质含量,故选择适宜的反应时间为60 min,此时钙、镁含量分别为236.0 mg/kg 和216.0 mg/kg。
2.5 优化条件实验结果及讨论
根据单因素试验确定最优的实验条件为:反应温度45 ℃、溶液pH 值7.0、CO2流量2.7 L/min、反应时间60 min。在该条件下获得的碳化产物烘干后经扫描电镜分析的碳酸锰颗粒内微区的X 射线能谱图如图7所示,对应区域碳酸锰中钙、镁含量EDS 分析如表6所示。 由表6 可知,本法所得产品中钙、镁杂质含量已达到高纯碳酸锰Ⅰ型品的标准。

图7 碳酸锰颗粒内微区能谱图

表6 高纯碳酸锰质量指标
3 结 论
1) 碳酸锰完全沉淀所需的理论pH 值为6.9,pH值过高会形成难溶沉淀碳酸盐和氢氧化物,因此合理控制溶液最终pH 值是净化硫酸锰溶液的重要影响条件。
2) 确定了碳化法去除硫酸锰浸出液中钙、镁离子的最适宜工艺条件为:反应温度45 ℃,溶液pH 值7.0,CO2流量2.7 L/min,反应时间60 min。
3) 在最适宜工艺条件下获得的硫酸锰溶液中钙、镁杂质含量仅为0.03%和0.01%。 与氟化沉淀法、复盐沉淀法和硫化剂除杂等工艺相比,此方法更环保、安全,且工艺简洁。

