Toll样受体-5在喉鳞状细胞癌中的表达及作用
蒋怀礼 沈纳 周雷 黄新生
(复旦大学附属中山医院耳鼻喉科 上海 200032)
免疫炎症反应在肿瘤发展的不同阶段起作用,包括肿瘤发生、侵袭和转移,同时影响肿瘤的免疫监视和治疗敏感性[1]。模式识别受体在固有免疫和适应性免疫的炎性反应中均具有重要作用,其中以Toll样受体(Toll-like receptors,TLRs)家族的研究最为广泛。TLRs激活后在肿瘤的发生、发展中发挥作用[2],然而不同的TLRs激活后表现出完全不同的结果[3]。TLR-5在小鼠巨噬细胞和传统树突状细胞不表达,并且在不同的肿瘤中,TLR-5激活表现出不同的作用。鞭毛蛋白(flagellin)激活TLR-5信号通路后抑制结肠癌的增殖[4],却促进乳腺癌的增殖[5]。喉鳞状细胞癌(简称喉鳞癌)是头颈部常见的恶性肿瘤,恶性程度高,易转移和复发。喉黏膜表面定植着多种正常菌群,调节局部炎症反应,喉癌发生后,菌群比例发生变化,提示菌群失调可能在喉癌的发生、发展中发挥作用[6]。本研究旨在探讨TLR-5在喉鳞癌增殖和免疫微环境中的作用。
1 材料与方法
1.1 材料 纳入2016年1月~2018年12月在我科行喉部分切除术或全喉切除术,经病理确诊为喉鳞癌的患者42例;年龄18~85岁,平均(51.00±6.78)岁。病例排除标准:喉鳞癌复发;喉咽恶性肿瘤;曾因喉恶性肿瘤接受过手术治疗、放射治疗(简称放疗)、化学药物治疗(简称化疗)或免疫治疗;合并其他脏器恶性肿瘤;合并传染病、全身免疫系统疾病及免疫缺陷者(如肺结核、梅毒、艾滋病等)。本研究经复旦大学附属中山医院伦理委员会批准。术中取癌组织和癌旁组织(距肿瘤2 cm内)并立即投入4%多聚甲醛、Trizol或液氮中用于后续实验。
1.2 定量反转录聚合酶链反应检测TLR-5和炎症因子的表达 采用1 mL Trizol法提取血清总RNA。具体步骤按照Trizol试剂盒说明书中步骤进行。将总RNA 按照反转录试剂盒的说明书进行RNA反转录后合成cDNA。采用 50 μL反应体系行聚合酶链反应(polymerase chain reaction,PCR),95 ℃ 10 min,95 ℃ 15 s,60 ℃ 45 s,72 ℃ 2 min,共 40个循环。以GAPDH作为内参。
1.3 细胞培养及稳定转染
1.3.1 细胞培养 将人喉鳞癌细胞系Hep-2培养在含 10%胎牛血清的培养基中,培养环境为37 ℃、5% CO2,每48 h行2.5%胰蛋白酶消化、传代,取对数生长期细胞用于实验。
1.3.2 慢病毒构建稳定细胞系 取对数生长期的Hep-2细胞,胰蛋白酶消化后接种于含8 μg/mL polybrene的完全培养液96孔板中,体积100 μL。培养过夜,观察细胞状态,加入慢病毒液 2 μL。在37 ℃、5%的CO2培养箱培养6 h后,更换为完全培养液;放置在37 ℃、5%的CO2培养箱中继续培养24~96 h,显微镜下观察细胞生长状态及荧光比例。PCR检测转染效果。TLR-5-shRNA序列为:F,CACCGCTCCTAA-TCCTGATGTATTTCGAAAAATACATCAGGATTAGGAGC;R,AAAAGCTCCTAATCCTGATGTATTTTTCGAAATAC-ATCAGGATTAGGAGC。TLR-5过表达序列为:F,AATTAAGGAAGCTAGATGGGAGACCACCTGGACC;R,TAAACCCAAGGCGCGTTAGGAGATGGTTGCTACA-GTTTGCAACG。
1.3.3 CCK8检测细胞增殖 分别取对数生长期Hep-2-NC、Hep-2-TLR-5敲除和Hep-2-TLR-5过表达细胞,制作单细胞悬液,以1×105/mL接种于96孔板,培养基200 μL,每组6个复孔。置37 ℃培养24 h后,每孔加入CCK8 200 μL,分别于24、48、72 h用酶标仪检测各孔450 nm处的吸光度(optical density,OD)值。
1.3.4 免疫组织化学 取多聚甲醛固定后的组织行石蜡包埋,常规切片(4 μm)后制片。苏木素-伊红(hematoxylin-eosin,HE)染色观察。TLR-5抗体[1∶1 000磷酸盐缓冲液(phosphate buffer saline,PBS)+1%牛血清]孵化过夜,二抗(1∶200)孵化1 h。用PBS洗涤样品,并用链霉亲和素-辣根过氧化物酶结合液培养20 min。封片后显微镜下观察。棕黄色颗粒即为染色阳性。
1.3.5 基因聚类分析免疫细胞浸润与预后分析 在TCGA中下载人头颈鳞癌数据,分析与TLR-5呈正相关和负相关的基因,后用Metascape网站在线分析和绘制基因聚类图。免疫细胞浸润分析采用TIMER数据库,纳入B细胞、CD4+T细胞、CD8+T细胞、巨噬细胞、中性粒细胞和树突状细胞。免疫细胞浸润与预后分析利用TCIA数据库完成。
1.4 统计学处理 采用SPSS 22.0和Graphpad Prism 13.0行t检验和卡方检验。P<0.05为差异具有统计学意义。
2 结果
2.1 TLR-5在喉鳞癌中的表达及与预后的关系 TLR-5在喉鳞癌组织及癌旁组织中均有表达,且在癌旁组织中的表达明显高于癌组织(P<0.05,图1A、1B);免疫组织化学结果的量化分析也显示癌旁组织的TLR-5阳性区域面积高于癌组织。预后分析结果表明,高表达TLR-5的喉鳞癌患者较低表达者总体生存率高(P=0.017,图1C),而无病生存率在二者间差异无统计学意义(P=0.19,图1D)。
2.2 TLR-5相关基因的聚类分析 为了进一步了解TLR-5在喉鳞癌中可能的功能,本研究利用TCGA数据库分析得出与TLR-5相关的基因。以相关系数(R)>0.3为界,共纳入2 020个基因,其中正相关基因1 480个,相关性最强的5个基因分别为SUSD4、CYP4X1、MAML3、SCYL3、RASEF(图2A);负相关基因540个,相关性最强的5个基因分别为SLC3A2、NUTF2、TPD52L2、PXN、EBNA1BP2(图2B)。
基因聚类分析结果显示,TLR-5正调控淋巴细胞激活、免疫应答、细胞因子分泌、细胞黏附等过程(图2C);负调控核糖核酸酶复合物生成、翻译终止、核糖体大亚单位合成、蛋白质折叠及细胞周期等(图2D)。因此推测,TLR-5可能影响喉鳞癌的增殖、炎性因子的释放及免疫浸润。

图1 TLR-5在喉鳞癌组织及癌旁组织中的表达 A、B.TLR-5在喉鳞癌组织及癌旁组织中均有表达,且在癌旁组织中的表达明显高于癌组织(P<0.05);C.高表达TLR-5的喉鳞癌较低表达者总体生存率更高(P=0.017);D.无病生存率在两者间差异无统计学意义(P=0.19)。
2.3 TLR-5对Hep-2细胞的增殖影响 先用慢病毒在Hep-2细胞中构建了TLR-5基因敲除和过表达的稳定细胞系,通过筛选,保证荧光比例>90%(图3A),并用qRTPCR检测敲除及过表达效果(图3B)。与对照组相比,敲除组的TLR-5表达明显降低(P<0.05),过表达组的TLR-5表达明显升高(P<0.05)。
接着利用CCK8观察了TLR-5对Hep-2细胞增殖的影响。在24、48、72 h,TLR-5敲除组的OD值明显高于过表达组(P值均<0.05,图3C);用TLR-5的天然配体鞭毛蛋白1 ng/mL刺激后各组在24、48、72 h的OD值较无鞭毛蛋白刺激减小(以72 h为例,P值均<0.05,图3D)。上述结果表明,TLR-5抑制Hep-2细胞增殖,鞭毛蛋白可进一步抑制增殖。
2.4 TLR-5对肿瘤微环境中炎性因子的影响 炎症因子的释放对肿瘤微环境具有重要作用,因此我们探讨了TLR-5对炎症因子的影响。qRT-PCR结果显示,在24、48、72 h,TLR-5过表达组较对照组和敲除组白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6和IL-17的表达明显上调(P值均<0.05);用TLR-5的天然配体鞭毛蛋白1 ng/mL刺激后过表达组和敲除组在24、48、72 h的IL-1β、TNF-α、IL-6和IL-17的表达明显上调(P值均<0.05),而敲除组各时间点炎症因子的表达差异无统计学意义(图4A~D)。进一步采用ELISA检测鞭毛蛋白刺激72 h时各炎症因子的蛋白情况,结果与mRNA结果一致(图4E)。上述结果表明TLR-5激活后促进炎症因子表达。
2.5 TLR-5表达与免疫细胞浸润程度的关系 采用TIMER数据库探讨头颈部鳞癌中TLR-5表达水平与不同免疫细胞浸润比例的关系,结果表明:TLR-5的表达与B细胞(R=0.298,P<0.05)、CD8+T细胞(R=0.291,P<0.05)、CD4+T细胞(R=0.266,P<0.05)、巨噬细胞(R=0.152,P<0.05)、中性粒细胞(R=0.142,P<0.05)和树突状细胞(R=0.257,P<0.05)的浸润比例呈正相关(图5A)。
随后通过TCIA数据库研究头颈部鳞癌中不同免疫细胞与患者生存预后的关系。结果显示:B细胞浸润比例越高,患者生存时间越长(logrankP=0.004 9,图5B),而CD8+T细胞(logrankP=0.415 7,图5C)、CD4+T细胞(logrankP=0.298 5,图5D)、巨噬细胞(logrankP=0.239 5,图5E)、中性粒细胞(logrankP=0.188 7,图5F)和树突状细胞(logrankP=0.869,图5G)浸润比例与生存预后无明显相关性。提示TLR-5可能通过招募B细胞影响肿瘤进展。

图2 TLR-5相关基因的聚类分析 A.正相关基因热图;B.负相关基因热图;C.基因聚类分析结果显示,TLR-5正调控淋巴细胞激活、免疫应答、细胞因子分泌、细胞黏附等过程;D.TLR-5负调控核糖核酸酶复合物生成、翻译终止、核糖体大亚单位合成、蛋白质折叠及细胞周期等。

图3 TLR-5对Hep-2细胞增殖的影响 A.利用慢病毒构建稳定的TLR-5敲除和过表达细胞系;B.稳定细胞的TLR-5表达验证;C.在24、48、72 h,TLR-5过表达组的CCK8OD值明显低于敲除组和对照组(P值均<0.05);D.鞭毛蛋白1 ng/mL刺激后各组在24、48、72 h的OD值较无鞭毛蛋白刺激减小(以72 h为例,P值均<0.05)。
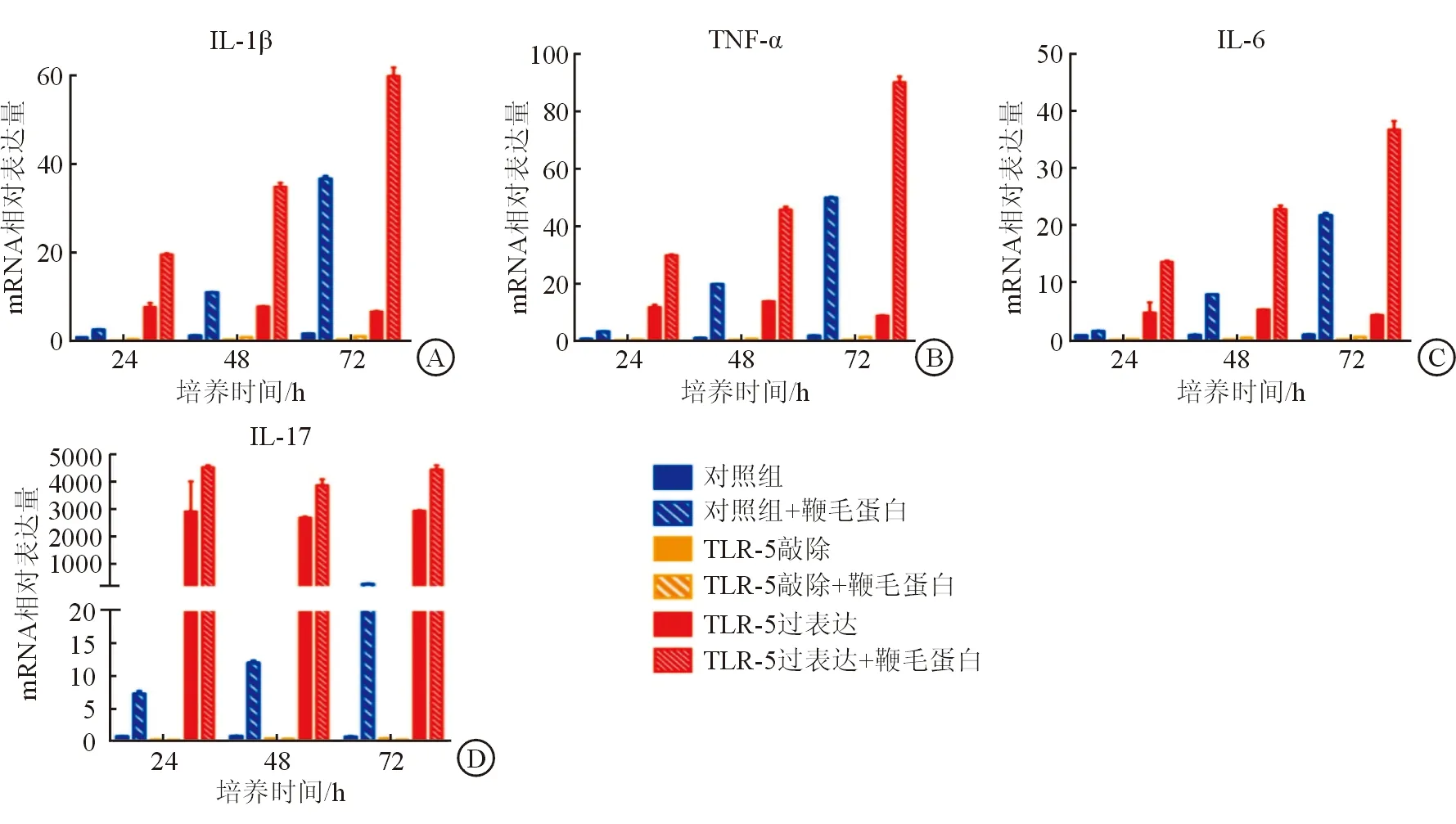
图4 TLR-5对肿瘤微环境中炎症因子表达的影响 在24、48、72 h,TLR-5过表达组较对照组和敲除组IL-1β(A)、TNF-α(B)、IL-6(C)和IL-17(D)的表达明显上调(P值均<0.05);鞭毛蛋白1 ng/mL刺激后,过表达组和敲除组在24、48、72 h的IL-1β(A)、TNF-α(B)、IL-6(C)和IL-17(D)的表达明显上调(P值均<0.05),而敲除组各时间点炎症因子的表达差异无统计学意义。

图5 TLR-5表达与免疫细胞浸润比例的关系 A.TLR-5的表达与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞的浸润比例呈正相关;B.B细胞浸润比例越高,患者生存时间越长;C~G.CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞浸润比例与生存预后无明显相关性。
3 讨论
TLRs在固有免疫及适应性免疫中的作用已得到广泛研究,随着炎症与肿瘤发生、发展关系的揭示[7-8],TLRs在肿瘤中的作用逐渐成为热点。TLRs主要表达在免疫细胞表面,因此绝大多数研究都将关注点放在免疫细胞表达TLRs在肿瘤中的作用,然而近年来研究表明TLRs也可以表达在肿瘤细胞表面。目前为止,关于肿瘤细胞表达TLRs对肿瘤及肿瘤微环境影响的研究非常少。Huang等[9]研究发现,肿瘤细胞TLR-4激活后促进结肠癌、乳腺癌、前列腺癌、黑色素瘤和肺癌增殖,同时促进IL-6、诱导型一氧化氮合酶、IL-12、B7-H1、B7-H2的表达,从而抑制肿瘤免疫反应。本研究发现,不同于TLR-4的功能,TLR-5能抑制喉癌细胞的增殖,同时促进炎症因子合成,招募免疫细胞,促进肿瘤免疫反应。
不同于其他肿瘤中TLRs的高表达,本研究发现TLR-5在喉鳞癌细胞表面表达,但较癌旁组织的表达降低。可能的原因有2种。首先,喉鳞癌中TLR-5基因发生了甲基化,以CpG岛和启动子上的甲基化为主,这2个部位的甲基化率与TLR-5的表达呈负相关;其次,TLR-5基因存在大量的突变,大多为无义突变,对TLR-5的功能无明显影响,而7%的人存在TLR-5终止突变,使得TLR-5跨膜结构的胞内段缺失,从而无法发挥抗肿瘤作用[10]。本研究还发现,鞭毛蛋白不仅可以激活TLR-5通路,同时也可以上调TLR-5的表达(数据未列出),因此即使喉鳞癌细胞低表达TLR-5,鞭毛蛋白依然可以发挥促炎和抗肿瘤作用。
TLR-5的天然配体为鞭毛蛋白,主要来自于肠道菌群,如大肠埃希杆菌,而正常咽喉部及喉鳞癌中常见细菌为链球菌及梭杆菌等[6],因此理论上喉鳞癌中TLR-5受体无法激活。然而,我们的研究表明,即使在无鞭毛蛋白刺激的环境下,TLR-5依然可以发挥抑制肿瘤和促进炎症因子合成的作用。究其原因可能为TLR-5被内源性配体所激活。TLRs除了可以识别外源性配体外,还可以识别多种内源性配体。例如TLR-4可以识别内源性配体Mrp8和Mrp14,从而促进致命内毒素性休克[11];TLR-4还可以识别死亡肿瘤细胞释放的HHMGB1,从而提高化疗及放疗敏感度[12],然而目前为止TLR-5的内源性配体尚未明确[13]。
本研究重点在体外实验中验证了TLR-5对喉鳞癌增殖的抑制作用和对肿瘤微环境中炎症因子的影响,但细胞系较为单一,且其在体内的作用尚未可知,因此接下来在多种喉鳞癌细胞系中进行验证和动物模型的构建必不可少。另外,TLR-5抑制喉鳞癌增殖、促进炎症因子分泌和招募免疫细胞的具体通路需要进一步探索。本研究还借助多个数据库预测了TLR-5在喉鳞癌中的作用,并验证了其中一部分,但尚有很多功能和机制值得探索。因此,在接下来的研究中我们将全面探索TLR-5在喉鳞癌中的作用,并在体外和体内实验中验证,同时期望能找到高效激活TLR-5的方法。
肿瘤细胞与免疫细胞之间的相互作用在肿瘤增殖、血管生成、肿瘤转移中具有重要作用。本研究发现,鞭毛蛋白激活TLR-5,抑制喉鳞癌细胞增殖、促进炎症因子释放、招募免疫细胞,因此TLR-5或许可以成为治疗喉鳞癌的潜在靶点。

