不同演替状态下高寒草甸土壤物理性质与植物根系的相互关系
樊 博,林 丽,*,曹广民,柯 浔,李以康,杜岩功,郭小伟,李 茜,钱大文,兰玉婷,周春丽
1 中国科学院西北高原生物研究所,海北高寒草甸生态系统定位研究站, 西宁 810001 2 中国科学院三江源国家公园研究院, 西宁 810001
高寒嵩草草甸是青藏高原放牧生态系统的主体[1],占青藏高原总面积的33%[2],是中国主要的畜牧基地[3]。自20个世纪90年代以来,在气候变化、人类活动、自然灾害等共同影响下,高寒嵩草草甸发生了不同程度的退化,严重威胁了高原畜牧业的生产及中国乃至亚洲周边地区的生态安全[4-5]。
近些年来,大量研究显示小尺度范围高寒草甸退化的主控因子为过度放牧[6-7],放牧对草场的作用主要包括:采食、践踏和粪尿回归,他们主要是通过改变植物群落的生存策略和土壤理化性质而改变生态系统界面特征。放牧强度加大一般伴随着土壤机械物理性质的改变(如土壤紧实度增大)[8],单位土体气、液和固相比例的改变,单位根系对土壤养分理论分配额度的改变[9],单位土体根土比的改变[10],植物群落生活型的改变(如从根茎型植物逐渐向密丛型植物转化)[6]。土壤紧实度、温度和湿度是生态系统无机环境中同植物生长关系最为密切的物理性质,他们可以通过影响土壤湿度、土壤温度以及土壤结构等直接间接影响土壤微环境及生物化学性质进而影响植物种群生长及群落构型[11- 12]。造成这一现象的原因一般认为是土壤体系(水分、空气和热量等)主要物理性质的改变,使得土壤的水文特征、矿质养分特征(存在形态、转化模式及供给能力)以及单位体积根系获取地面光合产物的分配比例发生了一系列的应激反应,影响了以植物根系为主体、土壤为媒介的植物群落特征及系统稳定性的改变,甚至造成植物群落的演替。而草毡表层是高寒草甸生态系统土壤剖面的特有诊断层,是根系-土壤无机环境作用最为活跃的区域。草毡表层由于根系的高密度导致其诸多特征区别于其他生态系统,那么,以草毡表层为根系生长核心区域的土壤剖面具有怎样的土壤物理特征?植物根系生长是否受制于土壤物理性质(土壤紧实度、水分、温度)的影响?如果两者相关,哪种作用可能是主导作用?为了解决以上问题,本文以放牧型高寒嵩草草甸不同退化演替状态土壤紧实度、土壤温度和湿度为环境因子,探讨土壤对高寒草地植物群落根系生长及垂直空间构型的影响,以期为高寒草地植物群落不同演替状态生态系统构件的互作与耦合关系研究提供数据支撑,为制定合理有效的退化高寒草甸恢复措施提供理论依据。
1 研究方法
1.1 研究区域概况
研究区域位于海北高寒草地生态系统国家观测研究站,属典型的高原大陆性气候,平均海拔为3200 m,年均气温-1.4℃,最冷月(1 月)平均气温为-14.8℃,最热月(7月)平均温度为9.8℃,绝对最低气温可降至-37℃。多年平均降水量523 mm,主要集中于5—9月,占年降水量的80%左右。植物生长季,雨热同期。研究区域草场为冬春草场,隶属于4户牧民。在1995年前,4样地植物群落均为禾草-矮嵩草草甸,整个草场统一使用,植被分布较为均匀;1995年后该草场分给4户牧民,用围栏分割后分别经营,由于各牧户经营策略不同,导致载畜量、畜群组成、放牧时间发生分异,经过近20年的累积效应,使得各围栏内草场地表特征、植物群落组成结构发生明显分异,形成了一个天然的放牧演替梯度,样地概况见表1。
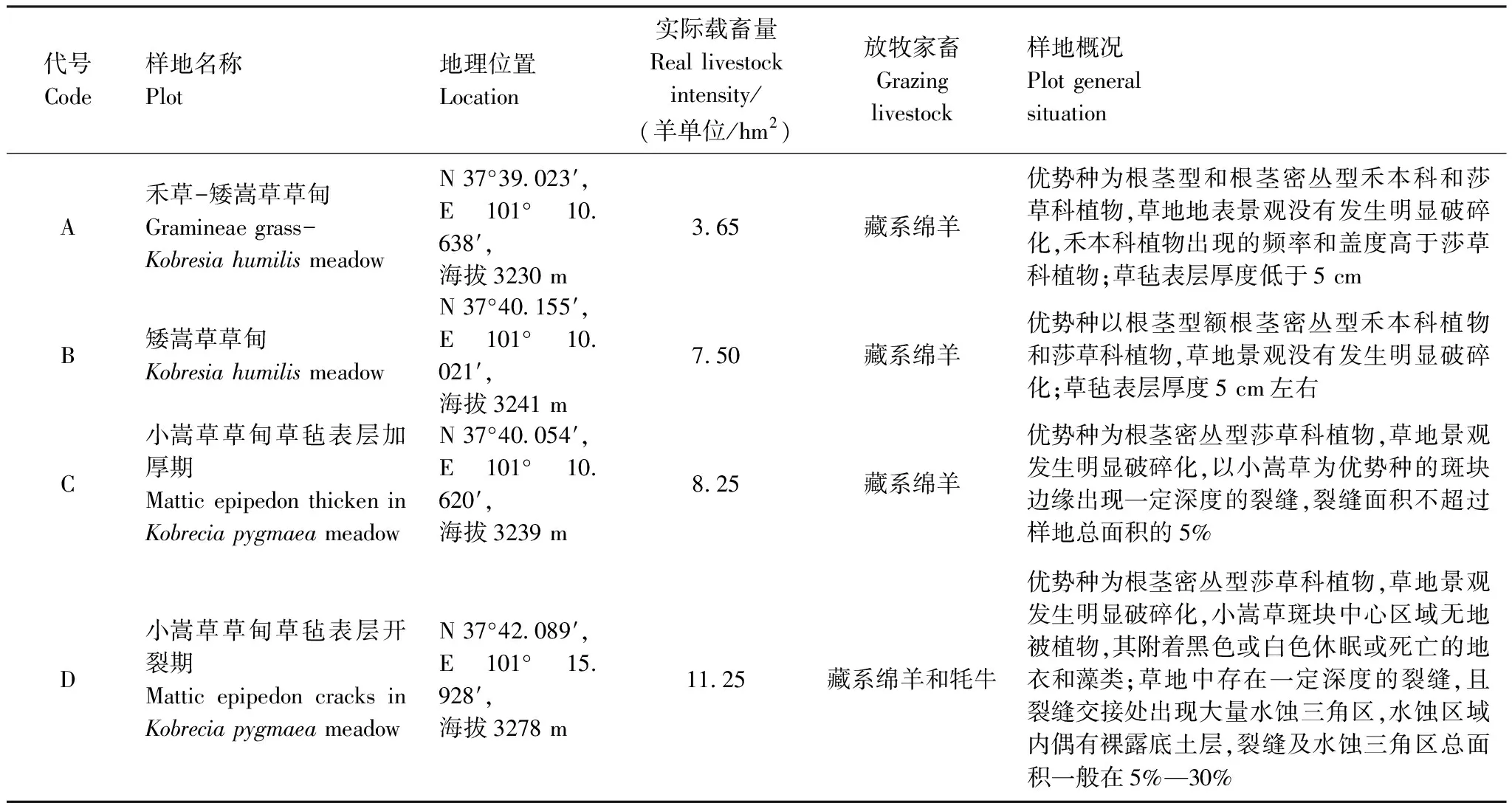
表1 研究样地描述
1.2 土壤及植物根系样品采集与分析方法
土壤样品采集:2017 年采用直径6 cm土钻分层采集(0—5、5—10、10—15、15—20、20—30、30—40 cm),每3钻土壤混合为一个样品。水洗,比重法区分死活根,将死活根分装后60℃ 烘干称重[13]。
土壤紧实度测定采用土壤紧实度仪(SL-TSC),测定探头(型号为BYCX),测定深度为0—5、5—10、10—20、20—30、30—40 cm;土壤温度测定采用土壤紧实度仪温度传感器(型号为HY-WEP),测定深度0—5 cm;土壤湿度测定采用土壤紧实度仪土壤水分传感器(输出信号0—2.5VDC),测定深度为0—5 cm,测定时间为2017年10月中旬。
根系直径测定样品采集时间为2017年10月。高寒草地生态系统植物根系兼有吸收养分和养分储存的功能,对该区域长期物候监测发现10 月中旬的植物群落进入休眠期,植物的根系量达到最大,此时根系量特征不但可以反应植物群落当年养分积累特征,同时对来年植物返青及生态系统自我更新和生长能力意义最大。因此选择在2017年10月中旬采集根系样品植物根系采集采用根钻法(直径=2 cm),每5钻合并为1个重复,每样地3个重复;样品采集后至于清水中将土、根分离,剪除地上植物部分,并将黏连在一起的植物根系用手轻轻撕开,风干24 h后至于植物根系阔叶图像分析系统(WinRHIZO/WinFOLIA Pro LA2400,Regent,加拿大)中测定群落不同直径级别的根系的总长度、直径等变量指标。并采用WinRHIZO分析软件进行数据分析[14- 15]。
1.3 数据分析处理
载畜量调查:通过调查牲畜数量、载畜时间和土地面积获得[16]。相关性分析采用Pearson 相关系数,显著系数为0.05;根系在土体中生长过程中产生的阻力计算公式为W=Σj=1P×V(其中P为土壤紧实度,即物体进入土体过程中承受的压强,V单位土体中的根系体积),数据采用SPSS 19.0软件、R软件(Vegan软件包)、Excel 2007软件进行分析。
2 结果与分析
2.1 不同演替状态群落根系直径结构特征
从各演替状态根系平均直径看(如图1),高寒嵩草草甸根系主要以细根为主,且根系分布具有明显的垂直梯度。高寒嵩草草甸根系直径的主要分布范围为小于0.5 mm,占全剖面根系总长的90.8%—93.6%;其次为直径在0.5—1.0 mm的根系,占全剖面根系总长的4.6%—6.4%;第三为直径为1.0—1.5 mm的根系,占全剖面根系总长的0.8%—1.7%;第四为直径为1.5—2.0 mm根系的根系,占全剖面根系总长的0.6%—1.5%;而大于2 mm的根系极少,占全剖面根系总长的0.4%—0.6%。因此高寒嵩草草甸根系主要以细根系为主,直径为2 mm以下的根系占根系总长度的99%以上;其中0—-0.5 mm细根占总根长的90.8%—93.6%。

图1 不同演替状态植物根系直径分布垂直峰度Fig.1 Plant root diameter distribution in different plant communities succession stagesX轴A、B、C、D代表不同演替状态,A代表禾草-矮嵩草草甸(Gramineae grass-Kobresia humilis meadow)、B代表矮嵩草草甸(Kobresia humilis meadow)、C代表小嵩草草甸草毡表层加厚状态(Mattic epipedon thicken in Kobrecia pygmaea meadow)、D代表小嵩草草甸草毡表层开裂状态(Mattic epipedon cracks in Kobrecia pygmaea meadow)
从不同根系直径在土壤剖面的分布层次上看,粗根系表层分布强度远远高于其他层次,根系越细在整个剖面的分布越分散。大于2 mm的根系主要分布在0—5 cm范围,占全剖面该直径范围根系总长度的81.8%—99.9%;而0—0.5 mm直径范围的根系也主要分布在0—5 cm范围,占全剖面该直径范围根系总长的45.0%—76.9%。
从演替过程看,0—10 cm范围内小于1.0 mm的根系呈增加趋势,大于1.5 mm的根系在不同退化状态之间差异小,甚至不显著(P>0.05)。小于1 mm根系在20 cm以下土层变异程度较小,甚至无显著变异。而大于2 mm根系在5 cm以下变异程度极大,首先,以小嵩草草甸草毡表层加厚状态大于2 mm根系含量最高;其次为矮嵩草草甸状态,而其他各状态差异小甚至无。从不同演替状态下草根的平均直径来说,在不同土壤层次分布状态和强度都存在差异,随着退化程度的加深,土壤根系直径的平均水平呈现一定程度的下降趋势,并且这种趋势在第一级根系(<0.5 mm)和最高级根系(>2 mm)中表现更为突出,而中间层次土壤中直径变化具有一定互补作用。高寒嵩草草甸根系直径平均水平在同一演替状态之间也存在较为明显的V”字形规律,且在未退化草地如禾草-矮嵩草草甸这种根系平均直径随土层的加深,呈先减少后增大的规律更为明显,而其他退化演替状态,则表层(0—5 cm)土层中根系的平均直径则远远高于其他层次,而底层(30—40 cm)土层根系的平均直径则略高于5—30 cm层次或差异不显著。
2.2 不同演替状态群落根系总长度特征
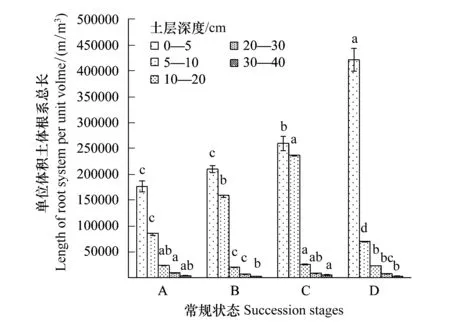
图2 单位土体根系总长Fig. 2 Total length of unit roots in 0—40 cm soil lays
由放牧引起的高寒嵩草草甸的模式退化演替系列可以划分成7个演替状态,而我们研究的四个演替状态是该演替模式系列中的4个演替状态,该演替状态下的土壤中总根系的长度变化趋势在不同退化演替状态的相同土壤层次表现为逐渐增高的趋势。从不同退化演替状态看,随着退化程度的加深,草甸土层中的总根长呈现逐渐增加的趋势,且表层表现最为明显。小嵩草草甸草毡表层开裂期较为特殊,其根系主要分布在表层0—5 cm范围内,较其他演替状态其根系总长度在该层次中更为集中,导致其5—40 cm范围内根系总根长较其他演替状态略小或没有变化(退化演替层度增高导致根系表层化分布),最低值出现在未退化的禾草-矮嵩草草甸状态,最大值出现在小嵩草草甸草毡表层开裂状态。
从土壤根系分布的垂直结构看(图2),单位土体中根系总长度随土层的加深呈现降低趋势,0—5 cm范围内分布了全土层48%—80%的根长,而全土层90%以上的根长全部分布在0—10 cm范围内。
2.3 不同演替状态群落根系总表面积特征
从不同演替状态植物根系的总表面积和总体积上看(图3、图4),随着退化程度加深,根系总表面积呈现逐渐上升趋势,且这种趋势在表层0—5 cm范围土层更为明显。禾草-矮嵩草草甸、矮嵩草草甸和小嵩草草甸草毡表层加厚状态,0—5 cm土层和5—10 cm土层根系表面积和体积之比都是呈现降低趋势,说明随着退化程度加深,表层(0—5 cm)根系单位体积的根吸收土壤养分的能力呈下降趋势,而体积增加趋于平衡,但是根系表面积增加速率高于根系体积增加速率,说明根系在单位土体的容量逐渐趋于饱和,而植物根系以降低根系的直径,增加根系的表面积来客观增加根系对养分、水分等的吸收能力。
小嵩草草甸草毡表层开裂期较为特殊,其0—5 cm范围内的根系总表面积和体积最高的,但是5 cm以下根系体积和表面积表现为较低状态,说明此状态根系生长的主要界面为表层0—5 cm,也客观的暗示植物根系总的生产能力很可能有限。
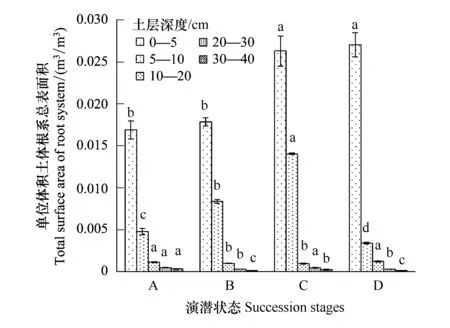
图3 单位体积根系总表面积Fig.3 Total root surface area per m3
图4 单位体积根系总体积Fig.4 Total root volume per m3
2.4 不同演替状态土壤紧实度分层特征
从土壤根系主要分布层累计机械阻力来看(图5),自表层向下40 cm土体范围内,总机械阻力呈现逐渐增高的趋势,其中禾草-矮嵩草草甸土壤全剖面土壤紧实度最低,显著低于矮嵩草草甸和小嵩草草甸的两种演替状态。而从矮嵩草草甸开始,其总体的土壤紧实度之间差异不明显。
从植物根系生长过程中需要抵抗土壤机械阻力而消耗能量来看(图6),植物在禾草-矮嵩草草甸状态和矮嵩草草甸状态用于抵御土壤根系阻力而消耗能量较小,累计平均量在1000 J以下;而在小嵩草草甸的两种演替状态中,其消耗的能量较大,一般在900 J以上。此外,小嵩草草甸草毡表层较厚和开裂状态,植物根系生长的机械阻力空间变异性很大,其变异系数在48.0%—55.0%;而禾草-矮嵩草草甸其根系生长的机械阻力在整个空间的变异一般在7.0%—9.0%之间,远小于小嵩草草甸的各个演替状态。
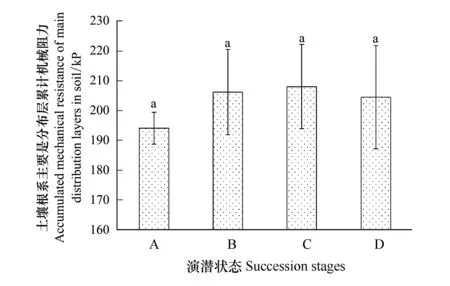
图5 土壤紧实度分层特征Fig.5 Soil compaction stratification
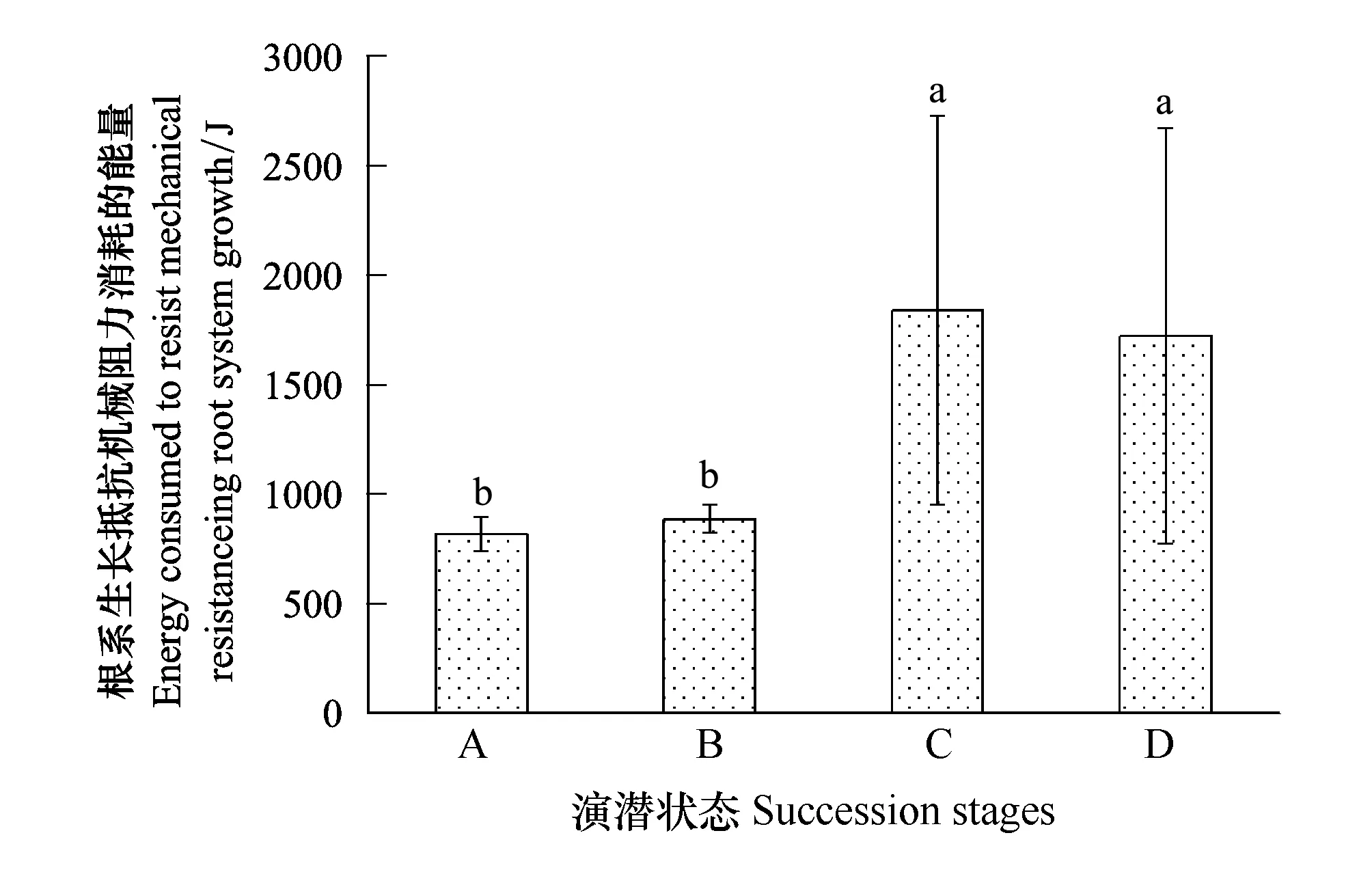
图6 根系生长抵抗机械阻力消耗的能量 Fig.6 Energy consumed to resist mechanical resistanceing root system growth
2.5 不同演替状态土壤紧实度、湿度和温度同植物根系生长耦合分析
从表2中可以看出,土壤紧实度对根系生长的影响具有双重作用。表层土壤紧实度增高可以明显增高中层土壤(10—20 cm)中0.5 mm以下根系量。而中层土壤(10—20 cm)的土壤紧实度与0.5 mm、1.5 mm直径根系的含量呈显著正相关关系,与大于2 mm根系含量呈显著负相关关系。20 cm以下底层土壤紧实度与0—5 cm表层的1 mm直径根系量呈现正相关关系,与20 cm以下的底层土壤中大于1 mm直径根系量呈负相关关系。也就是,土壤紧实度增高与植物根系直径细化、分布层次具有较为明显的相关性。草毡表层(0—5 cm)土壤中紧实度增高没有明显抑制粗根系植物生长,10—20 cm土壤对> 2mm根系具有明显的抑制作用,20 cm以下土壤紧实度增高对> 0.5 mm根系的生长均具有显著的抑制作用。
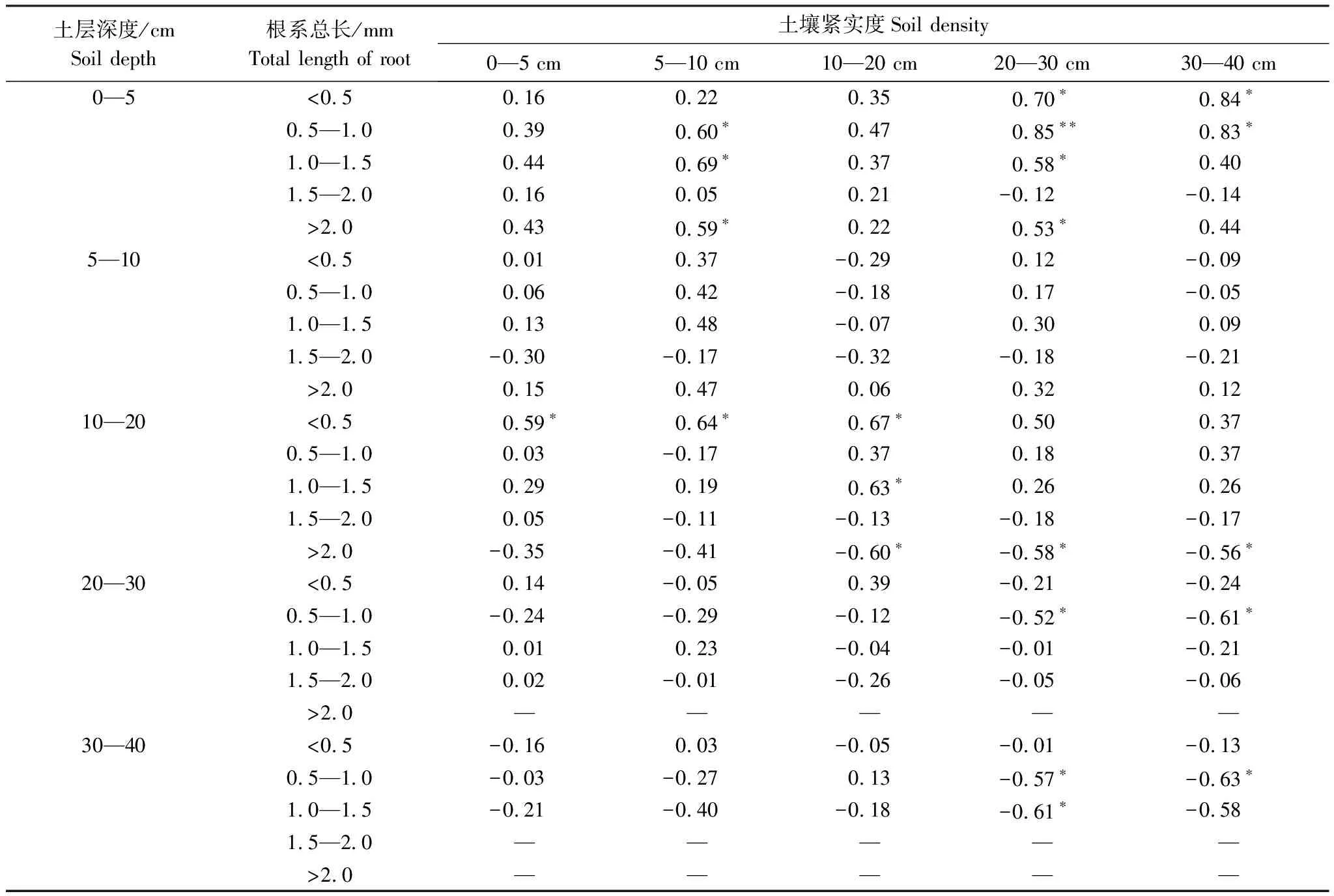
表2 土壤紧实度与根系生长之间的Pearson相关分析
“*”表示显著相关(P<0.05),“**”表示极显著相关(P<0.01)
从表3可以看出,土壤湿度同1.0—1.5 mm范围直径根系长度之间具有显著的强正相关关系(ɑ=0.05),相关系数为0.98,同其他直径范围根系长度之间没有显著的相关关系。土壤温度同<0.5mm范围内根系长度具有显著的强负相关关系(ɑ=0.05),相关系数为-0.97,而同其他直径范围内根系长度之间没有显著的相关关系(ɑ>0.05)。
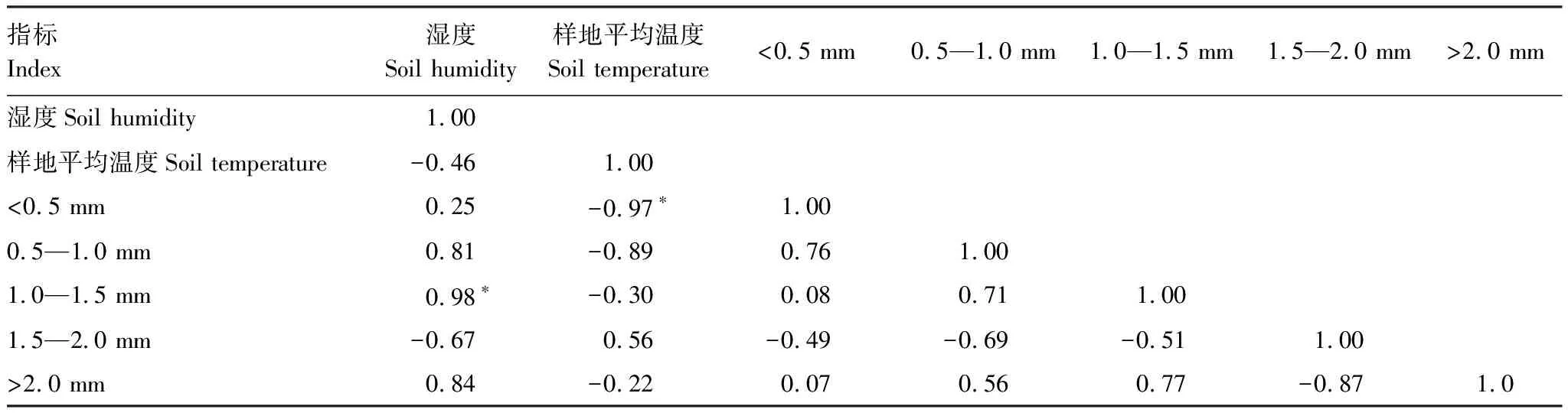
表3 土壤0—5 cm范围温度和湿度与表层根系生长之间的Pearson相关分析
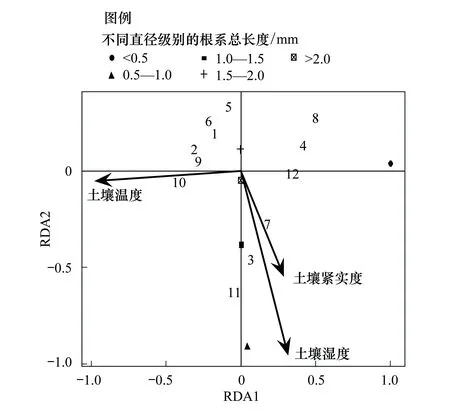
图7 土壤环境因子同根系长度RDA分析 Fig.7 RDA analysis of soil environmental factors and underground root length
如图7,表层土壤紧实度、土壤温度和土壤含水量可以解释总样方变异度的75.1%。其中,第一轴同土壤温度负相关性最高,可以解释总变异的75.0%;第二轴同土壤湿度负相关性最高,可以解释总变量的0.1%;第三轴同土壤紧实度负相关性最高,可以解释总变量的变异不足0.004%。土壤温度同第一轴的相关系数达到-0.9648,土壤湿度同第二轴的相关系数达到-0.9492,土壤紧实度同第三轴的相关系数达到-0.7955。从植物根系总长度的角度来看,第一轴同土壤中小于0.5 mm直径根长度关系最为密切,且小于0.5 mm直径长度几乎可以解释整个剖面直径的变异;第二轴同0.5—1.0 mm根系具有较大负相关性,可以解释总变异的1.5%,第三轴同1.5—2.0 mm根系长度具有较大负相关性,相关系数为-0.1276,可以解释总变异的可以解释总变量的0.24%。表明高寒嵩草草甸植物群落地下生物量的形成与小于0.5 mm植物根系具有较为明显的相关关系,且低温是形成植物根系直径较小,根量较多的主要原因。
3 讨论
高寒嵩草草甸植物群落根系细小且数量繁多,具有明显的表聚现象,草地表层紧实度高。植物的根系是植物体的六大器官之一,是生态系统地上与地下界面关联的枢纽,是土壤资源的直接利用者和植物生产量的重要贡献者。根系的空间分布特征决定了植被与土壤环境之间作用面积的大小,同时根系分布特征及其与土壤环境之间的复杂关系对植被地上部分的生长有着重要的影响[17]。高寒嵩草草甸庞大数量细根表聚现象很可能是植物群落对高寒低温环境的适应性调节[18]。首先高寒嵩草草甸地处环境恶劣,生长季节短暂,寒冷季漫长,其根系生长和功能的发挥主要集中在一个热量多变的活动层中,以环境因子对根系分布影响能力的贡献率发现,土壤温度与植物细根长度具有显著负相关性,理论认为,大于零度的积温有助于于启动草地植物根系生长,并未为根系所处环境中微生物的活动、速效养分的供给等提供环境支撑。大量研究表明,高寒嵩草草甸生态系统普遍具有全量养分丰富而速效养分匮乏的特征[19],因此,能够在较短的植物生长周期内迅速的获取养分,完成一个生命周期是高寒草甸植物种群在群落中生存和发展的基础[20]。
高寒嵩草草甸土壤以<2 mm根系为主,其中<0.5 mm的细根占90%左右。细根的增多,一方面可以增加植物对养分的吸收面积;另一方面一定数量的细根根系生长可以形成通道,加大土体的通气透水能力,改善土壤结构,有利于植物生长。典型高寒草甸根系主要分布于表层(如草毡表层或0—10 cm的浅层土壤),根量密度随深度增加而急剧减少[21],说明植物根系生长更多是利用土壤表层的水分和养分,而高寒草甸根系的侧向生长,增加了根系的分枝,也为植株利用水分、养分提供了基础。由于活动层的土层深度越深土壤环境条件越极端,而极端的土壤环境变化会导致根系的死亡[22- 23]。植物根系的短暂生长期更限制了根系的伸长生长和径向生长,进一步增大了土壤中细根的比例。
从退化演替过程来看,过度放牧的一个重要作用是通过改变土壤紧实度而对不同直径的根系产生不同程度的影响。首先放牧强度增大会客观增加植物群落中细根数量,尤其是增加草毡表层范围内直径小于0.5 mm根系的长度,而降低直径较大的根系(1.5—2.0 mm)长度。从植物群落根系的生长特征来看,以往研究发现高寒嵩草草甸植物群落的地上生物量是随着退化程度加深而呈现一定程度降低,这一方面是由于植物被过度的采食而导致地上生物量减少,同时也反映了植物群落通过生活型改变而增加了根冠比,植物根系不仅仅是养分吸收的器官,更是养分储存的器官,高寒嵩草草甸生态系统是一个温度限制型生态系统。土体环境变化是高寒嵩草草甸生态系统变化的源动力,其首要作用点为高寒植物地下根系[24- 26],高寒草地生态系统根系兼有营养和存储两种功能,根系储存的养分来源于冷季来临前,而这些养分也将成为翌年返青植物生长最重要的养分源泉,且高寒嵩草草甸的优势种(矮嵩草和小嵩草)养分的再利用能力可以超过60%,但是在植物系统受到放牧采食和践踏作用下,改变了植物群落在地表的群聚程度,以及土体中的水、土和气三相格局,客观上影响了植物-土壤复合体的环境条件,水分和养分的亏缺已经成为限制植物生长最重要的因子之一[27]。植物生活型的改变,一方面是应对家畜的采食和践踏,同时也是放牧采食干扰过后的劫余种,具有良好的根系生长能力,以最大限度的为植物生长提供相对多的养分,也是为保证能在高放牧强度条件下生存。另一方面,由于光合产物主要分配到地下的,导致地上植物量少,有效光合作用器官少,加之根系大量滋生加速了土壤中有效养分、水分及空气的利用的限制,最终导致了高寒嵩草草甸单株根系径向拓展受限,形成较粗根系(如1.5—2.0 mm根系)总根长随着放牧强度增大而减少的格局。此外,植被群落演替(植物群落组成结构、植物生活型结构的变化)等因素亦可造成根系直径的组成结构的变化,但植物群落在受胁迫条件下对根系的寿命的影响是否会直接或间接导致土壤根系的细化,还有待于进一步研究。
高寒草地生态系统植物根系垂直结构分布构型是根系对环境条件适应的综合体现。从根系分布格局上看,根系分布确实同土壤环境因子关系密切,尤其是土壤温度关系最为密切,而同土壤温度关系最为密切的是直径小于0.5 mm的根系,低温环境容易造成土壤根系的细化,从土壤紧实度分布层次与根系直径分布长度的相关关系分析中发现,深层次土壤紧实度增加是阻碍0—20 cm土壤中细根往深层土壤扩展的主要因素。土壤紧实度的增加与根系直径的减小呈正相关性,说明放牧很可能是通过增加土壤紧实度进而改变植物群落根系构型,甚至植物群落成员型。高寒草甸生态系统是青藏高原畜牧业主体,是当地农牧民的生产生活的物质基础,是维系亚洲乃至周边地区的生态安全的基石。近年来,高寒嵩草草甸大范围的退化的原因,许多专家学者归因为气候变化和人类活动共同作用,而海北高寒嵩草草甸的长期定位监测发现,相对于气候变化,人类活动对小尺度范围的草地退化的影响更为剧烈[28- 29]。草地退化是一个生态系统构件协同演化的过程,短期的气候波动有可能引起植物群落的应激性反应,而如果将气候变化叠加到一个相对较长的时间尺度上,这种演变将可能导致植物群落的生态驯化,这可以认为是草地生态系统对环境变化的生态适应和缓冲,而这种改变会体现在生态系统的诸多方面。
从造成根系紧实度增高的原因上看,在相关环境条件下,人类活动是造成高寒草甸退化演替的主控因子,而放牧行为是人类作用于高寒草甸最为持久、最为深远的人类活动。放牧对草地影响主要有3种,分别是采食、践踏和粪尿回归,前两者对草地的影响主要集中在家畜通过对群落中植物选择性采食改变了植物群落的成员型和生活型,导致植物群落从疏丛型植物向密丛型植被转化,客观上改变了植物群落的根土比、根系构型以及植物群落所处环境的物理化学结构,最终导致植物群落的退化演替;而家畜过度践踏将增加土壤紧实度,进而改变植物群落的垂直空间分布格局,因此,土壤物理化学性质的改变同植物根系构型的改变是一个互反馈过程,其外部驱动因子就是放牧强度的改变。
4 结论
高寒嵩草草甸植物群落演变是一个系统演化的过程,高寒嵩草草甸放牧强度加大可能造成植物根系的表聚现象的重要原因,且这种根系的表聚程度可以通过增大放牧强度而增大。
土壤温度与高寒草甸根系直径构型具有较强且显著的负相关关系,因此,高寒草甸植物根系生长构型的形成的一个主控因子有可能为温度;同时,高寒嵩草草甸根系主要以细根为主,且根系分布具有明显垂直梯度。土壤紧实度增高加大了植物群落中细根的比例及根系空间分布格局。

