淋巴瘤合并感染患者中TH1/TH2细胞因子和淋巴细胞亚群的变化
温珍珍,李铭杰,刘亚楠,王宏,关则兵,潘学谊
(广东药科大学附属第一医院血液科,广东 广州 510080)
恶性淋巴瘤是淋巴结和结外部位淋巴组织的免疫细胞肿瘤,来源于淋巴细胞或组织细胞的恶变[1]。恶性淋巴瘤患者由于机体免疫功能低下,加之化疗、放疗、免疫抑制剂等治疗后又会加剧这一功能的损伤,进而容易引发感染,感染将进一步中断或延长治疗进程,严重者甚至可能会影响其预后。因此早期、快速地诊断出感染对临床治疗尤其重要。已有相关文献[2-4]报道了TH1/TH2细胞因子或淋巴亚群在血液肿瘤治疗方面的重要作用,但是在淋巴瘤合并感染中,TH1/TH2细胞因子或淋巴细胞亚群的表达水平研究较少。为了揭示不同的指标与淋巴瘤合并感染的关系,为是否合并感染的诊断及抗感染治疗的疗效进行评估,本研究通过流式细胞技术,探讨TH1/TH2细胞因子、淋巴细胞亚群等与淋巴瘤合并感染的关系。
1 资料与方法
1.1 临床资料
选取2018年4月至2019年4月在广东药科大学附属第一医院血液科诊治的淋巴瘤合并感染的121例患者为研究对象(感染组),其中男69例,女52例,年龄17~78岁,中位年龄44岁;同期94例单纯淋巴瘤患者为对照组,其中男50例,女44例,年龄19~78岁,中位年龄47岁。恶性淋巴瘤均经临床及病理共同确诊[5],无肝功能、肾功能和心血管疾病等异常。感染组根据临床及病原体诊断为细菌感染患者76例,其中革兰阳性菌(G+)组29例,革兰阴性菌(G-)组47例;非细菌感染组45例,其中病毒感染32例,真菌感染13例。
1.2 标本采集与检测
两组患者均于抗感染治疗前、感染组于抗感染治疗7 d后,清晨空腹抽取外周静脉血,检测TH1/TH2细胞因子水平及T淋巴细胞亚群分布情况。检测方法:淋巴细胞亚群(CD3+、CD4+、CD8+、CD19+、CD4/CD8、NK细胞CD16/56+)应用流式细胞仪抗体双标法检测,TH1/TH2细胞因子[白介素(interleukin,IL)-2(IL-2)、IL-4、IL-6、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和干扰素-γ(interferon-γ,INF-γ)]应用流式微球阵列技术进行定量分析。
1.3 统计学分析
采用SPSS20.0软件进行统计学分析。各组数据经检验均为非正态性分布,用中位数[M(P2.5-P97.5)]描述计量资料,用Kruskal-Wallis检验(H检验)和秩和检验分析各组数据间的差异,以P<0.05为差异具统计学意义。
2 结果
2.1 两组TH1/TH2细胞因子表达水平比较
H检验结果显示,抗感染治疗前,感染组TH1/TH2细胞因子表达水平高于对照组(P<0.05,P<0.01);感染组内不同感染两两比较,细菌感染者IL-6、IL-10、INF-γ、TNF-α表达水平高于病毒感染、真菌感染者(P<0.05,P<0.01),G+菌感染者IL-6、IL-10表达水平高于G-菌感染者(P<0.05,P<0.01),其余指标比较,差异无统计学意义(P>0.05)。见表1。
2.2 两组T淋巴细胞亚群分布情况比较
H检验结果显示,抗感染治疗前,与对照组相比,感染组CD3+、CD4+、CD4/CD8、CD16/56+偏低,CD8+、CD19+偏高(P<0.05,P<0.01);感染组内两两比较,各指标差异无统计学意义(P>0.05)。见表2。
2.3 感染组抗感染治疗前后TH1/TH2细胞因子表达水平比较
秩和检验结果显示,感染组治疗7 d后,IL-2、TNF-α表达水平与治疗前比较差异无统计学意义(P>0.05),IL-4、IL-6、IL-10、INF-γ表达水平则低于治疗前(P<0.05,P<0.01)。见表3。
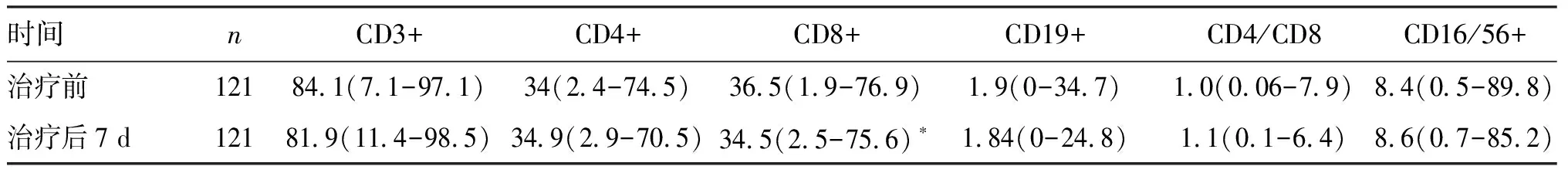
2.4 感染组抗感染治疗前后T淋巴细胞亚群分布情况比较
秩和检验结果显示,感染组治疗7 d后,CD3+、CD4+、CD19+、CD4/CD8、CD16/56+与治疗前比较差异无统计学意义(P>0.05),CD8+则下降(P<0.05),见表4。
表1 两组TH1/TH2细胞因子表达水平比较
Table1Comparison of TH1/TH2 cytokine expression between the two groups [M(P2.5-P97.5)]

ρ/(pg·mL-1)
与感染组比较:*P<0.05,**P<0.01; 与细菌感染组比较:##P<0.05; 与G-细菌感染组比较:ΔP<0.05,ΔΔP<0.01。
表2 两组T淋巴细胞亚群分布情况比较
Table2Comparison of distribution of T lymphocyte subsets between the two groups [M(P2.5-P97.5)] %

组别nCD3+CD4+CD8+CD19+CD4/CD8CD16/56+对照组9485.5(34.3-98.8)∗39.7∗(6-82.4)35.2(7.8-76.8)∗∗0.1(0-29.8)∗∗1.1(0.1-9.5)∗10.8(0.01-42.1)∗感染组 细菌感染 G-4774.75(5.7-97.1)35.26(1.4-74.5)75.29(1.9-76.9)6.89(0-76.7)0.37(0.06-7.9)6.23(0.5-93.6)G+2968.35(10.6-82.9)24.78(3.5-48.3)77.85(5.4-41.5)25.54(0.1-81.7)0.49(0.4-1.4)3.08(2.8-37.3) 病毒感染3279.56(77.3-95.5)37.33(28.6-52.2)46.07(38.8-62.3)2.53(0.1-7.4)0.85(0.46-1.3)7.69(1.1-23.4) 真菌感染1376.75(81.6-93.8)33.7(13.8-63.6)37.48(23.3-67.5)4.19(0.01-6.9)0.75(0.2-2.4)8.15(0.9-15.8)
与感染组比较:*P<0.05,**P<0.01。
表3 感染组抗感染治疗前后的TH1/TH2细胞因子表达水平比较
Table3Comparison of TH1 / TH2 cytokine expression levels before and after anti-infective treatment in infected group [M(P2.5-P97.5)]

ρ/(pg·mL-1)
与抗感染治疗前比较:*P<0.05,**P<0.01。
表4 感染组抗感染治疗前后的T淋巴细胞亚群分布情况比较
Table4Comparison of expression levels ofT lymphocyte subsets in the infection group before and after anti-infective treatment [M(P2.5-P97.5)]
%
与抗感染治疗前比较:*P<0.05。
3 讨论
恶性淋巴瘤是血液系统常见的恶性肿瘤之一,由于化疗、放疗、免疫抑制剂等治疗,患者多存在机体免疫功能的异常,即细胞免疫功能处于免疫抑制状态,机体的识别和杀伤突变细胞的能力下降,进而容易感染。众所周知,炎症和感染可促进和/或加重癌症。目前诊断感染的金标准仍然是需要找到病原学依据,但是其耗费时间长,不利于临床早期诊断和治疗,因此主要通过一些感染标志物,诸如C反应蛋白(CRP)、降钙素原(PCT)等,对有无感染及抗生素治疗的疗效进行评估,但CRP、PCT在诊断感染中具有一定的局限性。比如不能特异性区分细菌感染与自身免疫性疾病和某些血液学恶性肿瘤,给临床应用带来了一定的干扰[6-7]。
辅助性T细胞(thelper,TH)对机体免疫系统有着重要的调节作用,在不同抗原刺激下TH可分成TH1与TH2两个亚群。其能通过产生促炎性细胞因子,不仅能促进效应T细胞增殖、分化、活化在初次免疫应答中发挥抗感染作用,还能促进记忆细胞的产生,在再次感染时更高效的清除病原体感染。T细胞亚群不仅具有有效的抗肿瘤作用,还可通过T细胞介导细胞免疫,因此它与肿瘤患者的免疫状况也密切相关。本研究基于流式细胞术(FCM)检测外周血TH1/TH2细胞因子、淋巴细胞亚群,该技术具有高通量、快速、重复性好的优点,适合临床分析。Tang等[8]研究发现与正常人相比,感染患者中的IL-6和IL-10明显升高,G+细菌感染中IL-6升高2~10倍以上,G-细菌感染中IL-6及IL-10均升高10倍以上,并且可以鉴别G-或G+细菌感染,本研究显示,感染组TH1/TH2细胞因子表达水平高于对照组(P<0.05,P<0.01)。感染组内不同病原体感染比较,细菌感染者IL-6、IL-10、INF-γ、TNF-α表达水平高于病毒感染、真菌感染者(P<0.05,P<0.01),G+菌感染者的IL-6、IL-10表达水平高于G-菌感染者(P<0.05,P<0.01),其余指标比较差异无统计学意义(P>0.05)。这一研究结果与Tang等学者的结果一致。IFN-γ主要由TH1细胞和自然杀伤(natural killer,NK) 细胞产生,它可以诱导组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类分子的表达,MHCⅡ类分子可以提呈病原体的抗原,促进CD4+T细胞识别感染细胞,进而激发免疫应答[9-10]。本研究中,感染组IL-6、INF-γ表达水平显著升高,可能原因为恶性淋巴瘤本身是免疫细胞肿瘤,免疫细胞发生异常的增殖使得患者免疫系统处于一种高反应状态,进而激发免疫应答;升高的IL-6、INF-γ也可能促使炎症反应持续发生。研究还发现,使用抗感染方案治疗后,IL-4、IL-6、IL-10、INF-γ表达水平低于治疗前(P<0.05,P<0.01),其余指标则无明显差异(P>0.05),说明血清IFN-γ及IL-6的表达水平可能与淋巴瘤患者是否合并感染有关,可以进一步指导制定抗感染治疗方案。
恶性淋巴瘤患者多存在机体免疫功能的异常,即细胞免疫功能处于免疫抑制状态,机体对识别和杀伤突变细胞的能力下降,而作为细胞免疫最重要的T淋巴细胞能够通过功能各异的T淋巴细胞亚群来发挥免疫调控作用[11]。根据淋巴细胞在免疫应答过程中的功能可以将其分为T淋巴细胞、B 淋巴细胞和自然杀伤细胞(NK细胞)[12-14]。严健等[5]的研究发现,肿瘤患者常伴有外周血T淋巴细胞亚群的变化,主要原因在于当机体出现恶性肿瘤时,由于肿瘤分泌某些因子,使得CD3+细胞、CD4+细胞(辅助/诱导T淋巴细胞)、CD8+细胞计数出现偏差,导致机体免疫反应紊乱。此外,CD8+属于抑制/毒杀T淋巴细胞,在免疫反应中能够直接杀伤性细胞,CD8+细胞愈高,免疫抑制愈强,患者机体抵抗力愈弱。CD4+/CD8+比值以判断人体免疫功能紊乱的临床诊断敏感指标。CD19+是指人体淋巴免疫系统中的免疫因子,其值增高说明机体出现病变,免疫系统自动作出的免疫反应,当其值降低时,说明机体的免疫力低下。NK细胞(CD16/56+)是肿瘤标志物的一种,如升高提示有病变。本研究发现,与对照组相比,感染组CD3+、CD4+、CD4/CD8、CD16/56+分布降低,CD8+、CD19+分布升高(P<0.05,P<0.01)。经过抗感染治疗7天后,CD8+分布降低(P<0.05),其余指标无明显变化(P>0.05)。这一结果表明淋巴瘤合并感染时,患者的免疫功能下降,经过抗感染治疗能改善患者的免疫功能。可能的原因是淋巴瘤合并感染时CD8+细胞的抑制功能受损,不能抑制CD4+细胞活化B细胞且产生许多自身抗体,表现出体液免疫的过度亢进,使得CD8+细胞反馈性的增多。研究发现这一现象在淋巴瘤合并感染的患者中表现更为明显。淋巴瘤合并感染时,NK细胞数量明显减少,NK细胞对抗体的产生具有多向调节作用,NK细胞数量减少减弱了T淋巴细胞、B淋巴细胞的免疫调节作用,导致多种自身抗体的产生[15-17]。经抗感染治疗后,CD8+细胞分布降低,这也暗示着患者的抵抗力加强[18-19]。因此检测淋巴瘤合并感染患者淋巴细胞亚群数量可以了解患者整体免疫状态。
综上所述,TH1/TH2细胞因子和淋巴细胞亚群在淋巴瘤、淋巴瘤合并感染患者中,具有一定的差异性,对淋巴瘤患者是否合并感染及感染的治疗效果具有一定的鉴别价值。

