儿茶素对肌原纤维蛋白氧化、结构及凝胶特性的影响
贾娜 金伯阳 刘丹 孙嘉 刘登勇


摘 要:采用羥自由基氧化体系(10 μmol/L FeCl3、100 μmol/L VC和1 mmol/L H2O2)研究不同添加量儿茶素(10、50、100、150 μmol/g)对肌原纤维蛋白氧化、结构及凝胶特性的影响,同时以未氧化和氧化后未添加儿茶素(0 μmol/g)肌原纤维蛋白作为对照组,对肌原纤维蛋白羰基含量、总巯基含量、表面疏水性、溶解度、粒径分布、凝胶强度、凝胶保水性及肌原纤维蛋白流变特性进行测定,并观察凝胶微观结构。结果表明:添加儿茶素能减少羰基化合物的产生,但添加量过高会促进肌原纤维蛋白氧化;与未氧化和未添加儿茶素组相比,添加儿茶素降低了肌原纤维蛋白表面疏水性;随着儿茶素添加量增加,肌原纤维蛋白巯基含量逐渐降低,溶解度显著降低,粒径逐渐增大,凝胶强度和保水性逐渐下降,凝胶微观结构更加疏松多孔,蛋白胶束聚集,中、高添加量(50、100、150 μmol/g)儿茶素使得肌原纤维蛋白失去典型的流变曲线。中、高添加量儿茶素与肌原纤维蛋白发生共价交联,并导致肌原纤维蛋白发生疏水性聚集,最终削弱了肌原纤维蛋白的凝胶特性。
关键词:儿茶素;肌原纤维蛋白;氧化;结构;凝胶特性
Effect of Catechin on the Oxidation, Structure and Gel Properties of Myofibrillar Protein
JIA Na, JIN Boyang, LIU Dan, SUN Jia, LIU Dengyong*
(National and Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for
Fresh Agricultural and Aquatic Products, Food Safety Key Laboratory of Liaoning Province, College of Food and Technology,
Bohai University, Jinzhou 121013, China)
Abstract: The effects of different concentrations of catechin (10, 50, 100 and 150 μmol/g proteins) on the oxidation, structure and gel properties of myofibrillar proteins were studied. Oxidation was carried out in a hydroxyl radical oxidation system (10 μmol/L FeCl3, 100 μmol/L VC and 1 mmol/L H2O2). Non-oxidized and oxidized myofibrillar proteins without added catechin were used as control groups. The carbonyl content, total sulfhydryl content, surface hydrophobicity, solubility, particle size distribution, gel strength, water holding capacity and rheological properties of all samples were determined, and the microstructure of heat-induced protein gel was observed. The results showed that catechin could reduce the production of carbonyl compounds, but at high concentration promote the oxidation of myofibrillar proteins. Compared with the control groups, catechin decreased the surface hydrophobicity. With increased concentration of catechin, the sulfhydryl content decreased gradually, the solubility declined significantly, the particle size increased and the gel strength and water-holding capacity fell gradually. The gel microstructure became more loose and porous and the protein micelles were aggregated. Medium and high concentrations of catechin (50, 100 and 150 μmol/g) caused the protein to lose its typical rheological behavior. In conclusion, high and medium concentrations of catechin could covalently cross-link with myofibrillar proteins and cause the hydrophobic aggregation, ultimately weakening the gel properties of myofibrillar proteins.
Keywords: catechin; myofibrillar protein; oxidation; structure; gel properties
DOI:10.7506/rlyj1001-8123-20200220-043
中图分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2020)04-0013-07
引文格式:
賈娜, 金伯阳, 刘丹, 等. 儿茶素对肌原纤维蛋白氧化、结构及凝胶特性的影响[J]. 肉类研究, 2020, 34(4): 13-19. DOI:10.7506/rlyj1001-8123-20200220-043. http://www.rlyj.net.cn
JIA Na, JIN Boyang, LIU Dan, et al. Effect of catechin on the oxidation, structure and gel properties of myofibrillar protein[J]. Meat Research, 2020, 34(4): 13-19. DOI:10.7506/rlyj1001-8123-20200220-043. http://www.rlyj.net.cn
蛋白质发生氧化不仅会破坏蛋白质的结构,还会导致蛋白质的功能性质发生改变,从而导致产品质地、色泽等发生改变[1]。利用植物多酚能有效抑制肉及肉制品的脂肪和蛋白质氧化。研究表明,在猪肉糜中加入迷迭香精油能有效减少巯基的损失,抑制蛋白质氧化[2]。Ganh?o等[3]发现,大部分水果提取物能抑制羰基化合物的生成,降低猪肉糜蛋白氧化程度。Estévez等[4]对植物多酚抑制蛋白质氧化的效果进行研究,发现低添加量多酚能够抑制蛋白质氧化过程中羰基的形成。
多酚能够清除自由基,降低蛋白质氧化程度,但近年来很多研究发现,多酚类物质在起到抑制肉制品氧化作用的同时还能与蛋白质发生共价或非共价相互作用,从而对蛋白质结构产生影响,进而导致蛋白质功能特性发生改变,尤其是凝胶特性,其对蛋白质功能特性的影响与多酚添加量有关。没食子酸能够抑制肌原纤维蛋白乳液中脂肪和蛋白质的氧化,但却能够促进巯基和氨基的损失,破坏蛋白质三级结构,导致蛋白质发生聚集和交联,高添加量没食子酸(150 μmol/g)导致蛋白质凝胶结构破坏,凝胶强度和保水性显著下降,但低、中添加量没食子酸(6、30 μmol/g)对蛋白质凝胶强度和保水性影响不
大[5]。多酚与蛋白质之间的非共价键结合也可以导致蛋白质的溶解度降低[6]。绿原酸导致肌原纤维蛋白巯基和氨基损失程度增加,二级结构和三级结构发生改变,表面疏水性增加,溶解度降低,高添加量绿原酸(150 μmol/g)破坏蛋白质凝胶结构,蛋白质凝胶特性变差[7]。
儿茶素是从绿茶中提取的一种功能因子,作为茶多酚中主要的黄烷醇类成分具有很强的抗氧化能力。能够形成热诱导凝胶是肌原纤维蛋白的主要特性之一,因此,本研究以儿茶素作为抗氧化剂,采用Fenton反应体系制备肌原纤维蛋白氧化模型,对蛋白质氧化程度、结构、凝胶特性及流变特性等进行测定,研究儿茶素引起的蛋白质结构变化与凝胶特性变化之间的关系,为探究多酚对肌肉蛋白功能特性及凝胶类肉制品的影响提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜猪背最长肌 当地超市。
儿茶素 阿拉丁试剂有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazone,DNPH)、5,5-二硫代双-(2-硝基苯甲酸)(5,5-dithiobis-(2-nitrobenzoic acid),DTNB) 北京索莱宝科技有限公司;氯化钠、三氯化铁、乙二胺四乙酸二钠、过氧化氢、冰乙酸、溴酚蓝、β-巯基乙醇、VC、磷酸氢二钠、磷酸二氢钠、三氯乙酸(均为分析纯) 锦州药业(集团)器化玻有限公司。
1.2 仪器与设备
BT-9300 ST激光粒度分布仪 丹东市百特仪器有限公司;Allegra 64R冷冻离心机 美国Beckman公司;T25数显型均质机 德国IKA集团;UV-2550紫外-可见分光光度计 日本Shimadzu公司;TA-XT2i质构仪 英国Stable Micro Systems公司;S4800场发式扫描电子显微镜 日本日立公司;Discovery DHR-1流变仪 美国TA公司。
1.3 方法
1.3.1 肌原纤维蛋白提取及氧化体系的构建
猪肉肌原纤维蛋白的提取按照Park等[8]的方法进行。采用双缩脲法,利用牛血清蛋白作为标准蛋白测定肌原纤维蛋白含量[11]。
参照Xiong等[9]的方法建立氧化体系。将提取所得肌原纤维蛋白溶于pH 6.0、10 mmol/L磷酸缓冲溶液(含0.6 mol/L NaCl),再向其中添加不同量儿茶素(0、10、50、100、150 μmol/g),然后加入10 μmol/L FeCl3、100 μmol/L VC和1 mmol/L H2O2,制备羟自由基氧化体系,肌原纤维蛋白终质量浓度为40 mg/mL,4 ℃反应12 h。以未氧化肌原纤维蛋白(即不作任何处理的40 mg/mL肌原纤维蛋白)和在羟自由基氧化体系中氧化后未添加儿茶素的肌原纤维蛋白(质量浓度40 mg/mL)作为对照。
1.3.2 羰基含量测定
参照Oliver等[10]的方法。将1.3.1节制备的肌原纤维蛋白溶液用pH 6.0、10 mmol/L磷酸盐缓冲液(含0.6 mol/L NaCl)稀释到2 mg/mL,取1 mL与1 mL 10 mmol/L DNPH混合均匀,室温反应1 h,加入1 mL 20 g/100 mL三氯乙酸,10 000 r/min离心5 min,取沉淀,用1 mL乙酸乙酯-乙醇(体积比1∶1)洗涤沉淀3 次,加入3 mL 6 mol/L盐酸胍,37 ℃水浴保温15 min,沉淀溶解后,10 000 r/min离心3 min,上清液于370 nm波长处测定吸光度。羰基含量表示为每毫克蛋白中羰基的物质的量(nmol/mg)。
1.3.3 巰基含量测定
参照Di Simplicio等[11]的方法。将1.3.1节制备的肌原纤维蛋白溶液用pH 6.0、10 mmol/L磷酸盐缓冲液(含0.6 mol/L NaCl)稀释到10 mg/mL,取1 mL加入8 mL Tris-甘氨酸,混匀,10 000 r/min离心15 min,取4.5 mL上清液与0.5 mL 10 mmol/L Ellmans试剂反应30 min,于412 nm波长处测定吸光度。巯基含量表示为每毫克蛋白中巯基的物质的量(nmol/mg)。
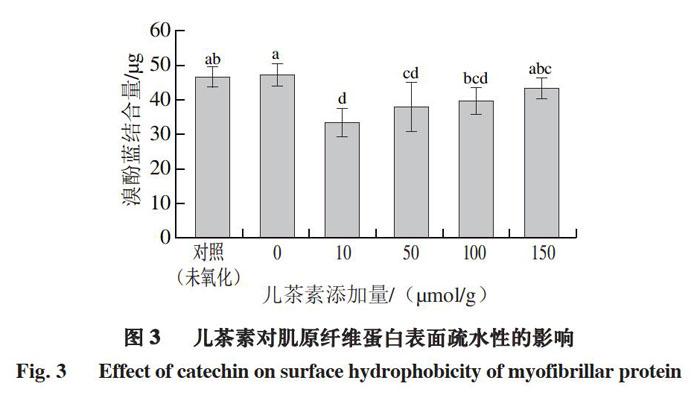
1.3.4 表面疏水性测定
参照Chelh等[12]的方法,将1.3.1节制备的肌原纤维蛋白溶液用pH 7.0、20 mmol/L磷酸缓冲溶液稀释到5 mg/mL,取1 mL加入200 μL 1 mg/mL溴酚蓝溶液,混匀,6 000 r/min离心15 min,将上清液稀释10 倍,于595 nm波长处测定吸光度,对照组用1 mL磷酸盐缓冲溶液替代肌原纤维蛋白溶液。表面疏水性以溴酚蓝结合量表示,按式(1)计算。
(1)
1.3.5 溶解度测定
参照Joo等[13]的方法,并略作修改。将1.3.1节制备的肌原纤维蛋白溶液用pH 6.0、10 mmol/L磷酸盐缓冲液(含0.6 mol/L NaCl)稀释到10 mg/mL,取3 mL于离心管,4 ℃放置2 h,4 ℃、10 000 r/min离心20 min。取上清液1 mL,采用双缩脲法测定蛋白质质量浓度。溶解度按式(2)计算。
(2)
式中:ρ1为上清液肌原纤维蛋白质量浓度/(mg/mL);
ρ2为离心前肌原纤维蛋白质量浓度/(mg/mL)。
1.3.6 粒径测定
将1.3.1节制备的肌原纤维蛋白溶液用pH 6.0、10 mmol/L磷酸盐缓冲液(含0.6 mol/L NaCl)稀释到5 mg/mL,用激光粒度仪对肌原纤维蛋白粒径进行测定。测定参数:物质折射率1.520,介质为水,介质折射率1.333。
1.3.7 肌原纤维蛋白热诱导凝胶的制备
将1.3.1节制备的肌原纤维蛋白溶液分装于密封玻璃瓶中(直径25 mm,高度40 mm),在水浴锅中加热至72 ℃,保持20 min,形成凝胶后取出,冰浴冷却1 h。将所有凝胶样品贮藏在2~4 ℃冰箱中备用。每次分析前凝胶需在室温(25~27 ℃)条件下放置30 min。
1.3.8 凝胶强度测定
使用质构分析仪进行测定,探头型号选择P/0.5。参数设置为:在测定模式选择下压距离为4 mm,测试前速率5 mm/s,测试速率2 mm/s,测试后速率2 mm/s,触发力5 g。
1.3.9 凝胶保水性测定
称取离心管质量,记为m0(g),取5 g凝胶放入离心管,再称取此时离心管质量,记为m1(g);4 ℃、3 000 r/min离心10 min,将离心析出的水分析干,再次称取离心管质量,记为m2(g)。凝胶保水性按式(3)计算。
(3)
1.3.10 微观结构观察
参照李明清[14]的方法,采用扫描电子显微镜进行观察,加速电压3.0 kV,放大倍数100 000 倍。
1.3.11 动态流变学测定
将1.3.1节制备的肌原纤维蛋白溶液均匀涂抹于流变仪测试平台,排出气泡。测试参数为:频率0.1 Hz,应变2%,上下夹缝为1 mm,升温程序:30~80 ℃,升温速率1 ℃/min。
1.4 数据处理
每个实验重复3 次,结果表示为平均值±标准差。采用SPSS 19.0软件中的Linear Models程序进行数据统计分析,采用LSD程序进行差异显著性分析(P<0.05)。使用Sigmaplot 12.5软件作图。
2 结果与分析
2.1 儿茶素对肌原纤维蛋白羰基含量的影响
小写字母不同,表示差异显著(P<0.05)。下同。
羰基含量是反映蛋白质氧化程度的重要指标之一[15],
羰基含量越高,蛋白质氧化越严重。由图1可知,氧化后肌原纤维蛋白(儿茶素添加量0 μmol/g)的羰基含量显著高于未氧化时(P<0.05),加入儿茶素后,羰基含量显著降低
(P<0.05),说明儿茶素能抑制肌原纤维蛋白氧化进程,这主要是由于儿茶素中的酚羟基对自由基的清除作用。儿茶素添加量为10、50、100 μmol/g时,肌原纤维蛋白羰基含量逐渐降低,即儿茶素添加量升高,蛋白氧化抑制能力增强,但是,当儿茶素添加量为150 μmol/g时,肌原纤维蛋白羰基含量有所增加,可能是由于儿茶素添加量增加使其起到促氧化作用,有研究表明,酚类物质的抗氧化性与其浓度有关,浓度过高时反而会促进氧化[16]。
Estévez[17]研究发现,在没食子酸、绿原酸、槲皮素、芦丁和染木料素等多种多酚中,除芦丁外,其他多酚对蛋白质羰基化合物的形成均具有抑制作用,这与本研究的结果相一致。
損耗模量(G)用来表示凝胶的黏性特征。由图9B可知,与G的变化趋势相似,儿茶素添加量10 μmol/g时,G的变化趋势与未氧化组和儿茶素添加量0 μmol/g组相似,当儿茶素添加量达到50、100、150 μmol/g时,加热至45 ℃不会出现峰值,G的变化曲线趋于平坦,说明凝胶网络结构已不能形成。肌原纤维蛋白流变特性测定结果与凝胶强度和保水性测定结果相一致。
3 结 论
儿茶素能抑制肌原纤维蛋白氧化过程中羰基化合物的产生,但添加过多儿茶素会促进蛋白质氧化。随着儿茶素添加量增加,肌原纤维蛋白巯基含量降低,表面疏水性低于未氧化组和儿茶素添加量0 μmol/g组,溶解度降低,粒径增大,肌原纤维蛋白发生聚集,肌原纤维蛋白凝胶强度和保水性逐渐下降,凝胶微观结构更加松散,蛋白胶束聚集,凝胶网络结构变差;中、高添加量儿茶素(50、100、150 μmol/g)使肌原纤维蛋白失去典型的流变曲线。因此,中、高添加量儿茶素与肌原纤维蛋白的共价交联或儿茶素导致的肌原纤维蛋白疏水性聚集会削弱肌原纤维蛋白的凝胶特性。
参考文献:
[1] MORZEL M, GATELLIER P, SAYD T, et al. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J]. Meat Science, 2006, 73(3): 536-543. DOI:10.1016/j.meatsci.2006.02.005.
[2] NIETO G, JONGBERG S, ANDERSEN M L, et al. Thiol oxidation and protein cross-link formation during chill storage of pork patties added essential oil of oregano, rosemary, or garlic[J]. Meat Science, 2013, 95: 177-184. DOI:10.1016/j.meatsci.2013.05.016.
[3] GANH?O R, MORCUENDE D, EST?VEZ M. Protein oxidation in emulsified cooked burger patties with added fruit extracts: influence on colour and texture deterioration during chill storage[J]. Meat Science, 2010, 85(3): 402-409. DOI:10.1016/j.meatsci.2010.02.008.
[4] EST?VEZ M, HEINONEN M. Effect of phenolic compounds on the formation of α-aminoadipic and γ-glutamic semialdehydes from myofibrillar proteins oxidized by copper, iron, and myoglobin[J]. Journal of Agricultural and Food Chemistry, 2010, 58: 4448-4455. DOI:10.1021/jf903757h.
[5] CAO Yungang, TRUE A D, CHEN Jie, et al. Dual role (anti- and pro-oxidant) of gallic acid in mediating myofibrillar protein gelation and gel in vitro digestion[J]. Journal of Agricultural and Food Chemistry, 2016, 64: 3054-3061. DOI:10.1021/acs.jafc.6b00314.
[6] SIEBERT K J. Effects of protein-polyphenol interactions on beverage haze, stabilization, and analysis[J]. Journal of Agricultural and Food Chemistry, 1999, 47(2): 353-362. DOI:10.1021/jf980703o.
[7] CAO Yungang, XIONG YoulingL.. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry, 2015, 180: 235-243. DOI:10.1016/j.foodchem.2015.02.036.
[8] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2007, 101(3): 1239-1246. DOI:10.1016/j.foodchem.2006.03.028.
[9] XIONG Y L, PARK D, OOIZUMI T. Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments[J]. Journal of Agricultural and Food Chemistry, 2009, 57(1): 153-159. DOI:10.1021/jf8024453.
[10] OLIVER C N, AHN B W, MOERMAN E J, et al. Age-related changes in oxidized proteins[J]. Journal of Biological Chemistry, 1987, 262(12): 5488-5491.
[11] DI SIMPLICIO P, CHEESEMAN K H, SLATER T F. The reactivity of the SH group of bovine serum albumin with free radicals[J]. Free Radical Research Communications, 1991, 14(4): 253-262. DOI:10.3109/10715769109088954.
[12] CHELH I, GATELLIER P, SANT?-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[13] JOO S T, KAUFFMAN R G, KIM B C, et al. The relationship of sarcoplasmic and myofibrillar protein solubility to colour and water-holding capacity in porcine longissimus muscle[J]. Meat Science, 1999, 52(3): 291-297. DOI:10.1016/S0309-1740(99)00005-4.
[14] 李明清. 鯉鱼肌原纤维蛋白功能特性的研究[D]. 哈尔滨: 东北农业大学, 2010: 15-16. DOI:10.7666/d.y1787263.
[15] M?LLER I M, ROGOWSKA-WRZESINSKA A, RAO R S P. Protein carbonylation and metal-catalyzed protein oxidation in a cellular perspective[J]. Journal of Proteomics, 2011, 74(11): 2228-2242. DOI:10.1016/j.jprot.2011.05.004.
[16] UTRERA M, EST?VEZ M. Analysis of tryptophan oxidation by fluorescence spectroscopy: effect of metal-catalyzed oxidation and selected phenolic compounds[J]. Food Chemistry, 2012, 135(1): 88-93.
DOI:10.1016/j.foodchem.2012.04.101.
[17] EST?VEZ M. Protein carbonyls in meat systems: a review[J]. Meat Science, 2011, 89(3): 259-279. DOI:10.1016/j.meatsci.2011.04.025.
[18] JONGBERG S, T?RNGREN M A, GUNVIG A, et al. Effect of green tea or rosemary extract on protein oxidation in Bologna type sausages prepared from oxidatively stressed pork[J]. Meat Science, 2013, 93(3): 538-546. DOI:10.1016/j.meatsci.2012.11.005.
[19] JONGBERG S, GISLASON N E, LUND M N, et al. Thiol-quinone adduct formation in myofibrillar proteins detected by LC-MS[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 6900-6905. DOI:10.1021/jf200965s.
[20] CAVALLIERI A L F, DA CUNHA R L. The effects of acidification rate, pH and ageing time on the acidic cold set gelation of whey proteins[J]. Food Hydrocolloids, 2008, 22(3): 439-448. DOI:10.1016/j.foodhyd.2007.01.001.
[21] MOHAN M, RAMACHANDRAN D, SANKAR T V, et al. Physicochemical characterization of muscle proteins from different regions of mackerel (Rastrelliger kanagurta)[J]. Food Chemistry, 2008, 106(2): 451-457. DOI:10.1016/j.foodchem.2007.05.024.
[22] NEHA B, POONAM A, HARINDER S O. Influence of green tea polyphenols on the colloidal stability and gelation of WPC[J]. Food Hydrocolloids, 2011, 25(5): 1077-1084. DOI:10.1016/j.foodhyd.2010.10.004.
[23] LI Chunqiang, XIONG YoulingL., CHEN Jie. Oxidation-induced unfolding facilitates myosin cross-linking in myofibrillar protein by microbial transglutaminase[J]. Journal of Agricultural and Food Chemistry, 2012, 60(32): 8020-8027. DOI:10.1021/jf302150h.
[24] SHI Yan, LI Ruyi, TU Zongcai, et al. Effect of γ-irradiation on the physicochemical properties and structure of fish myofibrillar proteins[J]. Radiation Physics and Chemistry, 2015, 109: 70-72. DOI:10.1016/j.radphyschem.2014.12.016.
[25] JIANG Lianzhou, WANG Zhongjiang, LI Yang, et al. Relationship between surface hydrophobicity and structure of soy protein isolate subjected to different ionic strength[J]. International Journal of Food Properties, 2015, 18(5): 1059-1074. DOI:10.1080/10942912.2013.865057.
[26] RAWEL H M, CZAJKA D, ROHN S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(3): 137-150. DOI:10.1016/S0141-8130(02)00016-8.
[27] SUN Weizheng, CUI Chun, ZHAO Mouming, et al. Effect of composition and oxidation of proteins on their solubility, aggregation and proteolytic susceptibility during processing of Cantonese sausage[J]. Food Chemistry, 2011, 124: 336-341. DOI:10.1016/j.foodchem.2010.06.042.
[28] SCHMITT C, BOVAY C, ROUVET M, et al. Whey protein soluble aggregates from heating with NaCl: physicochemical, interfacial, and foaming properties[J]. Langmuir, 2007, 23(8): 4155-4166. DOI:10.1021/la0632575.
[29] TANG Changbo, ZHANG Wangang, ZOU Yufeng, et al. Influence of RosA-protein adducts formation on myofibrillar protein gelation properties under oxidative stress[J]. Food Hydrocolloids, 2017, 67: 197-205. DOI:10.1016/j.foodhyd.2017.01.006.
[30] YAN Mingyan, LI Bafang, ZHAO Xue, et al. Physicochemical properties of gelatin gels from walleye pollock (Theragra chalcogramma) skin cross-linked by gallic acid and rutin[J]. Food Hydrocolloids, 2011, 25(5): 907-914. DOI:10.1016/j.foodhyd.2010.08.019.
[31] XIONG Y L, BLANCHARD S P. Myofibrillar protein gelation: viscoelastic changes related to heating procedures[J]. Journal of Food Science, 1994, 59(4): 734-738. DOI:10.1111/j.1365-2621.1994.tb08115.x.
收稿日期:2020-02-20
基金项目:辽宁省重点研发计划项目(2017205003);辽宁省高等学校产业技术研究院重大应用研究项目(041804)
第一作者简介:贾娜(1982—)(ORCID: 0000-0003-1770-8200),女,副教授,博士,研究方向為肉品加工与质量安全控制。
E-mail: jianaxia_2010@163.com
通信作者简介:刘登勇(1979—)(ORCID: 0000-0003-4588-9985),男,教授,博士,研究方向为肉品加工与质量安全控制。
E-mail: jz_dyliu@126.com

