衰亡期黑藻与生长期菹草交替生长对水体磷迁移的影响
王立志, 董彬, 宋红丽, 李宝, 安娟
衰亡期黑藻与生长期菹草交替生长对水体磷迁移的影响
王立志*, 董彬, 宋红丽, 李宝, 安娟
山东省水土保持与环境保育重点实验室, 临沂大学资源环境学院, 临沂 276005
为利用冷暖种交替控制水体磷污染、抑制水体富营养化, 揭示湖泊演化规律和机理。研究设置单季植物组(黑藻组、菹草组)和交替生长组(黑藻组+菹草组)进行实验。交替生长组在黑藻衰亡期种植菹草, 监测各组上覆水和底泥中各形态磷含量的变化, 计算黑藻衰亡释放磷及菹草生长吸收磷的总量, 同时测定环境因子指标。分析沉水植物交替生长(黑藻+菹草)过程对衰亡期沉水植物(黑藻组)释放磷所带来的二次污染的消减作用, 并分析环境因子变化与磷含量之间的关系。实验结果表明: 黑藻+菹草组显著(<0.05)降低了上覆水中总磷(TP)、溶解性总磷(DTP)和溶解性活性磷(SRP)的浓度; 显著(<0.05)降低了间隙水中DTP和SRP的浓度。底泥TP含量黑藻组呈上升趋势, 黑藻+菹草和菹草组呈下降趋势。在采用菹草生物量期望2倍于衰亡植物黑藻生物量的模拟实验条件下, 每实验组沉水植物黑藻衰亡分解所释放的磷为1.51 g, 沉水植物菹草生长所富集吸收的磷为1.83 g。因此, 菹草具备消减黑藻所释放磷的能力, 可作为冷暖种交替控制水体富营养化的备选物种。实验组磷的迁移方向分别为: 黑藻组磷迁移最终方向为底泥, 黑藻+菹草组和菹草组磷的迁移方向为植物。黑藻+菹草组通过提高环境中DO和ORP, 使得水相中磷向沉积物相中迁移, 从而使得水相中各形态磷浓度保持在相对较低的水平。
沉水植物; 交替生长; 磷迁移; 磷
0 前言
全球大约80%的湖泊受到营养盐磷的控制, 另外约10%与磷和氮有直接关系, 其余 10%是由氮或其它因素制约[1]。因此, 磷是造成湖泊水质富营养化的关键性因素之一。磷作为一种极具生物活性的元素, 不仅是引起湖泊水体富营养化的主要营养物, 同时也是水体富营养化现象能否发生的限制因子, 因此有效降低磷浓度成为防治湖泊水体富营养化的关键[2]。
利用水生植物修复富营养化水体, 具有氮、磷富集能力强, 净化效果好, 运营成本低等优点, 在工程实践中得到广泛应用。沉水植物是水体生态系统中的初级生产者之一, 能调节水生态系统的物质循环速度, 增加水体生物多样性, 抑制藻类过量生长, 增强水体稳定性, 从而有效提高水质环境[3]。沉水植物在生长过程中能通过根及茎叶的吸收, 使得水相和沉积物相中的磷浓度降低[4], 同时, 由于沉水植物的生长发育可改变水相和沉积物相的环境因子, 因而改变了沉积物相和水相之间磷的交换速率和方式[5]。但是, 沉水植物的生长期比较短, 一般为5-7个月, 一年中其它时间沉水植物处于衰亡和休眠期。植物的生命周期决定了植物在衰亡期对系统中氮磷的影响可能由生长旺盛期时系统中氮磷的“汇”而转变成氮磷的“源”[6], 从而导致藻类大量繁殖, 进而引起水质恶化, 造成二次污染[7]。在生态修复过程中, 沉水植物因衰亡对水体造成的二次污染一直困扰着学术界, 是否可以通过混合种植生长季节不同的沉水植物来减缓或抵消二次污染, 尚需要进一步探讨。
在应对水草问题的方法中, 多年来的实践表明化学法除草或机械打捞的方式, 终归只能作为水草防治的应急方式, 不能从根本上防止水草问题年年爆发[8]。近年来研究表明[9], 在水生植物冷暖种交替水体中, 磷浓度在全年均保持在一个相对稳定且较低的水平, 如南京固城湖湖水总磷含量 0.01—0.09 mg·L-1[10]。因此, 本研究拟应用生态学原理采用“以草治草”的理念, 解决的主要科学问题为: 采用生长期的菹草()来消除衰亡期的黑藻()分解所带来的二次污染。
王文林等[11]采用菹草、伊乐藻()、野菱()和水鳖()所构建的季相交替的水生植物群落能在水质变化剧烈、藻类容易爆发的阶段(初春至夏末)持续有效的抑制浮游植物生长繁殖, 对富营养化水体中的营养盐有较高的去除作用, 并能有效缓解因前一种植物死亡给水质带来的不利影响, 使水质保持相对稳定。叶春等[12]对沉水植物黑藻的分解研究表明黑藻分解率较高(76.56%), 碳、氮、磷等营养物质释放率分别为 81.31%、81.62%、85.94%。因此, 黑藻在进入生长末期必须采取生物操控措施, 以避免黑藻残体因腐解而对水体产生二次污染。
黑藻是多年生大型淡水沉水植物, 适应性强, 生长迅速, 广泛分布于各淡水水域, 黑藻种群的存在对维护淡水生态系统的稳定起重要作用。黑藻具有生长范围广、耐污能力和适应性强等特点, 在国内外富营养化水体治理和生态修复中已得到广泛应用, 对营养盐具有较强的吸收积累能力, 可作为重污染环境修复植物和水体污染的指示植物[13]。菹草又叫虾藻、虾草, 属眼子菜科眼子菜属多年生沉水草本植物, 分布于中国南北各省, 为世界广布种, 是许多草型湖泊春季水生植物的优势种群, 生于湖泊、池塘、水沟、水稻田、灌渠及缓流河水中[14]。菹草是富营养化浅水湖泊的常见种, 秋季发芽, 冬春生长, 4—5 月开始繁殖, 初夏逐渐衰亡腐烂。菹草茎、叶都具有吸收功能, 能明显的去除水体中氮、磷等营养物质, 抑制藻类的过量生长, 增加水体透明度, 同时菹草耐污能力高, 适应能力强, 因此也是湖泊生态修复的常用物种
在黑藻衰亡期种植该阶段处于生长期的菹草。监测水和底泥中各形态磷含量的变化; 计算磷在水-底泥-植物三相之间的迁移方向; 同时监测环境因子的变化, 分析环境因子和各形态磷含量之间的关系。在此基础上探讨如何利用冷暖种交替的水生植物调控水体磷循环。为水体生态修复工作中利用冷暖种交替控制水体磷污染、抑制水体富营养化提供借鉴。同时对进一步揭示湖泊演化规律和机理以及在湖泊生态修复中制定适当的沉水植物利用管理策略具有重要的理论意义和现实意义。
1 实验材料与设计
1.1 材料与设计
底泥采自山东临沂沂蒙湖富营养化水华暴发水域, 采用彼得森采泥器于8月份采集。采集后样品低温风干后过100目筛, 去除粗粒及动植物残体, 然后充分混匀。将混匀后的底泥加入高密度聚乙烯桶(顶直径×底直径×高=150 cm×145 cm×90 cm, 桶壁预先用蒸馏水冲洗干净), 底泥铺设厚度为20 cm, 底泥干重为50.00 kg每桶。然后缓慢注入去离子水1500 L(北京普析通用GWN-UN制备)。
实验设计为黑藻组, 黑藻+菹草组, 菹草组和对照组四组。实验系统在注入水后稳定一周, 然后种植经过预培养的黑藻, 所种植黑藻为室内驯化培养一年后处于生长期末期的植株。植株选用健壮无附着物的植物体, 并连根整株采集, 经冲洗干净后均匀种植于实验系统。实验设置交替生长组黑藻+菹草组, 单季种组黑藻组和菹草组。黑藻+菹草组每桶黑藻生物量为3 kg鲜重, 并同时种植菹草休眠芽(石芽)0.4 kg(根据预实验和野外调查, 0.4 kg菹草石芽在理想状态下生长最大生物量可达6 kg左右, 本实验采用菹草生物量期望2倍于衰亡植物黑藻, 因此采用种植0.4 kg菹草石芽)。黑藻组仅种植黑藻, 每桶黑藻生物量为3 kg鲜重, 菹草组种植菹草休眠芽(石芽)0.4 kg, 对照组不进行任何植物种植, 每组设置3个平行桶。
实验在挡雨棚内进行, 为最大限度接近自然环境, 挡雨棚与外界空气连同, 实验时间为9月—12月。实验开始前采集水样进行测定, 同时采用电极测定底质物理指标, 上覆水及底泥初始理化指标作为初始0天的数值。
1.2 取样与分析
水样采集采用虹吸管抽取的方式, 每次采集水面以下10 cm, 40 cm和70 cm处的等体积水(50 ml)混匀。上覆水总磷(TP)和溶解性总磷(DTP), 浓度测定采用过硫酸钾氧化法; DTP浓度的测定: 将水样预先过0.45 μm孔径的醋酸纤维滤膜, 而后用过硫酸钾氧化法; 溶解性活性磷(SRP)浓度的测定: 将水样预先过0.45 μm孔径的醋酸纤维滤膜, 而后用钼-锑-钪比色法。磷浓度用连续流动分析仪(FLOWSYSTEAⅢ, 希思迪, 意大利)测定。颗粒磷(PP)浓度为TP浓度与DTP浓度之差, 溶解性有机磷(DOP)浓度为DTP浓度与SRP浓度之差。每个样品均重复测定3次, 采用三次平均值作为计算数据。
沉积物采用微型柱状采泥器(自制)采集, 沉积物样品每次均匀采集5个微型柱状样(横切面直径2 cm), 采集后的样品室温(25 ℃)风干, 然后对风干前后的样品称重以计算由采样带来的系统中总体磷和水量的损耗(沉积物样品的采集会导致沉积物中总体磷量减少, 用此方法计算沉积物中减少的总体磷量。同时由于样品为湿样, 会带走部分水分, 用此方法计算水分损耗)。将风干后沉积物样品与植物根系分离, 过100目筛后充分混匀, 然后进行沉积物中各形态磷分析。采集沉积物样品的同时采集植物样品, 测定生物量及含水率, 并分析植物中磷含量。沉积物样品磷形态分析采用国际通用的SMT法[15]。具体见表1。
植物中磷用微波消解仪消解后, 采用电感耦合等离子体质谱仪(ICP-MS, 赛默飞, 美国)进行含量分析。并根据以下公式计算植物释放或吸收磷总量[16]:

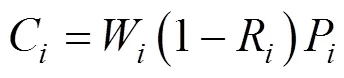
间隙水采用原位渗滤装置采集。pH和ORP测定采用多功能探头(PHSJ-4A, 雷磁, 中国)测定仪测定。DO采用溶解氧探头(YSI 550, 维赛, 美国)测定。

表 1 SMT 分级提取方法
1.3 生物量计算及统计分析
沉水植物菹草生长期和黑藻衰亡期, 在另外的预实验中统计黑藻、菹草不同生长阶段的株高(1/cm)和生物量(鲜重,/g)。株高的统计中将分枝的植株中的分枝进行长度累加, 获得某一植物的总长度计为总株高。并对植物65 ℃烘干后计算植物的干重和含水率。为保证数据最大限度接近实际值, 每次统计植物不少于300株。根据统计数据建立植物生物量模型, 以推算沉水植物在生长过程中的生物量[17]。
黑藻=0.01961+0.5207,2=0.81<0.05 (3)
菹草=0.04871-1.1699,2=0.76<0.05 (4)
绘图和模型运算采用origin pro 8.5, 数据分析采用SPSS 16.0, 显著性检验采用SPSS里面t检验。多重比较采用SPSS 16.0里面One-way ANOVA 中的LSD检验法。
1.4 水生植物分解速率及向水体释放磷含量描述方程
对于水生植物的衰亡速率一般采用式(5)进行描述, 以代表其分解速率; 本研究为了对比方便采用该式同时描述植物生长速率, 用代表生长率。
水生植物生长及分解速率描述公式[18]:
W=0e–kt(5)
代表时间 (d),时间时刻的植物生物量(按照占初始值百分比计算, 在计算生长率时按照占最后植物生物量百分比计算),0初始植物生物量, ‘e’常数,速率 (d–1).
水体中磷含量随时间的变化可用峰值方程(peak equation)来进行描述[19]。

代表时间 (d),为时间时候的水体磷的浓度(mg·L-1),‘e’自然常数,为常数。
将公式(5)带入(6)并简化, 得到磷含量随生物量变化的公式(7)。

2 实验结果
2.1 上覆水各形态磷浓度含量
与衰亡期黑藻组相比黑藻+菹草组显著(< 0.05)降低了上覆水中TP、DTP和SRP的浓度, 对DOP和PP的影响不显著(>0.05)。黑藻组各形态磷的变化呈明显的单峰曲线, 各形态磷浓度在实验开始后迅速升高, 并在实验第40天达到最大值(TP, 0.63 mg·L-1), 然后在实验第50到110天期间(图1), 上覆水中各形态磷浓度缓慢降低, 到实验结束时, 上覆水中TP浓度为0.23 mg·L-1, 仍然处于一个相对较高的水平。黑藻+菹草组各形态磷的变化和黑藻组类似, 呈单峰曲线变化。黑藻+菹草组各形态磷的浓度在实验第40天达到最大值(TP, 0.33 mg·L-1),然后随着时间的推移缓慢下降。黑藻+菹草组TP的最大值和单一的黑藻组相比降低了0.30 mg·L-1, 可见在黑藻衰亡速率最大时期, 黑藻+菹草组能有效的消减上覆水中TP浓度的峰值, 黑藻+菹草组虽然未能改变上覆水中因黑藻衰亡而带来的磷浓度升高趋势, 但是却能有效的降低水中各形态磷的浓度, 使得各形态磷的浓度保持在相对较低的水平。菹草组和对照组水体中磷含量相对较稳定, 同时也表明黑藻组水体中磷含量的剧烈波动主要是由于黑藻衰亡所导致。
根据式7, 可拟合黑藻生物量与水体中各形态磷含量之间的关系(表2)。黑藻+菹草组实验, 采用菹草生物量作为变量, 建立菹草生物量与水体各形态磷之间的关系, 通过拟合发现, DOP含量并不适合该方程(表2), 而其他各形态磷取得了较好的拟合效果。

图1 上覆水磷含量变化
Figure 1 Changes of different phosphorus concentrations in overlying water during the autumn experiment course

表 2 公式7拟合参数值
a 指标DOP 无法拟合函数
菹草组水体中各形态磷含量均呈不同程度的下降趋势, 且随着生物量的变化并不符合峰值方程, 因此本研究采用多项式拟合的方式来描述生物量变化和各形态磷之间的关系。公式如下:

P为时菹草组水体中磷含量,W为时水体中菹草含量百分比。a,b,c,d为常数。

表3 公式8拟合参数值
由表3可知, TP, SRP和DOP的拟合结果相对较好, 而DTP和PP的结果相对较差。
2.2 间隙水各形态磷浓度含量
与衰亡期黑藻组相比, 黑藻+菹草组间隙水中DTP和SRP的浓度均显著(<0.05)降低。黑藻+菹草组间隙水DTP和SRP的浓度在实验第20天略呈上升趋势, 然后在后期实验中缓慢下降, 在整个实验期间黑藻+菹草组沉积物相间隙水中各形态磷的浓度变化范围在0.23—0.60 mg·L-1之间波动(图2)。黑藻组间隙水DTP和SRP的浓度均显著高于对照组, 间隙水DTP和SRP的浓度呈单峰曲线变化, 在实验第50天时达到最大值(DTP, 0.82 mg·L-1; SRP, 0.61 mg·L-1, 图2)然后缓慢下降, 到实验结束保持在相对较高的水平(DTP, 0.65 mg·L-1)。菹草组间隙水DTP和SRP呈降低趋势, 到实验结束时DTP和SRP含量本别为0.03 mg·L-1和0.02 mg·L-1。

图2 间隙水各形态磷变化
Figure 2 Changes of different phosphorus concentrations in pore water
2.3 沉积物各形态磷浓度含量
TP含量黑藻组呈上升趋势, 黑藻+菹草和菹草组呈下降趋势。实验结束时黑藻组、黑藻+菹草和菹草TP含量分别为: (770.17±19.37), (734.25±6.18), (730.17±41.01) mg·kg-1(图3)。在实验过程中黑藻+菹草组和菹草沉积物TP的含量低于黑藻组和对照组, 与对照组相比较差异性均不显著(>0.05), 但是与黑藻组相比较差异性均显著(<0.05)。
各实验组NaOH—P与变化趋势与TP类似, 黑藻组呈上升趋势, 黑藻+菹草和菹草组呈下降趋势。实验过程中菹草组NaOH—P略低于黑藻+菹草组。实验结束时黑藻组、黑藻+菹草组和菹草组TP含量分别为: (266.87±6.70), (232.23±10.89), (231.88±18.94) mg·kg-1(图3)。与黑藻组相比较菹草组显著降低了沉积物NaOH—P的含量(<0.05), 而黑藻+菹草组虽然也降低了NaOH—P的含量但为达到显著性水平(>0.05)。与对照组相比较黑藻+菹草组和菹草组均显著降低了沉积物NaOH—P的含量(<0.05)。黑藻组HCl—P含量略呈上升趋势, 而黑藻+菹草和菹草组几乎保持不变, 仅在菹草组略有降低。实验组各组之间HCl—P含量无显著性差异(>0.05)。
黑藻组IP含量呈上升趋势, 黑藻+菹草和菹草组呈下降趋势。实验过程中菹草组IP略高于黑藻+菹草组。与黑藻组相比较, 黑藻+菹草和菹草组IP含量均显著降低(<0.05), 但黑藻+菹草和菹草组IP与对照组之间无显著差异(>0.05)。OP含量各处理组保持在相对稳定的水平几乎没变化, 也无显著性差异(>0.05)。

图3 沉积物各形态磷的变化
Figure 3 Changes of phosphorus concentrations in sediment during the autumn experiment
2.4 各处理组环境因子变化
黑藻+菹草组DO在实验第20天后便迅速升高, 并在实验过程中一直保持在相对较高的水平。实验期间DO含量黑藻+菹草组显著高于黑藻组、菹草组和对照组(<0.05)。而黑藻组、菹草组和对照组之间无显著性差异(>0.05), 同时各处理组DO随着实验的进行整体呈升高趋势。ORP黑藻+菹草组显著高于黑藻组、菹草组和对照组(<0.05)。黑藻组、菹草组和对照组之间无显著性差异(>0.05), 各处理组ORP随着实验的进行整体呈升高趋势(图4)。实验各处理组中pH整体偏碱性, 各组之间无显著性差异(>0.05), 黑藻+菹草组pH在实验期间略高于其它处理组。

图4 实验过程中上覆水pH、DO和ORP的变化
Figure 4 Changes of pH、DO and ORP in overlying water
2.5 磷在水-植物-底泥中的分配
各实验组磷的迁移方向也存在较大差异(图5)。衰亡期沉水植物黑藻组底泥中磷含量比例呈上升趋势, 水中磷含量比例呈先上升后下降趋势, 因此黑藻组磷迁移最终方向为底泥。黑藻+菹草组底泥和水中磷含量比例均呈先上升后下降趋势, 植物中磷含量比例呈先下降后上升趋势, 因此黑藻+菹草组磷的迁移方向为植物。菹草组底泥和水中磷含量比例呈下降趋势, 植物中磷含量比例呈上升趋势, 磷的迁移方向为植物。植物-水-底泥三相磷比例表明, 单季植物黑藻在生长期吸收底泥和水中磷在衰亡期向底泥和水中释放磷, 同时由于底泥对水中磷吸收的延滞, 导致大量磷滞留在水中。而交替生长植物黑藻+菹草组能较好的利用滞留在水中的磷, 并吸收了部分底泥中的磷, 从而使得水中磷含量波动相对较小。对照组水中的磷含量比例略有增加(由0.20%上升至0.38%), 说明在没有植物的作用下底泥存在一定的磷释放的现象。
3 讨论
3.1 沉水植物交替生长对磷的影响
实验开始黑藻进入街道生物量逐渐下降(图6), 黑藻的衰亡分解是一个复杂的过程, 主要包括糖类、有机酸、蛋白质和矿物质的释放以及木质素、纤维素等的不断降解。一般分为三个过程, 第一个过程是水溶性物质的淋溶过程, 第二个过程是在微生物的作用有机物降解过程, 第三个过程是难未分解的水草残体比例不断升高, 分解速率明显减慢的过程[20]。本研究黑藻衰亡主要出于第一、二过程。如图6所示, 根据公式5计算菹草的生长速率绝对值为||为0.0244 d−1。黑藻分解速率||为0.017 d−1, 根据本实验假设如果在本实验条件下菹草||大于黑藻||, 菹草才有可能消减黑藻衰亡所带来的二次污染。因此菹草是生长速率大于黑藻衰亡速率, 从磷的总量平衡来看, 菹草具备消减黑藻衰亡所释放的磷的能力。图6 a表明菹草生长所富集的磷总量要大于黑藻衰亡所释放的磷总量, 印证了本实验的假设。

图5 磷在水-底泥-植物三相的百分比
Figure 5 percentage of phosphorus in water-sediment-plant

图 6 交替生长过程中衰亡期沉水植物分解释放磷与生长期沉水植物吸收磷总量比较及实验期间生物量变化
Figure 6 Phosphorus released from submerged macrophyte during the decomposition period and phosphorus uptake by submerged macrophyte during the growth period in the seasonal aspect alternating experiment
在第40天黑藻组间隙水和水中均出现明显的磷峰值, 通过对比该时期的黑藻衰亡状况发现, 在实验第40—80天时, 黑藻组生物量下降明显, 表明这一阶段是黑藻快速衰亡期(图6 b)。植物体内的磷主要存在于一些生物活性物质中, 这些物质易于分解, 可优先释放出磷, 因此黑藻在衰亡初期将向水体释放大量的磷[21]。而在黑藻+菹草实验组由于菹草生长的吸收作用, 将间隙水中磷峰值消减。沉水植物根系并不发达, 因此在本研究中沉水植物衰亡所导致的间隙水中各形态磷含量波动并不大。吴凯等[22]研究黑藻、伊乐藻 () 和金鱼藻衰亡过程结果表明3 种水草的腐解的前两个阶段向水体释放了大量了氮、磷等营养盐, TP含量短期内达到较高浓度。研究表明[23], 水草腐解, 体内氮、磷的 70% 以上会在短时间内释放到水体, 氮、磷的快速升高容易导致水体藻类的迅速繁殖, 藻类的大量繁殖可能导致水质严重恶化。因此, 合理地控制水草种植密度, 对生态系统和水质安全具有重要的意义。
马月等[24]通过在菹草衰亡过程中种植金鱼藻()的方式, 研究其对菹草衰亡释放营养物质的消减作用, 表明菹草腐解—金鱼藻生长耦合作用对水质的改善效果明显, 同时采用线性拟合的方式对建立水体总氮、溶解性总氮、总磷、溶解性总磷、总有机碳与植物叶绿素、水体叶绿素、植物可溶性蛋白、植物丙二醛之间的多元线性拟合。由于水体中各形态磷的变化是曲线的, 因此本研究认为采用曲线拟合将更接近实验结果。
在黑藻+菹草组中, 菹草在快速生长过程中吸收水体中大量的营养物质, 以满足自身生长的需求, 在实验第40天(实验组磷峰值日), 与黑藻组相比黑藻+菹草组将水体中TP含量降低了47.62%。因此, 处于生长期菹草的吸收是黑藻+菹草组水体中各形态磷的含量均显著低于黑藻组的主要原因。植物附着生物对水体磷循环亦有一定的作用, 但由于其生物量较小(本研究附生藻生物量所占总生物量比例小于1%), 其作用基本可忽略[25]。本研究只有两种大型沉水植物, 同时实验用水为人为调配, 水中藻类数量较少, 因此藻类的作用也在本研究中基本可以忽略。对照组TP含量一直稳定在0.05—0.06 mg·L-1, 对照组SRP含量呈下降趋势, 表明底泥对水中磷含量影响较小。植物组黑藻组和黑藻+菹草组由于黑藻的衰亡分解导致水中磷含量迅速升高。菹草组在实验前期水体中磷含量也呈小幅度升高趋势, 可能和实验初期栽种过程中对底泥的扰动导致了少量的磷释放有关。
在沉水植物交替过程中, 处于衰亡的沉水植物将向上覆水和沉积物释放磷素, 而处于生长期的沉水植物将吸收利用沉积物和上覆水中磷, 以满足自身生长的需要。根据式1和2计算表明, 在本实验中每实验组沉水植物黑藻衰亡分解所释放的磷为1.51 g, 沉水植物菹草生长所富集吸收的磷为1.83 g (图6)。因此, 在采用菹草生物量期望2倍于衰亡植物黑藻生物量的模拟实验条件下, 菹草具备消减黑藻所释放磷的能力。
3.2 磷元素在水体和底泥中的迁移
磷在水体和底泥之间的交换是个十分复杂的物理、化学、生物过程, 主要包括含磷颗粒的沉降与再悬浮、溶解态磷的吸附解吸等, 在水体磷循环过程中, 底泥的对水体的营养物质具有很强的吸附及截留作用[26]。在本实验条件下, 实验组黑藻腐解的初期, 水体的 TP含量迅速升高, 在实验后期又逐渐下降, 在本实验结束时底泥中TP的含量升高, 植物—水—底泥三相磷比例表明, 表明黑藻分解释放的磷并未全部停留在水体, 而是发生了迁移, 有部分磷转移到了底泥中, 因此底泥存在较强的磷释放风险。而黑藻+菹草组中, 菹草的生长能较好的利用滞留在水中的磷, 同时吸收了部分水中向底泥迁移的磷, 从而使得水中磷含量波动相对较小, 从而降低了底泥磷释放的风险。
3.3 环境因子的改变及对磷含量的影响
在试验开始黑藻进入快速分解阶段, 消耗了水大量的DO, 因此水中的DO含量迅速下降。试验的中、后期, 黑藻残体中难分解物质的比例不断升高, 分解速率逐渐下降, 对水中耗氧量降低, 水中的DO逐渐升高。由于空气中氧气可以溶入水体, 实验后期, 水中的溶解氧逐渐上升。黑藻组在植物快速衰亡期水中DO如果没有得到及时的补充, 可能会导致水质恶化。有研究表明[27], 当水体植物残体生物量较大时, 极易在腐解期造成水体缺氧并向水体释放大量的营养盐, 造成水体发黄、发臭。黑藻分解初期, 体内不稳定的含碳有机物质释放到水体, 在微生物的作用下分解释放出 CO2, 造成水体 pH 下降[28]。黑藻分解导致水体由中性变为弱酸性, 可以使得水生生物如河蟹的免疫系统受到损伤[29]。
在本实验条件下, 黑藻+菹草组水体中DO和ORP均显著高于单一植物组(图4)。DO和ORP的升高对底泥磷释放有重要影响, 当水体控制在好氧状态时, 表层底泥氧化还原电位较高, 利于Fe2+转化为Fe3+, Fe3+与磷酸盐结合成难溶的磷酸铁, 使好氧状态下底泥对磷的释放作用减弱。厌氧时, Fe3+还原成Fe2+, 一方面使PO43-脱离原来沉淀状态进入上覆水, 另一方面[Fe(OH)3]x胶体转化成可溶的Fe(OH)2, 同时释放吸附于其上的游离态磷, 导致上覆水体中溶解态磷浓度增加[30, 31]。因此较高的氧化还原电位和较高的溶解氧都能降低水体磷含量。pH值是水质的重要指标, 它对水体物理化学反应有重要影响。碱性条件下, pH值升高时沉积物磷释放增加; 在中性范围内, 释磷量最小; 酸性条件下促使磷的释放[32]。
在本实验后期, 黑藻+菹草组水体中各形态磷含量显著低于单一植物组, 而且在间隙水中也存在类似现象, 这和环境因子DO和ORP的改变应该有重要的关系。同时也表明, 在黑藻+菹草组中处于生长期的沉水植物可以通过对环境因子DO和ORP的改变, 从而促进底泥对水体中磷的吸收。因此, 在黑藻+菹草组中衰亡期植物向水体释放的磷在较高的DO和ORP作用下向沉积物迁移。
4 结论
由于黑藻的腐烂分解向水体释放磷, 黑藻组与黑藻+菹草组各形态磷的变化呈明显的单峰曲线, 与黑藻组相比较黑藻+菹草组显著(<0.05)降低上覆水中TP、DTP和SRP的浓度, 对DOP和PP的影响不显著(>0.05)。黑藻+菹草组, 使得各形态磷的浓度保持在相对较低的水平。
黑藻的分解使得黑藻组沉积物各形态磷含量均呈上升趋势, 而菹草组由于菹草的吸收使得各形态磷含量均呈下降趋势。黑藻+菹草组沉积物中磷呈下降趋势。与黑藻组相比, 黑藻+菹草组显著(<0.05)降低了间隙水中DTP和SRP的浓度。菹草组间隙水由于菹草的吸收作用DTP和SRP含量呈降低趋势。
菹草生长速率||为0.0244d−1, 黑藻分解速率||为0.017d−1。在采用菹草生物量期望2倍于衰亡植物黑藻生物量的模拟实验条件下, 每实验组沉水植物黑藻衰亡分解所释放的磷为1.51 g, 沉水植物菹草生长所富集吸收的磷为1.83 g。因此, 菹草具备消减黑藻所释放磷的能力。
黑藻+菹草组水体中pH、DO和ORP均在实验期间高于单一植物组和对照组, 表明黑藻+菹草交相交替过程可能通过对环境因子pH、DO和ORP的改变影响磷的循环。
[1] 谢兴勇, 祖维, 钱新. 太湖磷循环的生态动力学模拟研究[J]. 中国环境科学, 2011, 31(5): 856–862.
[2] 陈志超, 张志勇, 刘海琴, 等. 4 种水生植物除磷效果及系统磷迁移规律研究[J]. 南京农业大学学报, 2015, 38(1): 107–112.
[3] CARPENTER S R, LODGE D M. Effects of submersed macrophytes on ecosystem processes[J]. Aquatic Botany, 1986, 26(3/4): 341–370.
[4] PAICE R L, CHAMBERS J M, ROBSON B J. Potential of submerged macrophytes to support food webs in lowland agricultural streams[J]. Marine & Freshwater Research, 2017, 68(3) 549–562.
[5] GRASSET C, LEVREY L H, DELOLME C, et al. The interaction between wetland nutrient content and plant quality controls aquatic plant decomposition[J]. Wetlands Ecology & Management, 2017, 25(2):211–219.
[6] SHILLA D, ASAEDA T, FUJINO T, et al. Decomposition of dominant submerged macrophytes: implications for nutrient release in Myall Lake, NSW, Australia[J]. Wetlands Ecology and Management, 2006, 14(5): 427–433.
[7] 孟凡丽, 王立志, 宋红丽, 等. 红枫湖水体营养盐与环境因子关系研究[J]. 生态科学, 2019, 38(2): 77–85.
[8] MADSEN T V, CEDERGREEN N. Sources of nutrients to rooted submerged macrophytes growing in a nutrient‐rich stream[J]. Freshwater Biology, 2010, 47(2): 283–291.
[9] 濮培民, 李正魁, 王国祥. 提高水体净化能力控制湖泊富营养化[J]. 生态学报, 2005, 25(10): 2757–2763.
[10] 谷孝鸿, 范成新, 胡本龙, 等. 固城湖生物资源现状及近20年间的变化趋势[J]. 生态与农村环境学报, 2005, 21(1): 7–11,16.
[11] 王文林, 马婷, 李强, 等. 水生高等植物季相交替群落对富营养化水体净化效果调查[J]. 环境监测管理与技术, 2006, 18(01): 16–19.
[12] 叶春, 王博, 李春华, 等. 沉水植物黑藻腐解过程中营养盐释放过程[J]. 中国环境科学, 2014, 34(10): 2653– 2659.
[13] 索江瑞, 宋辛辛, 张莹莹, 等. 伊乐藻和黑藻生理生化特征及其竞争优势比较[J]. 湿地科学, 2017, 15(5): 724– 730.
[14] 尹传宝, 张敏, 张翠英, 等. 沉水植物菹草对富营养化水体中TN生态效应及模型研究[J]. 生态科学, 2015, 34(1): 129–131.
[15] RUBAN V, L PEZ-S NCHEZ J, PARDO P, et al. Harmonized protocol and certified reference material for the determination of extractable contents of phosphorus in freshwater sediments-a synthesis of recent works[J]. Fresenius Journal of Analytical Chemistry, 2001, 370(2/3): 224–228.
[16] 杜立刚. 三峡库区消落带植被淹水碳氮磷释放及消落带氮磷交换通量研究[D]. 重庆: 重庆大学, 2013.
[17] 王立志, 王国祥. 衰亡期沉水植物对水和沉积物磷迁移的影响[J]. 生态学报, 2013, 33(17): 5426–5437.
[18] OLSON J S. Energy Storage and the Balance of Producers and Decomposers in Ecological Systems[J]. Ecology, 1963, 44(2): 322–331.
[19] WANG L Z, LIU Q J, HU C W, et al. Phosphorus release during decomposition of the submerged macrophyte[J]. Limnology, 2018, 19(1): 355–366.
[20] BEST E P H, DASSEN J H A, BOON J J, et al. Studies on decomposition oflitter under laboratory and field conditions: losses of dry mass and nutrients, qualitative changes in organic compounds and consequences for ambient water and sediments[J]. Hydrobiologia, 1990, 194(2): 91–114.
[21] GODSHALK G L, WETZEL R G. Decomposition of aquatic angiosperms. III.L. and a conceptual model of decomposition[J]. Aquatic Botany, 1978, 5: 329– 354.
[22] 吴凯, 马旭洲, 王友成, 等. 3种水草腐解对水质的影响[J]. 上海海洋大学学报, 2016, 25(5): 726–734.
[23] SHILLA D, ASAEDA T, FUJINO T, et al. Decomposition of dominant submerged macrophytes: implications for nutrient release in Myall Lake, NSW, Australia[J]. Wetlands Ecology & Management, 2006, 14(5): 427–433.
[24] 马月, 王国祥, 曹勋, 等. 菹草腐解-金鱼藻生长耦合作用对水质及植物生长的影响[J]. 环境科学, 2015, 36(7): 2504–2510.
[25] SULTANA M, ASAEDA T, AZIM M E, et al. Morphological responses of a submerged macrophyte to epiphyton[J]. Aquatic Ecology, 2010, 44(1): 73–81.
[26] HU D M, CAI L, CHEN H, et al. Fungal diversity on submerged wood in a tropical stream and an artificial lake[J]. Biodiversity & Conservation, 2010, 19(13): 3799– 3808.
[27] GIBBS M, OZKUNDAKCI D. Effects of a modified zeolite on P and N processes and fluxes across the lake sediment–water interface using core incubations[J]. Hydrobiologia, 2011, 661(1): 21–35.
[28] 武海涛, 吕宪国, 杨青, 等. 三江平原典型湿地枯落物早期分解过程及影响因素[J]. 生态学报, 2007, 27(10): 4027–4035.
[29] STEBBING A R D. Hormesis — The stimulation of growth by low levels of inhibitors[J]. Science of the Total Environment, 1982, 22(3): 213–234.
[30] JIANG X, JIN X C, YAO Y, et al. Effects of biological activity, light, temperature and oxygen on phosphorus release processes at the sediment and water interface of Taihu Lake, China[J]. Water Research, 2008, 42(8/9): 2251–2259.
[31] HORPPILA J, NURMINEN L. Effects of submerged macrophytes on sediment resuspension and internal phosphorus loading in Lake Hiidenvesi (southern Finland)[J]. Water Research, 2003, 37(18): 4468–4474.
[32]JIN X C, WANG S R, PANG Y, et al. Phosphorus fractions and the effect of pH on the phosphorus release of the sediments from different trophic areas in Taihu Lake, China[J]. Environmental Pollution, 2006, 139(2): 288–295.
Effects of alternating growth of decliningand growingon phosphorus migration in water
WANG Lizhi*, DONG Bin, SONG Hongli, LI Bao, An Juan
Shandong Provincial Key Laboratory of Water and Soil Conservation and Environmental Protection, College of Resources and Environment, Linyi University, Linyi 276005, China
In order to revealthe mechanism of alternating aquatic plants cold and warm species to control phosphorus pollution and eutrophication, submerged macrophyteandwere planted respectively as single season plant groups, andwere planted as alternate growth process in this study. Phosphorus concentration in overlying water and sediment was monitored. The amount of phosphorus released from the decomposition ofand the total phosphorus uptake bywere calculated. The environmental factors were determined simultaneously. The subtractive effects of alternate growth of submerged macrophytes () on the release of phosphorus from submerged submerged macrophyte () and the relationship between the changes of environmental factors and the content of phosphorus were analyzed. The results indicated thatgroups significantly reduced total phosphorus(TP), dissolved total phosphorus (DTP) and soluble reactive phosphorus (SRP) concentration of the overlying water and DTP and SRP concentration of the interstitial water (<0.05). The content of TP in sediment increased in, but decreased inandgroups. Phosphorus release from thedecomposition in each experiment group was 1.51 g, and the phosphorus uptake by the submerged plantwas 1.83 g under the simulated experiment whichexpected biomass was double as much asdecomposing plantbiomass. Therefore,had the ability to reduce phosphorus release from. The transfer direction of phosphorus in the experimental group showed that the final direction of phosphorus transfer in thegroup was sediment, while in theandwas plant. This could be explained by the high DO and ORP. In the groupsphosphorus transferred from water to sediment by increasing DO and ORP.
submerged macrophyte; alternate growth; phosphorus transfer; phosphorus
10.14108/j.cnki.1008-8873.2020.03.022
S932
A
1008-8873(2020)03-160-12
2019-08-05;
2019-10-12
山东省自然科学基金 (ZR2018LD004); 国家自然科学基金 (41303061, 41601086)
王立志(1980—), 男, 山东临沂人, 博士, 教授, 主要从事水环境生态修复研究, E-mail:wanglizhi@lyu.edu.cn
王立志
王立志, 董彬, 宋红丽,等. 衰亡期黑藻与生长期菹草交替生长对水体磷迁移的影响[J]. 生态科学, 2020, 39(3): 160–171.
WANG Lizhi, DONG Bin, SONG Hongli, et al. Effects of alternating growth of decliningand growingon phosphorus migration in water[J]. Ecological Science, 2020, 39(3): 160–171.
——以武汉紫阳湖为例

