钙化型乳腺癌的分子分型特点及其预后分析
胡仰玲 曾辉 何子龙 徐维敏 秦耿耿 陈卫国
南方医科大学南方医院放射科(广州510515)
乳腺癌是全球女性中最常见的癌症,随着医疗技术的发展和人民生活水平的提高,乳腺癌的检出率逐步提高,但目前仍然是病死率较高的癌症[1]。微钙化是早期乳腺癌重要且相对特异的表现,其作为增加乳腺癌恶性程度的影像学标记物,尤其是对临床触诊阴性的隐匿型乳腺癌的早期诊断十分重要[2]。越来越多的研究提示伴随钙化征象的乳腺癌恶性风险更高,预后更差,更容易复发。铸型钙化已被认为是乳腺癌患者预后的一项独立危险因素,且更容易出现腋窝淋巴结转移[3]。乳腺癌转移是一个涉及多因素、多阶段的复杂过程,其治疗和预后一直以来都是关注的热点和难点[4]。迄今为止,微钙化在乳腺组织形成的相关分子机制及在乳腺癌进展中的作用机制尚未完全明确[5]。仅靠传统的病理组织学分类已不能满足当今肿瘤研究和诊治的要求,精确地掌握乳腺癌分子分型特征是个体化精准治疗的必要前提。乳腺癌在分子水平上具有高异质性,不同分子分型对应的临床治疗反应和预后生存不同[6]。近年来,部分研究提出与分子分型密切相关的雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,Her-2)的表达与影像学征象也存在一定的关联[7-10]。由此可见,不同分子分型也可能形成不同的影像学特征[9,11]。钙化作为乳腺癌的主要恶性征象之一,其形态及分布特征可能因分子分型不同而截然不同。本研究基于不同分子分型乳腺癌患者临床病理特征,具体分析钙化X 线影像特征(形态、分布)与肿瘤分子分型之间的关系,重点探讨钙化型乳腺癌分子分型的分布特点及其预后风险,旨在深入了解钙化型乳腺癌的潜在分子机制,为乳腺癌的个体化治疗提供更准确的依据。
1 对象与方法
1.1 研究对象回顾性分析南方医科大学南方医院2012年1月至2017年10月病理证实的631 例乳腺癌患者临床资料,包括临床资料、影像诊断报告、病理诊断结果、免疫组化结果等。其中钙化型乳腺癌376 例,无钙化型乳腺癌255 例。
1.2 方法根据ER、PR、Her-2、肿瘤增殖指数(Ki-67)的表达情况,划分4 种乳腺癌分子分型:Luminal A 型、Luminal B 型、三阴性型、Her-2 过表达型。乳腺X 线检查主要采用Siemens Mammomat Novation DR 全数字化乳腺X 线机。所有病例均行头尾位及内外斜位摄影片,必要时行局部加压或放大摄影。影像评估:由两位高年资影像科医师以美国放射学会的乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)(第5 版)[12]为标准,对乳腺病灶进行BI-RADS 分类,并详细分析钙化形态及分布。
1.3 判断标准ER、PR 阳性标准:免疫组化肿瘤细胞染色阳性细胞在10%以上;Her-2 免疫组化染色(++)或(+++)为阳性,0 或(+)为阴性;Ki-67 增殖指数<14%为阴性,≥14%为阳性。乳腺癌分子分型的判定标准见表1。

表1 乳腺癌分子分型的判定标准Tab.1 Criteria for breast cancer molecular types
1.4 统计学方法采用SPSS 20.0 统计软件分析。符合正态分布的定量资料,以(>)表示,组间差异的比较采用单因素方差分析;定性资料以例数(%)的形式表示,组间差异的比较采用交叉表χ2检验,期望频数不满足要求时采用确切概率法。以单因素分析筛选出的有统计学意义的变量作为自变量,分别以钙化和预后淋巴结转移作为因变量,最终建立二分类Logistic 回归方程。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同分子分型的乳腺癌的临床特征631 例乳腺癌 患 者中,Luminal A 型61 例,Luminal B 型376 例,三阴性型66 例,Her-2 过表达型128 例。不同分型乳腺癌临床特征见表2,在BI-RADS 分类、病理分型、淋巴结转移上的差异均有统计学意义(P<0.05)。相比Luminal A 型及三阴性型乳腺癌,Luminal B 型和Her-2 过表达型乳腺癌在乳腺X 线诊断时更多判为BI-RADS 5 类(P=0.008);病理结果提示,相比Luminal A 型,Luminal B 型、三阴性型乳腺癌、Her-2 过表达型乳腺癌为浸润性导管癌更多见,差异有统计学意义(P<0.001);此外,Luminal B 型和三阴性型乳腺癌病理多提示伴有淋巴结转移,而Luminal A 型和Her-2过表达型乳腺癌的淋巴结转移率相对低,差异有统计学意义(P= 0.001)。但在年龄分层上差异无统计学意义(P>0.05)。

表2 不同分子分型乳腺癌患者的基本特征Tab.2 The characteristics of breast cancer patients in different molecular types 例(%)
2.2 乳腺癌分子分型与钙化X 线征象的相关分析631 例乳腺癌患者中,376 例钙化,255 例无钙化。根据是否钙化,从钙化的形态及分布去分析不同分子分型乳腺癌的差异,结果表明,钙化X 线影像征象与乳腺癌分子分型相关,Her-2 过表达型及Luminal B型乳腺癌多伴有钙化(78.9%、61.7%),Luminal A 型、三阴性型乳腺癌的钙化率相对较低(42.6%、25.8%),组间差异均有统计学意义(P<0.001);此外,钙化的形态及分布均与乳腺癌分子分型相关,组间差异均有统计学意义(P= 0.008;P= 0.003)。Her-2 过表达型乳腺癌钙化大多呈细小多形性或线样分支状,Luminal B 型则为细小多形性居多,两者均以线样、段样分布多见;Luminal A 型、三阴性型乳腺癌钙化类型多呈细小多形性,Luminal A 型乳腺癌线样、段样分布、成簇分布均可见;三阴性型则成簇分布更为多见。见表3。

表3 不同分子分型乳腺癌的钙化征象分析Tab.3 Analyzing the characteristics of calcification in different breast cance molecular types 例(%)
2.3 不同分子分型乳腺癌出现钙化X 线征象的Logistic 回归分析通过对不同分子分型乳腺癌进行Logistic 回归分析,提示分子分型是乳腺癌出现钙化X 线征象的影响因素,相比之下,Her-2 过表达型较Luminal B 型钙化的风险更高(OR= 4.977,P<0.001;OR=2.270,P=0.008),见表4。
2.4 钙化型乳腺癌预后的Logistic 回归分析以病理淋巴结转移为预后因素,单因素Logistic 回归分析提示分子分型和病理分型均可能是钙化型乳腺癌预后淋巴结转移的影响因素;其中,Luminal B 型提示危险性相对较高(OR=4.4,P=0.002)。多因素Logistic 回归分析结果进一步证实Luminal B 型是钙化型乳腺癌淋巴结转移的独立危险因素(OR= 2.753,P= 0.05),见表5。
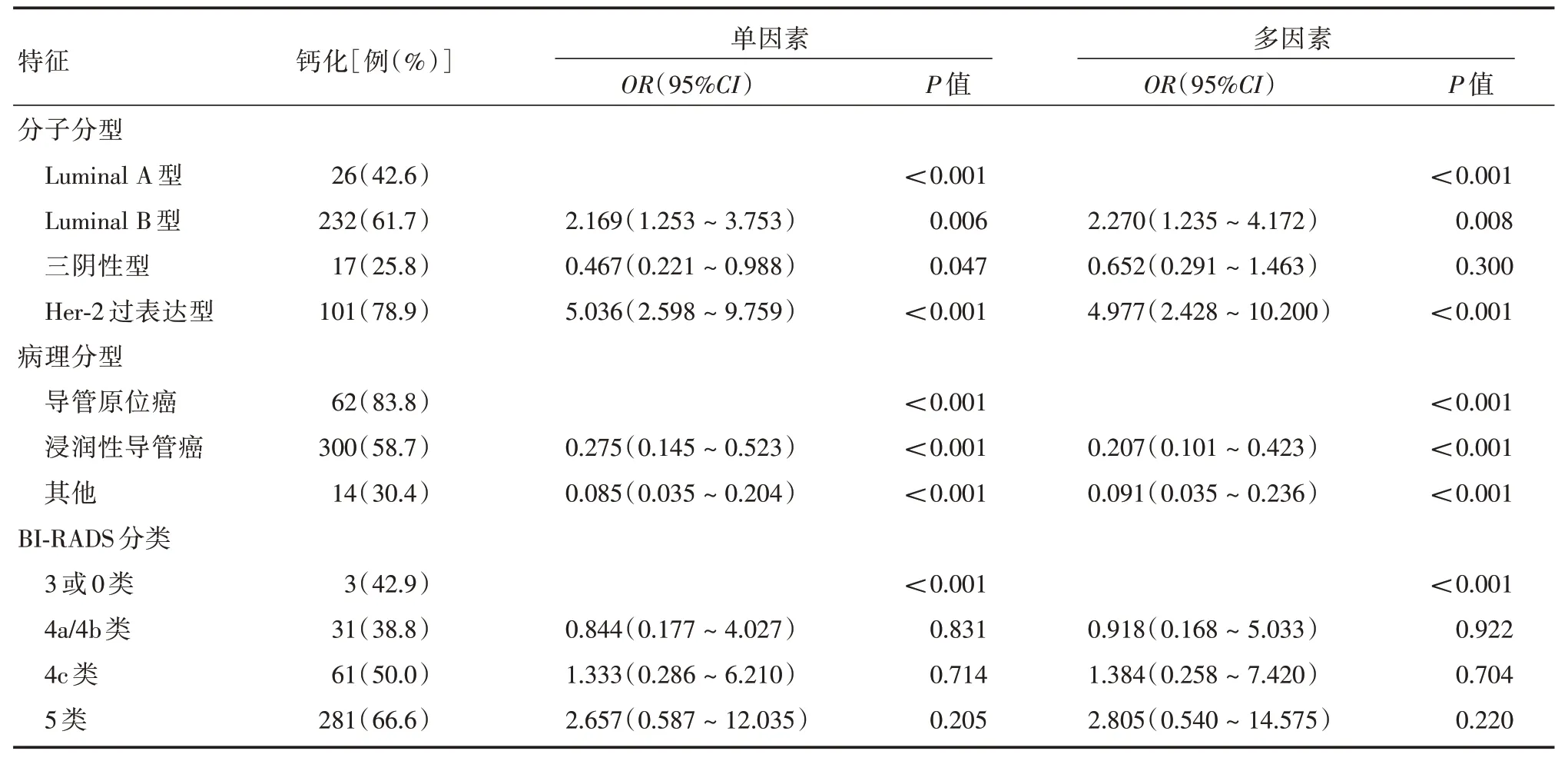
表4 不同分子分型乳腺癌出现钙化X 线征象的Logistic 回归分析Tab.4 Logistic regression analysis of mammography calcification in different breast cancer molecular types

表5 钙化乳腺癌患者淋巴结转移的Logistic 回归分析Tab.5 Logistic regression analysis of lymph node metastasis in breast cancer patients with calcification
3 讨论
随着分子生物学的快速发展,乳腺病理学也从传统的组织学分类,发展至乳腺癌分子分型特征的精确分类,这是个体化精准治疗的必要前提。乳腺癌分子分型不同,其肿瘤生物学行为也呈现出不同的形态学模式、微观病理学表现以及影像成像特征。乳腺癌的生物多样性可能体现在影像学特征中,所以研究其影像学特征也可能有助于区分不同的分子表型。
微钙化是早期乳腺癌的一个非常重要且相对特征的X 线表现。钙化通常被认为与浸润性癌相关的导管内成分的标志物。有报道指出50%浸润性导管癌含有恶性钙化,95%难触及肿块的导管原位癌以钙化征象被发现[2];越来越多的研究表明,伴随钙化征象的乳腺癌恶性风险更高,预后更差;尤其铸型钙化更容易出现腋窝淋巴结转移[3]。另外,伴铸型钙化的乳腺癌,其实际病灶比例往往比影像学显示的大得多,这主要是由于其内广泛的导管内成分[13]。
关于乳腺癌微钙化影像学特征(形态、分布、范围)与病理免疫组化指标ER、PR 及Her-2 表达的关系已有诸多报道,但目前尚无定论;尤其对钙化型乳腺癌的分子分型研究及分子机制也尚未明确[9,14];较多研究提出乳腺癌微钙化与ER、Her-2的表达情况关系密切,在Luminal B 型和Her-2过表达型中更可能发现钙化,而在三阴性型中分布较少[15-16],本研究也得出类似的结论。不同于TAMIMI 等[6]及WU 等[9]的研究,本研究对不同亚型乳腺癌进行更详细的BI-RADS 评估;相比Luminal A 型及三阴性型乳腺癌,Luminal B 型和Her-2 过表达型在乳腺X 线诊断时更多判为BIRADS 5 类;说明分子分型可能为未来临床诊断乳腺癌的恶性程度提供更多参考价值。此外,本研究分析不同分子分型乳腺癌的钙化情况,阐明了Her-2 过表达型及Luminal B 型更容易出现钙化。本研究发现钙化的形态及分布与分子分型也存在一定的相关性;Her-2 过表达型乳腺癌钙化大多呈细小多形性或线样分支状,Luminal B 型则为细小多形性居多,两者均呈线样、段样分布多见;三阴性型则成簇分布更多见;Luminal A 型线样、段样分布、成簇分布均可见。
本研究Luminal B 型和Her-2 过表达型钙化的形态及分布均提示其恶性程度较高,原因可能是:(1)ER 及Her-2 可能参与钙离子的转运过程;如绝经后妇女容易骨折,其原因大多是雌激素影响钙质的流失;有文献[17]报到ERα影响骨质愈合过程;另外有研究提出Her-2 过表达可促进前列腺癌骨转移[18],也可涉及骨肉瘤的进展过程[19]。(2)肿瘤坏死产物及肿瘤自主分泌的代谢产物等都可形成钙化,有研究提出钙化的类型可能成为乳腺癌恶性程度的预后因素,Luminal A 型多为非坏死性钙化(包括不定形和点状钙化),Her-2 过表达型多呈坏死性钙化(包括多形和线性钙化);坏死钙化往往比非坏死钙化具有更高的组织学等级[13]。也有研究[20]提出钙化增加与肿瘤坏死过程有关。肿瘤生长过于迅速缺乏血供营养则可发生坏死,且Her-2 阳性多为易局部复发和转移的高级别肿瘤,生长比较快;Luminal B 型的判别标准:一是肿瘤细胞增殖指数Ki-67 更高,二是Her-2 表达稍高,两者都与肿瘤细胞增殖关系密切。因此,笔者大胆猜测Lumina B型和Her-2过表达型大多可能是肿瘤坏死产生钙化,导致恶性程度更高。此外,不同于其他研究[21-22],本研究重点讨论了不同分子分型与钙化型乳腺癌预后情况的内在联系,并提示分子分型影响钙化型乳腺癌淋巴结转移的危险因素,且Luminal B 型的危险性相对更大。进一步研究可尝试以肿瘤坏死为出发点,挖掘ER 及Her-2 与钙化形成的分子机制,更深入探讨分子分型与钙化的内在联系,更精准指导临床个体化治疗。
MAZARI 等[8]提出Her-2 阳性且伴微钙化的乳腺癌患者在新辅助化疗后可达到病理完全缓解。有研究[20]提出新辅助治疗可以改变钙化的数量,钙化数量的减少与临床部分缓解具有一定的相关性。不同分子分型对应的临床治疗反应和预后生存不同[21-22]。分子亚型的确定可有助于开展治疗计划和监测治疗效果。乳腺癌在分子水平上的高度异质性是精准治疗中的一个很大的障碍。探讨乳腺癌的分子亚型临床特征及其与乳腺钙化影像学特征的内在联系,有助于进一步揭示乳腺癌的生物学特性,为乳腺癌患者临床疗效的预判提供更为准确的依据,为乳腺癌患者个体化治疗提供有力的指导。多学科诊疗模式也是目前医学发展趋势;此外,多/跨学科结合的医学研究模式,也为疾病研究开展提供更多的新方向和可能性,如乳腺癌早期骨转移的靶向治疗、靶向治疗(例如免疫疗法)与其他诊疗形式(生物标记物、分子成像等)相结合的新型诊疗策略、影像组学与基因组学的结合等,均为解决肿瘤异质性这一难题提供了新思路[23-24];作为一种新兴研究方法,尚有许多关键科学问题和技术有待进一步探索。本文基于临床、影像资料及病理结果的乳腺癌分子分型与钙化X 线征象的相关性探讨,可为后续更深入的多/跨学科研究提供基础性数据支持。
此外,本研究也存在不足之处:(1)缺乏大样本数据,限制了预后分析和多变量分析的效果;(2)收集的病例缺乏诊治及生存期等信息,难以进行转移部位的统计及生存期的分析;(3)回顾性研究可能存在混淆偏倚;(4)本研究是单中心进行的,钙化型乳腺癌的预后情况若通过多中心结合的研究来验证则更有说服力。综上所述,未来研究需不断改进,为钙化性乳腺癌的诊治提供更多可能性。

