T淋巴细胞表型对慢性HBV感染免疫状态的影响及应用价值
赵金花, 李俊峰, 毛小荣
1 兰州大学第一临床医学院, 兰州 730000; 2 兰州大学第一医院 a.传染病研究室; b.感染科, 兰州 730000
Effect of T-lymphocyte phenotype on immune status in chronic hepatitis B virus infection and its application value
ZHAOJinhua,LIJunfeng,MAOXiaorong.
(TheFirstClinicalMedicalCollege,LanzhouUniversity,Lanzhou730000,China)
Abstract:ObjectiveTo investigate the association between T-lymphocyte phenotype and immune status in chronic hepatitis B (CHB) and its application value.MethodsA total of 77 CHB patients who attended The First Hospital of Lanzhou University from January 2015 to May 2019 were enrolled, and according to the status of HBeAg and the serum levels of alanine aminotransferase (ALT), HBsAg, and HBV DNA, they were divided into immune tolerance group and non-immune tolerance group. The laboratory results of T-lymphocyte phenotype, HBV serological test, HBV DNA load, routine blood test, and liver function were obtained, and aspartate aminotransferase-to-platelet ratio index (APRI) and fibrosis-4 (FIB-4) were calculated. Thettest was used for comparison of normally distributed continuous data between two groups; and the Mann-WhitneyUtest was used for comparison of non-normally distributed continuous data between two groups; the chi-square test was used for comparison of categorical data between groups. Spearman correlation analysis was used to test the correlation effect between the two variables. The diagnostic efficacy of Treg, CD8+PD-1+T lymphocyte percentage and CD8+CD45RO+T lymphocyte percentage were evaluated by AUC.ResultsCompared with the non-immune tolerance group, the immune tolerance group had significantly higher percentages of Treg and CD8+PD-1+T cells (U=12.0 and 59.0,P<0.001,P=0.013) and significantly lower percentages of CD3+CD8+T cells and CD8+CD45RO+T cells (U=50.0 and 38.5, bothP<0.05). Compared with the high HBV DNA load group, the low HBV DNA load group had significantly lower percentages of Treg and CD8+PD-1+T cells (U=178.5 and 255.0,P=0.003 and 0.018) and significantly higher percentages of CD3+T cells and CD8+CD45RO+T cells (U=104.0 and 149.5,P=0.033 and 0.025). APRI was negatively correlated with the percentage of Treg (r=-0.379,P=0.013), and FIB-4 was negatively correlated with the percentages of CD3+CD4+, CD3+CD8+, CD4+CD45RO+, and CD8+CD45RO+T cells (r=-0.259, -0.275, -0.233, and -0.229,P=0.023, 0.016, 0.041, and 0.045). Treg, CD8+PD-1+T cells, and CD8+CD45RO+T cells had an area under the ROC curve of 0.793 (95% confidence interval [CI]: 0.651-0.936), 0.802 (95% CI: 0.678-0.927), and 0.816 (95% CI: 0.706-0.927), respectively, in evaluating immune status.ConclusionThere are various T-lymphocyte phenotypes in patients with chronic HBV infection, and different T lymphocytes have different abilities to eliminate HBV. Detection of T-lymphocyte phenotype helps to understand the immune status and adjust the immune function in CHB patients and can provide a reference for the functional cure of CHB patients.
Keywords:hepatitis B, chronic; T-lymphocyte subsets; immunity, cellular
HBV感染是引起慢性肝病的主要原因,其特点是炎症、肝细胞损伤和肝纤维化的缓慢进展。据世界卫生组织估计,每年约有2.4亿人感染HBV,只有不到1%的慢性HBV感染通过抗病毒治疗治愈,因此就产生了长期或终生治疗的需求[1]。HBV的清除在很大程度上依赖有效的T淋巴细胞免疫反应,在慢性HBV感染中,这种反应通常会变得失调。研究[2]表明,即使在急性HBV感染期间循环内的特异性T淋巴细胞频率也是适中的,并且在慢性感染中进一步降低。感染HBV还可以通过处理和递呈异常高水平的病毒粒子和亚病毒颗粒对免疫系统长期攻击,反复触发T淋巴细胞受体,导致T淋巴细胞衰竭[3-4]。目前的抗病毒治疗很少达到治愈的目的,迫切需要新的治疗方法来恢复HBV特异性T淋巴细胞免疫,以尽快达到慢性HBV的功能性治愈。初治慢性HBV感染者的转录基因显示,在慢性HBV感染的不同阶段有不同的血液基因特征,这表明不同阶段T淋巴细胞的激活是不同的[5]。此外,肝脏免疫状态是通过肝脏炎症反应表现,免疫反应越强,炎症程度越强,但严重的炎症反应可导致肝纤维化程度的增加而加快肝硬化进展。因此,评估慢性HBV感染患者免疫状态是实现HBV功能性治愈的基础,通过研究不同T淋巴细胞表型百分比与肝纤维化程度的相关性,寻找治疗与肝脏炎症反应之间的平衡点。本研究拟通过观察慢性HBV感染初治患者外周血T淋巴细胞表型百分比与不同免疫状态及HBV DNA不同水平以及与肝纤维化程度之间的相关性,为了解慢性HBV感染初治患者的免疫状态及恢复HBV特异性免疫功能提供参考。
1 资料与方法
1.1 研究对象 选取2015年1月-2019年5月在兰州大学第一医院就诊的慢性HBV感染初治患者77例,筛选流程见图1。其中免疫耐受期68例,非免疫耐受期9例。慢性HBV感染患者诊断依据临床实践指南[6]。排除标准:(1)合并肝细胞癌、肝移植、脾切除、血液系统疾病、丙型肝炎及戊型肝炎、AIDS、遗传代谢性肝病、酒精性和非酒精性脂肪性肝病;(2)合并有活跃的自身免疫性疾病、药物或可能影响免疫功能的共同疾病。本研究方案经由兰州大学第一医院伦理委员会审批(批号:LDYYLL2019-254)。
1.2 研究方法
1.2.1 观察指标 收集患者的一般资料、T淋巴细胞表型、HBV血清学标志物、HBV DNA载量、血常规、肝功能等主要实验室指标,并计算肝纤维化血清学诊断指标APRI及FIB-4。
1.2.2 流式细胞术T淋巴细胞亚群及调节性T淋巴细胞(Treg)检测 外周血单个核细胞中加入荧光素标记的单克隆抗体CD3、CD4、CD8、CD45RO、CD4+CD25+Foxp3(Treg)和小鼠IgG1-FITC及小鼠IgG2-PE做为对照(美国BD公司)直接标记全血细胞,溶血素溶解红细胞,PBS洗涤两次,流式细胞仪(美国BD公司)检测T淋巴细胞,CellQuest软件获取分析细胞进行分析,计算CD3+、CD4+、CD8+、Treg、CD8+PD-1+、CD4+CD45RO+、CD8+CD45RO+细胞。

图1 研究对象的筛选流程
1.2.3 免疫状态分期 根据国内指南[6],将年龄较轻、HBV DNA>107IU/ml、HBsAg水平较高(通常>104IU/ml)、HBeAg阳性及ALT持续正常患者列为免疫耐受期患者,其余患者均列为非免疫耐受期患者。

2 结果
2.1 一般资料 慢性HBV感染初治患者中HBeAg阴性组44例,其中男32例,女12例,HBeAg阳性组33例,其中男22例,女11例,根据HBeAg状态分为2组,CD3+CD4+T淋巴细胞百分比和HBsAg水平在HBeAg阳性组与HBeAg阴性组间差异均有统计学意义(P值均<0.05)(表1)。
2.2 不同免疫状态下T淋巴细胞表型百分比的比较结果
慢性HBV感染后患者不同免疫状态表现出不同的T淋巴细胞表型百分比。Treg和CD8+PD-1+细胞百分比在免疫耐受期明显高于非免疫耐受期,差异均有统计学意义(P值均<0.05);CD8+CD45RO+百分比和CD3+CD8+百分比在免疫耐受期明显低于非免疫耐受期,差异均有统计学意义(P值均<0.05)(表2)。
2.3 不同HBV DNA载量组各T淋巴细胞表型百分比的比较结果 为了进一步评估不同T淋巴细胞表型对HBV DNA的清除作用,根据HBV DNA载量将患者分为HBV DNA高载量组(>500 IU/ml)和HBV DNA低载量组(≤500 IU/ml)。结果显示Treg和CD8+PD-1+百分比在HBV DNA低载量组明显低于HBV DNA高载量组,差异均有统计学意义(P值均<0.05);CD3+和CD8+CD45RO+百分比在HBV DNA低载量组明显高于HBV DNA高载量组,差异均有统计学意义(P值均<0.05)(表3)。
2.4 不同T淋巴细胞表型的百分比与肝纤维化血液学诊断指标的相关性 分析结果显示,不同T淋巴细胞表型百分比中仅有Treg与APRI有相关性,且呈负相关(P=0.013);而与FIB-4相关性分析显示,CD3+CD4+、CD3+CD8+、CD4+CD45RO+、CD8+CD45RO+这四种T淋巴细胞百分比与FIB-4呈负相关(P值均<0.05),随着上述四种T淋巴细胞百分比的降低肝纤维化程度逐渐加重(表4)。

表1 不同HBeAg状态的慢性HBV感染初治患者指标比较

表3 不同HBV DNA载量组各T淋巴细胞表型的比较(%)
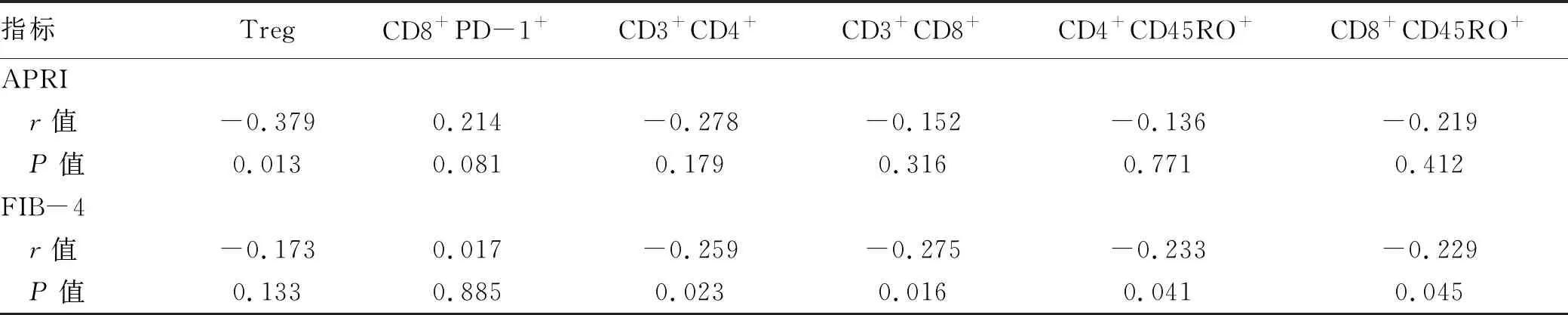
表4 不同T淋巴细胞表型百分比与肝纤维化血液学诊断指标的相关性
2.5 Treg、CD8+PD-1+及CD8+CD45RO+百分比对于免疫状态的评估效能 T淋巴细胞表型百分比评估免疫状态的ROC曲线分析结果显示,Treg、CD8+PD-1+及CD8+CD45RO+的AUC值均>0.7(表5)。

表5 3种T淋巴细胞百分比对于免疫状态的评估效能
3 讨论
人体感染HBV后,体内抵御病毒的免疫反应主要是细胞免疫,如T淋巴细胞通过细胞溶解途径和非细胞溶解途径清除病毒,感染即可得到控制,反之,病毒将长期存在[7]。近年来,关于慢性HBV感染的免疫功能研究越来越多,其中大部分是基于动物实验,而对于检测患者外周血中不同T淋巴细胞表型的研究尚处于初始阶段。本研究通过流式细胞术检测不同T淋巴细胞表型的表达水平并首次将其用于评估慢性HBV感染患者的免疫状态,为进一步调节慢性HBV感染患者免疫功能进而达到功能性治愈提供依据。本研究显示,Treg、CD8+PD-1+及CD8+CD45RO+T淋巴细胞百分比与免疫状态及HBV DNA载量有关,可以推测这三种表型T淋巴细胞百分比的下降与免疫功能的衰竭及HBV的清除能力低下有关,这与既往的研究中慢性HBV感染患者Treg对HBV清除的抑制作用及细胞毒性T淋巴细胞衰竭时表现的免疫抑制相对应。
本研究显示,HBV DNA水平低者,Treg百分比低,HBV DNA水平高者Treg百分比高。Treg是一类具有免疫抑制功能的T淋巴细胞亚群,是细胞免疫中重要的调节细胞,在维持机体免疫耐受方面起着关键作用。既往研究[8]显示相比未感染的动物,土拨鼠肝炎病毒感染的土拨鼠肝脏中Treg的百分比明显升高,肝脏Treg的增加伴有抗炎细胞因子(如TGFβ1和IL-10)和免疫抑制分子如程序性死亡受体1(PD-1)及其配体(PD-L1)的表达显著增加。此外,研究[9]显示,HBV感染的小鼠中,滤泡辅助性T淋巴细胞是清除HBV所必需的,并且能被Treg所抑制;进一步的研究显示,去除Treg或抑制Treg功能(用CTLA-4封闭抗体)可恢复滤泡辅助性T淋巴细胞对HBV DNA的清除。另外,Treg百分比与APRI呈负相关也可以推断,Treg在HBV的清除过程中起抑制作用,抑制肝脏炎症反应进而减慢肝纤维化进展。因此,阻断Treg功能可能有助于控制HBV感染,本研究也证实了既往研究结果。
已有大量的细胞实验和动物实验证实,HBV特异性T淋巴细胞是HBV感染的免疫控制所必需的。因此,对于慢性HBV感染患者免疫功能衰竭的大多数研究集中于恢复T淋巴细胞的活性,特别是CD8+T淋巴细胞。CD8+T淋巴细胞是清除HBV感染细胞的主要效应T淋巴细胞,通过细胞溶解和非细胞溶解机制两种途径清除HBV感染细胞[10-11]。而PD-1分子是表达于CD8+T淋巴细胞衰竭时最突出的标志物,是CD8+T淋巴细胞抑制性受体,负性调节其活化、增殖和细胞因子的产生,进而抑制对HBV的清除。此前已有研究[12-13]显示,慢性HBV感染者PD-1、PD-L1表达较健康对照组明显升高,提示PD-1表达上调与HBV感染慢性化相关。更进一步在慢性HBV感染的研究[14]中,检测到了与病毒逃逸相容的序列,最常见的是以表达高水平PD-1的T淋巴细胞为靶向的核心表位。同样的基于PD-1阻断的免疫疗法将恢复CD8+T淋巴细胞的抗病毒功能。在本研究中,PD-1的表达在免疫耐受期明显高于非免疫耐受期,且HBV DNA高载量者明显高于HBV DNA低载量者,其与Treg一样抑制清除病毒的免疫反应。
此外,本文评估了不同免疫状态下慢性HBV感染者的T淋巴细胞表型百分比。关于恢复慢性HBV感染者免疫功能的研究中,主要是根据不同免疫状态下T淋巴细胞表型百分比的变化情况进一步调整慢性HBV感染者的免疫功能,从而达到治疗的目的。大多数免疫治疗的目的是加强机体对HBV功能失调的特异性免疫应答,其中T淋巴细胞工程就是要人工替代HBV特异性CD8+T淋巴细胞[15]。淋巴细胞脉络丛脑膜炎病毒小鼠模型的实验数据[16]显示,T淋巴细胞衰竭的不同阶段具有不同的恢复能力,提示慢性HBV感染的免疫治疗可能必须根据感染不同阶段CD8+T淋巴细胞表型进行调整。本研究表明随着免疫状态的活化,Treg与CD8+PD-1+细胞百分比呈下降趋势而CD8+CD45RO+T淋巴细胞百分比呈上升趋势,且三种T淋巴细胞表型百分比对慢性HBV感染者的免疫状态的诊断效能均较高。因此,根据Treg、CD8+PD-1+和CD8+CD45RO+T淋巴细胞百分比在慢性HBV感染者的不同免疫状态的变化情况,及时调整慢性HBV感染者体内紊乱的免疫功能,可望恢复患者清除HBV的主动免疫,从而达到功能性治愈。
综上所述,通过对不同HBV特异性T淋巴细胞表型与免疫状态及HBV DNA载量的研究,可以推测Treg、CD8+PD-1+及CD8+CD45RO+T淋巴细胞在慢性HBV感染者不同免疫状态下的变化情况,及时调整免疫功能,恢复HBV特异性免疫细胞的主动免疫,从而恢复对HBV的清除功能。同时,本研究仍有难以避免的不足之处,所选样本量较少,且由于临床数据不足未能根据患者肝硬化Child-Pugh评分进一步分组,此外,由于回顾性研究本身特性的缺陷,大量患者缺乏后续随访数据,未能评估其预后情况。因此,将来的研究有待进一步的优化。

