RhoA/ROCK 信号通路在骨性关节炎中的研究进展*
王 柳 韩 芮 谢俊雄 张小梅 张 源
(昆明医科大学第一附属医院1 疼痛科;2 骨科,昆明 650032)
骨性关节炎(osteoarthritis, OA) 多表现为关节疼痛、关节畸形及功能障碍,多累及膝、髋、 踝、手和脊柱等关节,可增加病人心血管事件的发生率及全因死亡率。OA 患病率非常高,据统计,超过50%的65 岁以上人口罹患OA,随着中国人口的老龄化,患病率也呈逐渐上升的趋势,是制约经济和社会发展的主要疾病之一[1]。OA 病因不明,临床上治疗OA 多采取健康宣教、运动治疗、功能性锻炼、物理治疗、药物治疗等方法,但这些治疗方法面临疗效争议、非甾体抗炎药 (non-steroidal anti-inflammatory drug, NSAIDs) 胃肠道不良反应、阿片类药物成瘾性等问题,且只能短期缓解症状,无法阻止疾病的进展,OA 病人最终常需要手术治疗。OA病人又面临手术费用高昂、并发症较多、功能恢复可能不佳、假体使用寿命有限等问题。
关节软骨细胞作为关节软骨的主要细胞,参与维持细胞外基质合成和降解的动态平衡,老化退变后难以恢复正常。Rho 家族的RhoA 蛋白被瘦素、FKBP51、过度的机械刺激、透明质酸与CD44 受体结合、TGF-α 等多种因素激活后磷酸化并激活ROCK 蛋白,通过下游相关信号分子调节细胞骨架重组,最终引起软骨退变,促进OA 发生和发展。此外,RhoA/ROCK 信号通路还参与调节炎性/非炎性疼痛和神经病理性疼痛,与OA 产生的疼痛密切相关。使用RhoA/ROCK 信号通路相关抑制剂既可以减慢软骨细胞退变速度,也可以缓解OA 产生的疼痛[2]。
通过对RhoA/ROCK 信号通路以及相关调控机制的研究,可进一步了解OA 的发病机制,为OA的预防和治疗带来新的思路。近年来,国外学者对RhoA/ROCK 信号通路以及相关调控机制进行了一系列的研究,但国内的研究相对较匮乏。本文综述了RhoA/ROCK 信号通路在OA 中的研究进展。
一、RhoA/ROCK 信号通路结构及功能
1. Rho 即Ras 相似物 (Ras homologue, Rho)
哺乳动物Rho 家族的小GTP 酶由23 个细胞内信号分子组成,是一组分子量在20~25 kDa 的具有GTP 酶活性的GTP 结合蛋白,又称RhoGTP 酶,受到如生长因子受体、细胞因子受体、整联蛋白和钙粘蛋白粘附受体等细胞膜受体的调节。Rho 家族成员可分为经典和非典型成员,经典RhoGTP 酶,如RhoA、RAC1 和CDC42,对GTP/GDP 的 亲 和力非常高,而自发核苷酸解离速率非常慢,因此需要通过鸟嘌呤核苷酸交换因子 (guanine nucleotide exchange factors, GEF) 加速GDP/GTP 交换。具体而言,GEF 刺激GDP 结合状态的Rho 蛋白向GTP 结合状态转换激活RhoGTP 酶,而RhoGAP 催化GTP水解,使这些活性蛋白质转换为无活性状态,通过活性GTP 结合状态/非活性GDP 结合状态之间转换,发挥其分子开关的作用。除GTP/GDP 循环外,RhoGTP 酶还受磷酸化和泛素化等翻译后修饰的调节。激活的RhoGTP 酶进一步激活ROCK、mDia (mammalian Diaphanous, mDia)、PKN (protein kinase N, PKN) 等下游效应底物发挥作用。
2. RhoA/ROCK 信号通路
RhoA/ROCK信号通路的激活与很多疾病相关,如心血管疾病、肿瘤、神经中枢系统疾病等。RhoA蛋白作为最具特征的GTP 酶之一,属于小G 蛋白超家族的亚家族成员,同样受上游各种细胞膜受体调节。当RhoA 被上游分子激活后,可进一步激活下游分子Rho 相关蛋白激酶 (Rho associated protein kinase, ROCK),引发下游的磷酸化/脱磷酸化反应,调节细胞的相关生命活动。
ROCK 于20 世纪末期在哺乳动物中发现,是一种丝氨酸/苏氨酸蛋白激酶,可被RhoA、RhoB 和RhoC 等RhoGTP 酶 激 活。ROCK 分 为ROCK I 和ROCK II 两个亚型,分别由1 354 和1 388 个氨基酸组成,两者都含有N 末端定位的激酶结构域、卷曲螺旋区和Rho 结合结构域,氨基酸序列中有65%的同一性,其中激酶结构域之间具有最高的氨基酸同源性,高达92%,而在卷曲螺旋结构域内最具不同性,只具有55%的同源性,因此两者在体外具有相似的激酶活性。ROCK 可通过其C-末端PH-C1串联隔离N-末端激酶结构域并降低其激酶活性来发挥自身抑制作用。ROCK 的组织表达和亚细胞定位不同:ROCK I 主要在肝、肺、肾、脾和睾丸等器官中表达,ROCK II 优先在脑和肌肉中表达;ROCK I 与中心体、质膜、细胞-细胞接触、细胞粘附位点和囊泡共定位,ROCK II 多位于细胞质中与中心体结合、与肌动蛋白和波形蛋白共定位。在ROCK 被RhoA 活化后,进一步磷酸化下游底物,如LIM 激酶 (LIM kinase, LIMK)、肌球蛋白轻链 (myosin light chain, MLC)、豆蔻酰化富丙氨酸C 激酶底物 (myristoylated alanine-rich C-kinase substrate, MARCKS) 等,调节细胞粘附、迁移、细胞周期进程以及基因表达等功能。具体而言,ROCK 磷酸化LIMK 后可直接抑制cofilin,促进肌动蛋白丝的稳定;也可通过磷酸化MLCP (myosin light chain phosphase, MLCP),抑制MLCP 对MLC 的抑制作用从而间接激活MLC 或者直接磷酸化激活MLC,从而激活肌球蛋白。通过对肌球蛋白和肌动蛋白的调节促进软骨细胞骨架重组和应力纤维形成,并通过膜整合素在细胞局部形成黏着斑复合物。整合素和粘着斑复合物又可以将细胞外化学和机械信号传递到细胞中,并激活Rho 家族小G 蛋白从而反馈调节细胞骨架的组装,对于骨骼组织的生长发育至关重要。此外,有研究发现ROCK 还可磷酸化下游底物MARCKS,参与炎性疼痛和神经病理性疼痛调节[3](见图1)。
二、RhoA/ROCK 信号通路与软骨细胞
1. 细胞软骨与细胞骨架
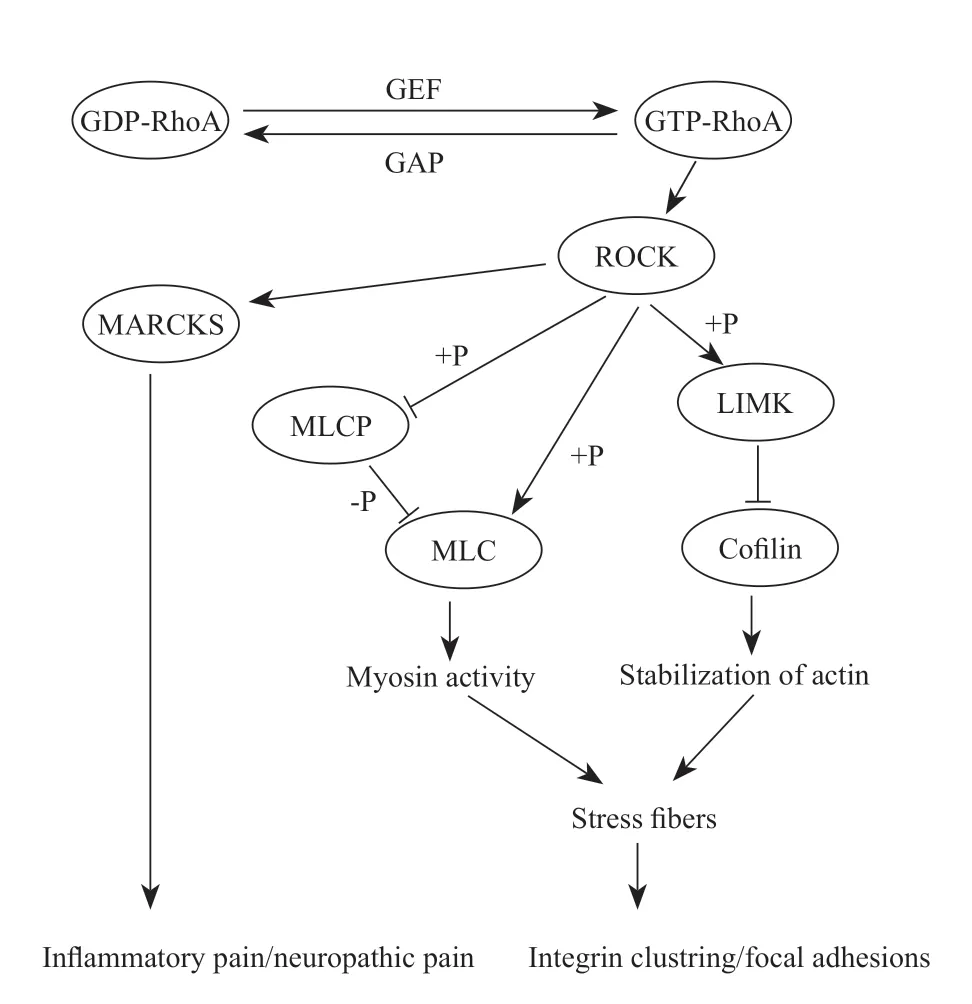
图1 RhoA/ROCK 信号通路对细胞骨架的调节 +P:磷酸化;-P:去磷酸化;GDP-RhoA:失活的RhoA 蛋白;GEF:鸟嘌呤核苷酸交换因子;GAP: GTP 酶 活 化 蛋 白;GTP-RhoA: 激 活 的RhoA 蛋白;ROCK: Rho 相关蛋白激酶;MARCKS:豆蔻酰化富丙氨酸C 激酶底物;MLCP:肌球蛋白磷酸酶;MLC:肌球蛋白轻链;LIMK: LIM 激酶;cofilin:丝切蛋白;Myosin activity:肌球蛋白激活;Stabilization of actin:肌动蛋白稳定;Stress fibers:应力纤维;Inflammatory pain/neuropathic pain:炎性疼痛/神经病理性疼痛;Integrin clustering/focal adhesions:整合素聚集/黏着斑
关节软骨无血管、神经、淋巴管,老化退变或者运动损伤后难以恢复正常。软骨细胞作为成人关节软骨的主要细胞,在分化成熟时呈圆形或多边形,参与维持细胞外基质的合成和降解之间的动态平衡,其形态和功能的改变与OA 关系密切。细胞骨架 (cytoskeleton) 指真核细胞中蛋白质纤维网构成的三维网状结构,由微丝、微管及中间纤维组成,三者主要成分为肌动蛋白、微管蛋白和波形蛋白。细胞骨架通过整合素介导细胞内外信号传导,调节细胞物质传输、细胞分化、细胞形态维持稳定等功能。三种细胞骨架系统相互作用,影响软骨细胞的形态和机械反应性的改变,如微管可通过其合成和分解期间对鸟嘌呤核苷酸交换因子H1 (guanine nucleotide-exchange factors H1, GEF-H1) 的控制来调节微丝。GEF-H1 与微管结合时失活,微管解聚时释放出GEF-H1 激活Rho 蛋白,通过促进肌动蛋白稳定促进应力纤维形成和细胞收缩[4]。RhoA/ROCK信号也可通过调节蛋白波形蛋白参与TNF-α 介导的内皮细胞凋亡[5]。在这三种细胞骨架调节中,研究的最多、最透彻的是微丝骨架。
2. RhoA/ROCK 信号通路与微丝骨架
RhoA/ROCK 信号通路可直接调控微丝骨架重塑,导致关节软骨退变。在微丝骨架重塑过程中,RhoA 磷酸化ROCK 后通过LIMK 和MLC 调节肌球蛋白和肌动蛋白,促进细胞骨架重组和应力纤维形成,而应力纤维的形成被认为是软骨细胞退变的标志。软骨细胞中,RhoA/ROCK 信号通路可被多种因素激活,如Liang 等[6]发现OA 病人关节软骨中瘦素可激活RhoA/ROCK/LIMK/cofilin 途径促进肌动蛋白聚集,导致细胞微丝骨架改变和应力纤维的生成,促进软骨退变。Takaoka 等[7]发现过表达FKBP51 也可激活RhoA/ROCK 信号通路,引起细胞微丝骨架重排和张力纤维形成。
3. 透明质酸与RhoA/ROCK 信号通路
透明质酸 (hyaluronic acid, HA) 是由D-葡萄糖醛酸和N-乙酰-D-葡糖胺两种单糖重复组成的线性多糖。HA 作为细胞外基质的主要成分,在关节组织中具有润滑、减震以及营养等功能,其正常合成有助于关节软骨的生成和损伤修复。CD44 作为HA的主要受体之一,其细胞外结构域的保守碱性残基簇可与细胞外基质结合,细胞内结构域与细胞内信号蛋白如GEF、细胞骨架蛋白,如锚蛋白和Ezrin/Radixin/Moesin (ERM) 等结合,调节细胞内外信号传导。
在肿瘤研究中,大量研究表明HA 结合CD44可激活RhoA/ROCK 信号通路,促进肿瘤发展。如乳腺癌中HA 结合CD44 可激活p115RhoGEF,促进RhoA 信号传导,导致乳腺肿瘤细胞的转移。但是HA 在OA 中作用机制的作用却相对复杂。关节内注射HA 可缓解OA 疼痛、改善关节功能,但该法治疗膝OA 的确切机制不明。有研究表明,外源性HA 可促进软骨蛋白多糖、糖胺聚糖的合成,具有抗炎和维持软骨弹性作用,然而外源性HA 治疗效果却存在明显的差异性。此外,如前所述,激活RhoA/ROCK 信号通路后细胞骨架重组、应力纤维形成和软骨细胞退变,属于软骨细胞的损害因素,在肿瘤学研究中也可观察到HA 介导CD44 激活RhoA 信号后促进细胞骨架重组和应力纤维改变,增强肿瘤转移性。这种HA 介导的RhoA/ROCK 信号通路激活导致的损伤性效应与临床上应用HA 产生的保护作用是相悖的。推测这种反差结果产生的原因可能是组织细胞间的差异或者病人关节滑液中裂解HA 的透明质酸酶的水平差异以及HA 结合CD44 信号后可能通过多种信号通路调节软骨形态和生理功能。
4. 透明质酸合成酶与RhoA/ROCK 信号通路
HA 由透明质酸合成酶 (hyaluronan synthase, HAS) 在细胞质膜的内表面合成。HAS 共3 种同工酶:HAS-1、HAS-2 和HAS-3,不同的HAS 同工酶调节方式、表达水平以及活性不同,催化合成的内源性HA 也不同。有间接证据表明HAS 活性受蛋白激酶C (PKC)、蛋白激酶A (PKA) 以及钙依赖性蛋白激酶调节。HAS 不仅是HA 的合成酶,还可能是细胞活动的重要调节剂。Moffatt 等[8]研究发现敲除小鼠HAS-1 或HAS-3 基因后,小鼠仍可以存活,而敲除Has2 基因的小鼠在出生时便已死亡,其胚胎期骨骼发育也出现异常。Chan 等[9]研究发现,缺乏HAS-1 的小鼠在膝关节软骨损伤后尽管整体HA 产生没有缺陷,但是随着时间推移,关节内出现广泛的瘢痕形成和严重的OA 症状,同时也不能像野生型小鼠那样较好的控制关节损伤后的炎症和软骨修复。但是,HAS 究竟是通过催化生成内源性HA 参与软骨细胞保护作用,还是自身通过多种途径通过RhoA/ROCK 信号通路调节软骨细胞,目前国内外尚无相关研究。
5. 机械传导与RhoA/ROCK 信号通路
关节软骨没有血管,因此适宜的机械刺激有利于基质的滑液扩散来滋养软骨细胞,而过度的机械刺激则对软骨细胞有损伤作用。过度的机械刺激作用于软骨细胞,可激活RhoA 信号传导,通过ROCK 或mDia 启动肌动蛋白重塑、应力纤维重新定向,影响整合素和黏着斑生成,介导细胞内外的信号转导,促进软骨退变。如Sanz-Ramos 等[10]发现RhoA 基因表达程度随着关节软骨外部机械传导应力的增加而增加,Fujiwara 等[11]研究发现RhoA的靶向GEF 之一ARHGEF40 (Rho guanine nucleotide exchange factor40, ARHGEF40),在机械应力刺激下可激活RhoA 并在细胞与细胞粘附位点形成厚实的肌动蛋白应力纤维,而ARHGEF40 的敲低抑制了张力引起的RhoA 活化和应力纤维生成增加。p120-连环蛋白 (p120-catenin, p120ctn)则抑制RhoA/ROCK-1 信号通路的表达来保护软骨细胞免受间歇性循环机械张力造成的损伤[12]。
6. RhoA/ROCK 信号通路与软骨退变
软骨退变是OA 发生的机制之一,RhoA/ROCK 信号通路与软骨细胞退变密不可分。软骨细胞成熟时呈圆形或多边形,当软骨细胞发生去分化现象时会慢慢变为长梭形,软骨前体细胞也会逐渐变为成纤维细胞,同时伴RhoA/ROCK 信号通路表达升高,细胞骨架重组、应力纤维生成,细胞外基质如透明质酸、II 型胶原、氨基葡萄糖等减少,特征性基因如Sox9 (Sry box-containing gene 9, Sox9)、II 型胶原 (type II collagen, Col2a1)等表达降低。如前所述,OA 病人关节软骨中的瘦素可激活RhoA/ROCK 信号通路,引起肌动蛋白聚集,导致细胞微丝骨架改变和应力纤维的生成,促进软骨退变[6]。过度的机械刺激也可以刺激细胞内外的机械传导信号通路,激活RhoA/ROCK 信号通路,促进软骨退变[10,11],而抑制RhoA/ROCK 信号通路则可以保护软骨细胞免受间歇性循环机械张力造成的损伤[12]。透明质酸与CD44结合可引起软骨细胞代谢的改变,导致软骨细胞外基质降解和软骨细胞退变,其机制也与激活RhoA/ROCK 信号通路密不可分[13]。此外,Appleton 和Matsumoto 等[14,15]研究发现,TGF-α 可激活Rho/ROCK 信号通路,导致软骨细胞发生伸长、肥大等退变修饰,使用抑制剂C3 毒素转移酶 (toxin C3 transferase) 或Y27632 则可抑制退变,减少细胞外基质的降解,促进特征性基因表达。
由于关节软骨无血管、神经、淋巴管,软骨退变后再生能力有限。将多能干细胞在促分化为软骨细胞已成为抗软骨退变的一个研究热点。尽管多数研究表明激活RhoA/ROCK 信号通路可促进软骨细胞退变,但在促进不同细胞分化为软骨细胞的功能上,RhoA/ROCK 信号通路的作用是复杂的,受细胞类型和培养条件等因素的影响。如Woods 等[16]发现抑制RhoA 信号传导可以促进软骨前体细胞株ATDC5 形成软骨,同时软骨细胞成熟的特征性基因Sox9 的mRNA 水平升高,而过表达RhoA 则会抑制软骨前体细胞成熟。而在Zhong 等[17]的研究中发现,抑制RhoA/ROCK 信号通路却会抑制间充质干细胞分化成软骨,从而影响软骨细胞的发育和形成。类似的,Xu 等[18]发现TGF-β1 激活RhoA/ROCK 信号通路后可诱导滑膜间充质干细胞向软骨方向分化,同时伴Sox9、I 型和II 型胶原以及氨基葡萄糖等表达增加,在使用RhoA/ROCK 信号通路抑制剂后该效应被抑制。
三、RhoA/ROCK 信号通路抑制剂与OA 治疗
1. RhoA/ROCK 信号抑制剂
RhoA/ROCK 信号通路作用范围广,在血管生成、癌细胞迁移、青光眼、特发性肺疾病、勃起功能障碍、神经系统疾病和脊髓性肌萎缩等起着重要的作用。2016 年,Feng 等[19]对170 多种ROCK 抑制剂进行了综述,然而受到多种不良反应(如低血压或血管舒张)、生物利用度低、药物血浆半衰期短的影响,目前只有少数抑制剂在临床使用,如日本的法舒地尔用于脑血管痉挛和肺动脉高压,中国的瑞帕司他用于治疗青光眼和高眼压症,其他药物如辛伐他汀通过抑制RhoA/ROCK 信号通路发挥心脏保护、抗胰岛素抵抗等也进入临床研究,而在OA 治疗上,目前尚未见相关报道。
2. 预防软骨退变
尽管作用于OA 的RhoA/ROCK 信号通路抑制剂临床尚无应用,但在实验室研究中相关抑制剂已展现出良好的抗软骨退变和抗疼痛效应。如单层培养的人软骨细胞在培养几代后会向成纤维细胞形态发展并丧失软骨细胞特性,发生细胞去分化现象,使用ROCK 特异性抑制剂Y-27632 处理后可使软骨细胞保持圆形或多边形,SOX9、COL2A1 等特征性基因表达也高于未处理组细胞[15]。研究还发现,使用RhoA/ROCK 信号通路抑制剂后基质金属蛋白酶-3 (matrix metalloproteinase 3, MMP-3) 表达降低,转录因子ETS-1 (E26 transformation-specific-1, Ets-1) 与MMP-3 启动子结合位点之间的关联减弱,SOX9与聚集蛋白聚糖启动子之间的相互作用增强,细胞外基质降解减少[15,20]。RhoA/ROCK 信号通路抑制剂有望成为临床缓解OA 关节退变的新方向,具有巨大的市场潜力。
3.关节疼痛
OA 除关节功能障碍外,还常伴剧烈疼痛。常用镇痛药如NSAIDs 和阿片类药物常因胃肠道风险和中枢神经系统不良反应使用受限。此外,OA 疼痛产生的原因不明,炎症只是OA 疼痛的原因之一。OA 病人中仅有部分膝关节或髋关节检测到严重的滑膜炎症,且应用NSAIDs 的疗效并不理想。OA病人的疼痛是感觉、情感和认知过程的复杂整合,在神经系统的外周(关节)和中枢(脊髓)水平上常有异常细胞信号传导。因此,OA 病人镇痛需要外周和中枢同时入手,同时控制炎性/非炎性疼痛和神经病理性疼痛。
有研究表明,RhoA/ROCK 信号通路参与神经病理性疼痛和炎性/非炎性疼痛的发展和维持,其机制可能与RhoA/ROCK 信号通路激活后促进伤害性细胞因子如TNF-α 和IL-1β 的释放、cofilin 磷酸化后调节细胞骨架参与脊髓伤害感受加工以及NO介导的痛觉过敏的有关[21,22]。如丘玥等[23]研究发现辛伐他汀鞘内注射可抑制大鼠慢性神经病理性疼痛时的RhoA/ROCK 信号通路的激活,缓解疼痛。Takeshita 等[24]也发现单碘酸醋盐制造的大鼠OA模型中ROCK 表达升高,使用抑制剂AS1892802可抑制ROCK 的表达和缓解关节软骨退变,同时炎症因子如缓激肽、IL-1β、PGE2 等的分泌也明显减少,关节疼痛评分降低。临床前模型中也有证据表明ROCK 抑制剂具有神经保护作用。法舒地尔可增加运动神经元存活,抑制轴突变性,增强轴突再生和调节小胶质细胞功能的作用[25]。在临床使用中,RhoA/ROCK 信号通路抑制剂因低血压或血管舒张等不良反应影响而使用受限,然而Yoshimi 等[2]应用新型ROCK 抑制剂AS1892802 在炎症 (AIA) 和非炎症 (MIA) 疼痛的大鼠模型中都表现出良好的镇痛效应,既未观察到常规镇痛药的胃肠或者神经系统不良反应,也没引起大鼠明显的血压降低,展现出AS1892802 在控制炎性和非炎性疼痛方面的巨大优势。这些RhoA/ROCK 信号阻断剂的研究,为临床预防和治疗OA 以及缓解OA 疼痛提供了新的可能性。
四、RhoA/ROCK 信号通路靶点的应用前景
RhoA/ROCK 信号通路与软骨细胞骨架、软骨退变以及关节炎之间关系密切,瘦素、FKBP51、过度的机械刺激、透明质酸与CD44 受体结合、TGF-α 等多种因素可激活RhoA/ROCK 信号通路,对软骨细胞既有积极抗凋亡作用,又有消极的促进软骨退变、推动OA 进展的作用,同时也参与OA的疼痛调节。在如此复杂的调控关系网中,RhoA/ROCK 信号通路以及相关因子对OA 的发生、发展带来什么影响,如何靶向性的在不同组织、不同途径调控其表达,以及相关靶点的新药值得我们深入研究。相信通过对RhoA/ROCK 信号通路和相关因子调控的研究,以及相关靶点药物的研究有望对OA 的发病机制、预防和治疗带来新思路与方法。

