0.05%/0.05%他扎罗汀倍他米松乳膏治疗轻中度寻常型银屑病多中心疗效观察
陈浩 杨海珍 顾军 温海 李明 刘晓明 郝飞 娄冬华 孙建方
1中国医学科学院 北京协和医学院 皮肤病医院,南京210042;2北京大学第一医院皮肤科100034;3第二军医大学长海医院皮肤科,上海200072;4第二军医大学长征医院皮肤科200003;5复旦大学附属中山医院皮肤科,上海200032;6大连医科大学附属第一医院皮肤科,大连 116011;7 陆军军医大学第一附属医院皮肤科,重庆400038;8南京医科大学生物统计学系211166
刘晓明现在香港大学深圳医院皮肤科518053;郝飞现在重庆医科大学附属第三医院皮肤科401120
局部外用药为治疗轻中度银屑病的一线药物。0.05%/0.05%他扎罗汀倍他米松乳膏为重庆华邦制药有限公司开发的治疗银屑病的局部外用复方制剂,经国家药品监督管理局批准进行临床研究(批件号:2007L04104)。本临床研究旨在初步评价0.05%/0.05%他扎罗汀倍他米松乳膏治疗寻常型银屑病的疗效和安全性。
对象与方法
一、对象
入选标准与排除标准同文献[1],临床研究时间为2009年7月至2010年1月。
二、试验药物与方法
1.试验药物:受试药物为0.05%/0.05%他扎罗汀倍他米松乳膏(15 g/支,批号20081105)。对照药物为0.05%二丙酸倍他米松乳膏(15 g/支,批号20081007)、0.05%他扎罗汀凝胶(15 g/支,批号20081001)。以乳膏基质(15 g/支,批号:20081101或20081102)为模拟剂。试验药物、对照药物和模拟剂均由重庆华邦制药有限公司提供。
2.试验分组:本研究为多中心、随机、盲法、单模拟、平行对照临床研究,通过中国医学科学院皮肤病医院伦理委员会批准(批号:2008 临审第47 号)。由统计专业人员使用SAS 软件生成随机数字,保证受试者按2∶1∶1∶1比例随机分入0.05%/0.05%他扎罗汀倍他米松乳膏(Taz/Bp)组、0.05%二丙酸倍他米松乳膏(Bp)组、0.05%他扎罗汀凝胶(Taz)组、安慰剂(Plb)组。
试验开始之前,所有药物按照随机盲法要求分装,每个编号含2 管药物。试验药、对照药及模拟剂的规格、包装完全一致,外包装贴相同标签。由与本次试验无关人员完成药品分装及应急信件的准备,药品随机编盲后的药物编号即为患者随机号,盲底一式二份,分别存于中国医学科学院皮肤病医院和申办单位。各个应急信件随相应编号的药物发往各中心。随机方法及分组情况均对研究者和受试者保密。
各组受试者用药方案见表1。将药物均匀涂于皮损区域,早晚各1次,连续用药4周。避免药物接触眼睛和其他黏膜部位;避免日晒。治疗2周自觉无效者可中止试验进行其他治疗。
三、疗效观察和评估
1.观察方法:同文献[1]。
2.疗效评估:主要疗效指标为治疗4周后各组达到PASI75的受试者比例。次要疗效指标包括每次随访时各组达到PASI75、PASI90 的受试者比例及PASI 下降率和下降值。PASI 下降值= 治疗前PASI-治疗后PASI,PASI下降率=PASI下降值/治疗前PASI×100%
3.安全性评估:同文献[1]。
四、统计学方法
采用SAS 9.1.3软件。PASI评分下降率和下降值的比较采用中心效应的两因素方差分析,并用LSD-t检验进行两两比较,P <0.05为差异有统计学意义。分类指标的比较采用χ2检验或Fisher 精确检验法,组间比较时,相差最大、次大的组间比较,检验水准α值依次采用0.05、0.025、0.016 7。
结 果
一、一般资料
1. 试验完成情况:本研究的7 个中心共纳入300例受试者,年龄18 ~64岁,男196例,女104例;其中,中国医学科学院皮肤病医院70例,北京大学第一医院40 例,长海医院40 例,上海长征医院40 例,复旦大学附属中山医院30例,大连医科大学附属第一医院30 例,陆军军医大学第一附属医院50例。全分析集(FAS)和安全性分析集(SAS)均为300 例。符合方案集(PPS)269 例(脱落26 例,剔除5 例),其中Taz/Bp 组106 例,Plb 组57 例,Taz 组53 例,Bp组53例。26例脱落受试者包括失访18例(Taz/Bp 组8例、Bp 组5例、Taz 组3例、Plb 组2例),自觉效果不佳5例(Taz/Bp组1例、Bp组1例、Taz组2 例、Plb 组1 例),未能缓解而选用其他疗法1 例(Taz 组),病情恶化1 例(Taz 组),依从性差1 例(Taz/Bp 组)。被剔除的受试者包括Taz/Bp 组使用影响疗效评价的禁用药物2例,Taz/Bp组误纳1例,Taz/Bp组撤回知情1例,Bp组严重超窗1例。
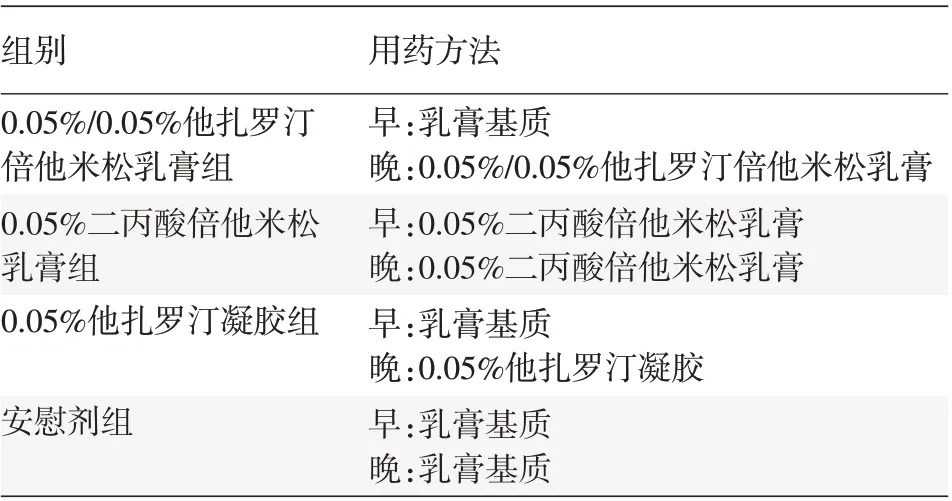
表1 各组寻常型银屑病患者用药方案
2.基线特征:各组受试者的年龄、性别、病程、身高、体重、身体质量指数、治疗史、伴随疾病等情况差异均无统计学意义(P >0.05)。Taz/Bp 组、Bp组、Taz组、Plb组基线PASI评分分别为5.63±3.19、6.99±3.96、6.20±3.32、5.75±3.09,差异无统计学意义(F=2.36,P >0.05)。
3.依从性和合并用药:能追溯到用药量的受试者用药依从性均达到80%~120%,各组依从性差异无统计学意义(P >0.05)。治疗期间,各组有合并用药情况的比例差异无统计学意义(P >0.05)。除2例受试者因合并使用禁用药物被剔除外,无其他违背方案的合并用药。
二、疗效
1. PASI75:1 周时,4 组间PASI75 比例差异无统计学意义(P >0.05)。2周、4周时,4组间PASI75比例差异有统计学意义(均P <0.05),Taz/Bp 组的PASI75 比例显著高于Taz 组和Plb 组(P <0.025或<0.05),与Bp 组比较差异无统计学意义(P >0.016 7)。见表2。PPS分析结果与FAS相似。
2.PASI90:1 周时,各组均无达到PASI90 的受试者。2 周时,4 组间PASI90 比例差异无统计学意义(P >0.05)。4周时,4组间PASI90比例差异有统计学意义(P <0.05),Taz/Bp 组高于Plb 组(P <0.05)、Taz 组(P <0.025)及Bp 组(P <0.0167)。见表2。PPS分析结果与FAS相似。
3.PASI评分下降率和下降值:FAS分析结果显示,3次随访时4组的PASI评分下降值差异均有统计学意义(均P <0.05),Taz/Bp组均高于Taz组、Plb组(均P <0.05),Taz/Bp组与Bp组差异均无统计学意义(均P >0.05)。见表3。
FAS 分析结果显示,3 次随访时4 组的PASI 评分下降率差异均有统计学意义(均P <0.05),1周、2 周时,Taz/Bp 组均高于Taz 组、Plb 组(均P <0.05),Taz/Bp 组与Bp 组差异均无统计学意义(均P >0.05);4 周时,Taz/Bp 组均高于Taz 组、Bp 组、Plb组(均P <0.05)。见表3。

表2 各组寻常型银屑病患者达银屑病皮损面积和严重程度指数(PASI)75和PASI90比较(FAS集)
表3 各组寻常型银屑病银屑病皮损面积和严重程度指数下降值及下降率比较(±s)(FAS集)

表3 各组寻常型银屑病银屑病皮损面积和严重程度指数下降值及下降率比较(±s)(FAS集)
注:a 与他扎罗汀倍他米松乳膏组比较,P <0.05
组别他扎罗汀倍他米松乳膏组二丙酸倍他米松乳膏组他扎罗汀凝胶组安慰剂组F值P值例数120 60 60 60下降值下降率(%)1周1.48±1.53 1.29±1.68 0.69±1.66a 0.88±1.38a 4.40 0.005 2周2.46±2.14 2.41±2.57 1.45±2.03a 1.37±1.70a 5.94<0.001 4周3.50±2.76 3.30±3.08 2.26±3.09a 1.72±1.94a 8.06<0.001 1周25.70±20.46 20.01±18.71 13.10±23.45a 12.26±27.17a 6.97<0.001 2周42.56±27.05 34.17±24.63 25.78±27.60a 20.35±33.03a 10.03<0.001 4周61.33±29.22 46.58±28.93a 36.27±36.61a 26.35±38.78a 17.78<0.001
三、安全性
在整个研究期间,各组均无严重不良事件发生。治疗期间,4组不良事件发生率差异有统计学意义(P=0.036),重要不良事件发生率差异无统计学意义(P=0.472)。见表4。
4 组均可观察到药物不良反应,药物不良反应发生率差异有统计学意义(P=0.004),Taz/Bp组发生率低于Taz 组(P=0.004),与Bp 组和Plb 组比较差异无统计学意义(P >0.05)。见表5。药物不良反应主要表现为用药部位出现轻到中度的瘙痒、刺痛、灼热、红斑、脱屑等皮肤局部刺激症状,无需特殊处理或适当对症处理后均可缓解。未观察到皮肤萎缩、色素沉着等不良反应。见表5。

表4 各组寻常型银屑病不良事件及不良反应发生情况[例(%)]
各组于治疗前后进行血尿常规及肝肾功能检查。治疗后出现的实验室检查异常不良事件11 例。白细胞升高或减少3例,随访中未出现异常症状和体征,复查后正常。丙氨酸转氨酶和/或天冬氨酸转氨酶升高4 例,其中1 例有脂肪肝病史但未用药,出组前饮食控制不佳,1 例检查前通宵未眠,另外2例均于近期有饮酒史。血甘油三酯升高2例,1例诉近日高脂饮食,1例为餐后抽血,复查均正常。尿糖升高2例,次日复查均正常。根据受试者治疗前后检查情况及基础疾病、生活习惯等原因综合考虑,认为与研究药物可能无关。
讨 论
他扎罗汀和二丙酸倍他米松均为国内外指南推荐的治疗轻中度银屑病的一线外用药物[2-3]。已有临床研究表明[4-5],他扎罗汀联合糖皮质激素治疗银屑病具有效果好、起效迅速、复发率低、不良反应发生率低的特点。基于前期的非临床研究和人体耐受性试验[6]结果,在他扎罗汀倍他米松乳膏治疗寻常型银屑病的剂量探索研究[1]中,选择他扎罗汀和二丙酸倍他米松浓度配比分别为0.025%/0.025% 、0.05%/0.025% 、0.025%/0.05% 、0.05%/0.05%的4 种乳膏制剂,每日1 次连续用药4 周,评价不同浓度配比的疗效和安全性,结果显示,0.05%/0.05%浓度配比的疗效和安全性优于其他试验组。

表5 各组寻常型银屑病发生的局部药物不良反应情况[例(%)]
此次临床研究采用0.05%/0.05%他扎罗汀倍他米松乳膏,旨在评价0.05%/0.05%他扎罗汀倍他米松乳膏每日1 次治疗寻常型银屑病的疗效和安全性。在试验中采用已在国内上市的0.05%二丙酸倍他米松乳膏和0.05%他扎罗汀凝胶作为阳性对照药物。0.05%二丙酸倍他米松乳膏的剂量为临床常用的每日2 次,0.05%他扎罗汀凝胶的用量为每日1 次;考虑到复方制剂的两种组分具有协同作用[4-5],0.05%/0.05%他扎罗汀倍他米松乳膏采用每日1次的用药方法。
随着治疗的进行,各组PASI评分逐渐下降,明显低于用药前;Taz/Bp 组PASI 评分的改善情况最明显,其下降值及下降率显著高于Plb 组和Taz组。Taz/Bp 组PASI评分下降率高于Bp组,而PASI评分下降值与Bp 组相当。用药4 周,Taz/Bp 组的PASI75比例显著高于Plb组和Taz组,与Bp组差异无统计学意义。
Taz/Bp 组不良反应发生率与Plb 组、Bp 组相当,明显低于Taz 组,表明复方较单方的不良反应减少,安全性提高。
综合分析研究结果表明,0.05%/0.05%他扎罗汀倍他米松乳膏治疗寻常型银屑病具有良好的疗效和安全性。但同时本研究还存在样本量小,治疗时间短且未考察复发、反跳和长期安全性等缺点,需要在更大样本量的后期临床研究中进一步确证其临床疗效,以及考察长期用药的安全性。
利益冲突 他扎罗汀倍他米松乳膏为化学药品注册分类1.5 类的新药,本试验为他扎罗汀倍他米松乳膏上市前临床试验的一部分,属于Ⅱb 期临床研究,试验数据已上报国家药品监督管理局,并作为他扎罗汀倍他米松乳膏批准上市的支持证据之一。重庆华邦制药有限公司作为申办方,提供本次试验使用的试验药物,向研究中心的临床研究机构支付了本次试验所需的经费,并按照《药品临床试验管理规范》(GCP)中的要求对本次试验的实施过程进行了监督。除此之外,重庆华邦制药有限公司与本文作者之间无其他资助或服务关系

