贵州黑山羊BMP15基因多态性及生物信息学分析
李平 李潇蒙 龙清孟
关键词:贵州黑山羊;BMP15;SNPs;生物信息学
骨形态发生蛋白15(BMP15)又称生长分化因子9B,不仅能够促进颗粒细胞分裂、分化,而且能够抑制颗粒细胞中FSHR基因的表达[1],同时能够促进卵泡发育[6-7]。BMP15基因由1个内含子与2个外显子构成,2个外显子被内含子隔开,外显子全长1 176 bp,共编码393个氨基酸残基的前蛋白。通过大量研究发现,BMP15基因可能与高繁殖性状有关,研究人员已在国内优良地方品种的绵羊上对BMP15基因展开相关研究,以期为构建高繁殖力群体奠定基础。目前,已在少数绵羊品种上发现BMP15基因与繁殖性状有关联,在小尾寒羊上发现BMP15基因B2处突变对高繁殖性状影响作用十分明显[4-5]。程俐芬等人研究发现BMP15基因在第一外显子中虽存在突变位点,但对绵羊繁殖性状并没有显著影响[3]。吴翠玲等研究6个绵羊群体发现,BMP15基因外显子1上在58~60 bp处有3个碱基(CTT)缺失[1]。本研究通过PCR产物直接测序技术并结合生物软件对贵州黑山羊BMP15基因进行多态性研究与生物信息学分析,预测mRNA二级结构、蛋白质二级结构、三级结构,以期为今后研究贵州黑山羊繁殖性状提供理论依据。
1 材料与方法
1.1 血液DNA提取
102只贵州黑山羊血液样本,来自册亨县冗渡镇贵州领头羊山地草牧业科技有限公司。血液DNA提取采用天根血液基因组DNA提取试剂盒,提取后用1%琼脂糖凝胶电泳对DNA进行检测,检测结果发现条带清晰明亮、无RNA和蛋白质等污染。通过微量紫外分光光度计检测DNA质量D260 nm/D280 nm均在1.8~2.0之间,说明DNA提取效果好,纯度高。
1.2 引物设计与合成
根据NCBI数据库中绵羊BMP15基因序列(登录号:NM_001114767.1)利用Primer 5.0软件设计2对引物,其目的片段覆盖全部外显子区域,引物序列见表1。引物合成由上海英潍捷基贸易有限公司完成。
1.3 PCR扩增
贵州黑山羊基因组DNA采用天根血液基因组DNA提取试剂盒提取,以提取的DNA为模板进行PCR扩增。PCR反应体系为20.0 μL:PCR Mixture 10.0 μL,上、下游引物各1.5 μL,DNA2.0 μL,蒸馏水5.0 μL。PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,退火(退火温度见表1)30 s,72 ℃延伸1 min,35 個循环;72 ℃延伸5 min;4 ℃保存。PCR扩增产物用1%;琼脂糖凝胶电泳检测。
1.4 PCR扩增产物测序和基因序列分析
PCR扩增产物,送往上海英潍捷基贸易有限公司进行双向测序。测序结果利用SeqMan软件进行序列分析,采用MWSnap测量SNPs等位基因的峰高值,根据Ai=Bi/(Ba+Bb),i=a,b公式估算各等位基因频率。利用生物信息学软件进行mRNA二级结构预测,蛋白质二级、三级结构预测。
2 结果与分析
2.1 DNA检测结果
采用1%的琼脂糖凝胶电泳对血液DNA进行检测,电泳结果显示基因组条带整齐、清晰明亮、无RNA和蛋白质等污染,并利用紫外分光光度计测量D260 nm/280 nm均在1.8~2.0范围内。检测DNA结果表明提取的DNA可用于PCR扩增。
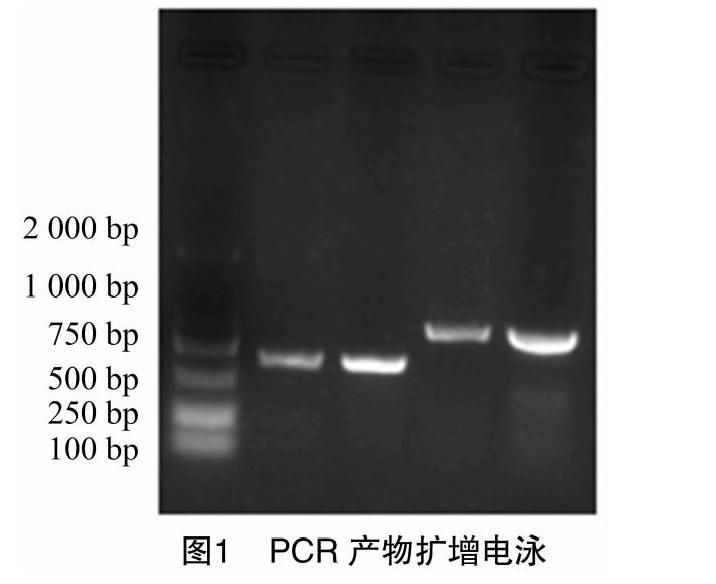
2.2 PCR扩增产物检测结果
以5 μL扩增产物为样本用1%的琼脂糖凝胶进行电泳检测,以1 000 bp DNA Ladder Maker作为分子量标记对照。检测结果见图1,PCR扩增产物条带整齐、清晰明亮、检测片段长度与目的片段一致,其扩增目的片段长度分别为632 bp和920 bp,表明2对引物的特异性较好。
2.3 扩增基因的测序
测序结果利用SeqMan软件查看,找到1个SNP位点,由图2可知,在第二外显子6 260 bp处发生C→G突变,exon2-C 6 260 bp,利用DNAStar中的EditSeq软件进行分析发现,BMP15基因编码的蛋白质突变前后发生改变,由Gln突变为Glu,第二外显子上的突变为错义突变。
2.4 SNPs等位基因频率估算
BMP15基因SNPs等位基因的峰高值利用MWSnap软件进行测量,将其测量值代入公式,利用公式估算出突变前后等位基因频率,突变前为0.485,突变后为0.515,数据结果显示突变前后有差异。
2.5 BMP15基因mRNA二级结构分析
利用EditSeq软件进行mRNA二级结构分析发现,BMP15基因mRNA的序列在突变前后翻译的氨基酸序列不同,使得mRNA结构改变。利用http://rna.tbi.univie.ac.at-bin/RNAfold.cgi软件进行mRNA二级结构预测,发现其突变前后的自由能均为-1 201.75 kJ/mol,突变前后具体的二级结构见图3。
2.6 BMP15的蛋白质理化特性分析
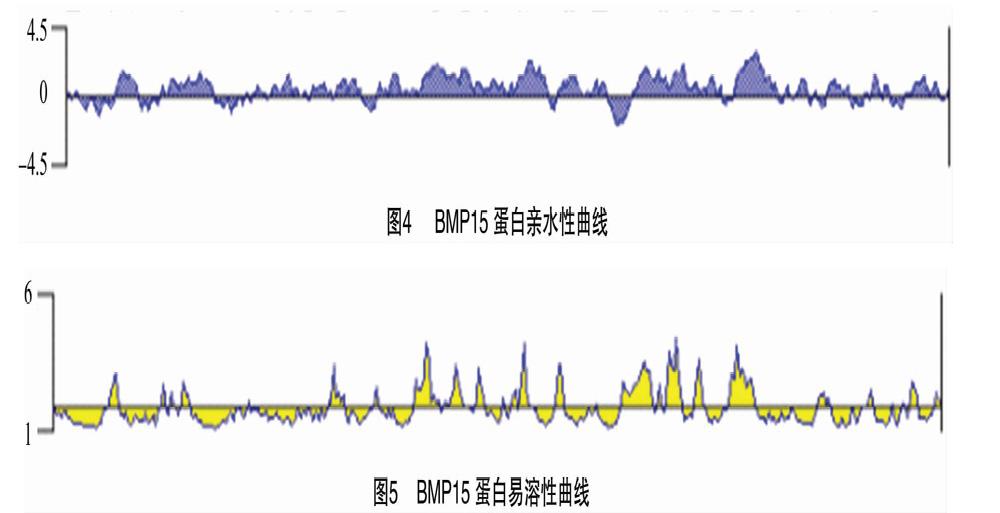
依照BMP15基因所编码的氨基酸序列,通过http://us.expasy.org/tools/protparam.html在线进行蛋白质理化特性分析。由表3可知,BMP15基因分子式突变前为C1828H2779N515O494S14,突变后为C1828H2778N514O495S14,在酵母菌中的半衰期突变前后均大于3 min,在人体外红细胞中半衰期突变前后均大于2.8 h,该蛋白属于不稳定性蛋白。利用Antheprot 63分析软件对BMP15蛋白的亲水性和易溶性进行分析,由图4、图5可知,BMP15蛋白的亲水指数范围为-1.91~2.72;易溶性较强,皆为正数,最大易溶性为3.97。综上分析,BMP15蛋白整体上表现为亲水性。利用在线跨膜蛋白数据库对BMP15的跨膜区域进行分析,由图6可知,实线表示跨膜方向由膜内向膜外,虚线表示跨膜方向膜外向膜内,2种跨膜方向皆是由正数到负数再到正数的顺序,此蛋白具有跨膜结构。
2.7 BMP15蛋白质二级结构分析
https://npsa-pr-abi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_Sopma.html网页在线进行蛋白质二级结构预测;结果显示,α-螺旋(Alpha helix)、β-转角(Beta turn)、扩展链、 无规卷曲在突变位点前后均有改变(表4)。利用Protean软件对BMP15蛋白质二级结构进行预测(图7)。
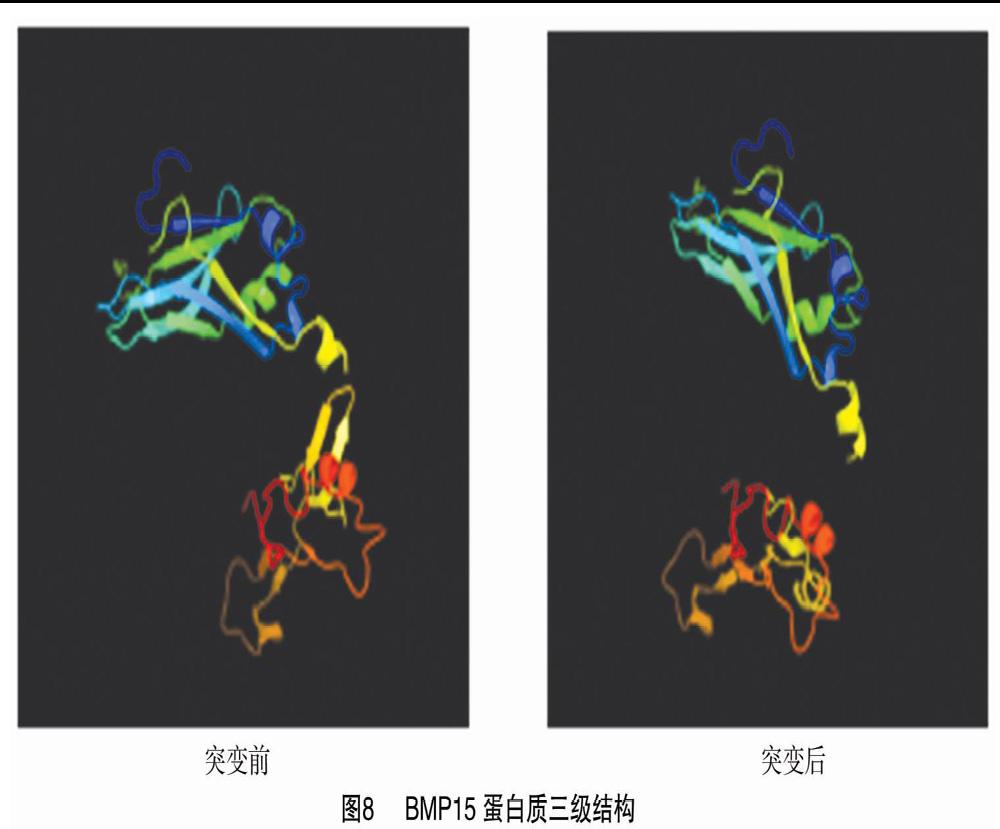
2.8 BMP15蛋白质三级结构分析
http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index网页在线进行蛋白质三级结构预测,分析显示突变前和突变后的变化具体结构,见图8。
3 讨论
近年,研究人员不断地挖掘BMP15基因突变位点[8-9],并且有研究发现BMP15基因是控制绵羊高繁殖性状的主效基因之一[10-11],目前已在Inverdale绵羊、Hanna绵羊和Lacaune绵羊等国外品种中发现BMP15基因与产羔性状相关的多个不同突变位点[15]。田志龙等人在绵羊上对BMP15基因进行多态性研究,发现g.50971423T > C位点处存在3种基因型,分别是TT、TC和CC,在单羔和多羔品种间其基因型频率和等位基因频率均差异显著(P<0.05)[12]。胡珊等对山羊BMP15基因进行生物信息学分析,发现山羊BMP15基因编码区长 1 185 bp,编码394个氨基酸,BMP15蛋白是一个具有亲水性的不稳定的碱性蛋白[2]。何远清等在6个山羊品种中找到了B4突变[13],林尖兵等也在贵州白山羊中找到了B4突变[14]。
本研究发现贵州黑山羊BMP15基因在第二外显子6 260 bp处发生C→G突变。朱韶华等研究发现BMP15第二外显子第755位点发生的T→C突变(AC型)对蒙古羊1胎产双羔影响十分显著[16]。通过生物信息学分析,结果显示,BMP15基因突变前后所编码的氨基酸序列发生改变,此突变为错义突
变;BMP15蛋白为具有跨膜结构的亲水性不稳定性蛋白。胡珊等研究发现,BMP15蛋白是一个不稳定的碱性蛋白[2]。本研究在BMP15基因上也有同样的发现。有研究表示,BMP15第二外显子的突变可能与动物繁殖性状相关,本研究在第二外显子上找到突变位点,后续将结合第二外显子突变与繁殖性状作进一步的研究,以期为今后与性状相关联研究提供理论依据。
参考文献:
[1]吴翠玲,宗兴龙,赵 卓,等. 6个绵羊群体BMP15、GDF9基因多态性分析[J]. 中国畜牧兽医,2018,45(8):2236-2246.
[2]胡 姗,方 乾,李 浩,等. 山羊BMP15基因生物信息学分析[J]. 家畜生态学报,2018,39(8):13-19.
[3]程俐芬,姬爱国,王清祥. 骨形态发生蛋白BMP15基因与绵羊繁殖性能关系的研究进展[J]. 中国畜牧兽医,2017,44(8):2392-2397.
[4]储明星,成 荣,陈国宏,等. 小尾寒羊和湖羊高繁殖力候选基因BMP15的研究[J]. 安徽农业大学学报,2005,32(3):278-282.
[5]黄顺国,额尔和花,王新燕等. 绵羊多胎基因BMPR-1B、BMP15的研究进展[J]. 农业科学研究,2007,28(3):68-71.
[6]Peng J,Wigglesworth K,Rangarajan A,et al. Aminoacid 72 of mouse and human GDF9 mature domain is responsible for homodimer bioactivities but has subtle effects on GDF9:BMP15 heterodimer activities[J]. Biology of Reproduction,2014,91(6):142.
[7]Paulini F,Melo E O. The role of oocyte-secreted factors GDF9 and BMP15 in follicular development and oogenesis[J]. Reproduction in Domestic Animals,2011,46(2):354-361.
[8]Lassoued N,Benkhlil Z,Woloszyn F,et al. Fec XBar: a novel BMP15 mutation responsible for proli?cacy and female sterility in Tunisian Barbarine Sheep[J]. BMC Genetics,2017,18(1):43-53.
[9]董新龙,胡文萍,贺小云. 等绵羊BMP15组织表达特征及Fec XGr、Fec XO 和 G971A 突变的检测[J]. 农业生物技术学报,2016,24(12):1810-1819.
[10]Galloway S M,Mc N P,Cambridge L M,et al. Mutations in an oocyte-derived growth factor gene(BMP15)cause increased ovulation rate and infertility in a dosage-sensitive manner[J]. Nature Genetics,2000,25(3):279-283.
[11]Hanrahan J P,Gregan S M,Mulsant P,et al. Mutations in the genes for oocyte-derived growth factors GDF9 and BMP15 are associated with both increased ovulation rate and sterility in Cambridge and Belclare sheep(Ovis aries)[J]. Biology of Reproduction,2004,70(4):900-909.
[12]田志龍,刘秋月,王翔宇,等. 绵羊BMP15基因多态性及其与产羔数的关联分析[J]. 中国畜牧杂志,2018,54(7):23-27.
[13]何远清,储明星,王金玉,等. 6个山羊品种高繁殖力候选基因BMP15多态性研究[J]. 安徽农业大学学报,2006(1):61-64.
[14]林尖兵,杜智勇,覃 成,等. 贵州白山羊BMP15基因多态性研究[J]. 畜牧与兽医,2007(12):21-24.
[15]朱 兰,兰 蓉,邵庆勇,等. 云南黑山羊新品种和龙陵黄山羊高繁基因的研究[J]. 畜牧与兽医,2018,50(2):1-6.
[16]朱韶华,张利平,马晓明,等. 3种绵羊BMP15基因第二外显子多态性及与产羔数的相关性分析[J]. 基因组学与应用生物学,2019,38(1):74-81.赵 位,喻 东,程建国,等. 林麝源肺炎克雷伯氏菌新LysR家族转录因子的原核表达[J].

