一株产纤维素酶细菌的发酵产酶条件优化
郭建华 张春强 郭宏文
关键词:产纤维素酶细菌;FPA酶;CMC酶;发酵条件优化
能源、环境及工农业原料生产等问题越来越影响着人们的日常生活,高产纤维素酶微生物的筛选对解决这些问题都十分重要[1-3]。大多数细菌所产纤维素酶与真菌来源的酶性质不同,某些方面具有真菌酶不可替代的作用[4]。細菌纤维素酶在饲料工业、洗涤剂工业及纺织工业中具有广泛的利用前景,因此在工业生产中的地位逐渐提高[5],其中产纤维素酶的芽孢杆菌成为近年来的研究热点[6]。本试验以从白酒酒醅中选育得到的产纤维素酶细菌菌株DM-4为试验菌株,利用单因素试验和响应面试验设计,优化其发酵产酶条件,为进一步的试验研究准备条件。
1 材料与方法
1.1 试验菌株
菌株DM-4,由笔者所在实验室从白酒酒醅中选育得到,经鉴定该菌株为枯草芽孢杆菌(Bacillus subtilis)。
1.2 培养基
种子培养基:牛肉膏0.5%,蛋白胨1%,NaCl 0.5%,pH值7.5~7.6,121 ℃下灭菌30 min。发酵培养基:CMC-Na 10 g,蛋白胨2.5 g,酵母浸出汁 1.0 g,NaCl 2.5 g,KH2PO3 0.5 g,硫酸镁0.1 g,琼脂10 g,去离子水500 mL,121 ℃下灭菌30 min。
1.3 纤维素酶活力测定方法
待测发酵液倒入离心管中,5 000 r/min离心 10 min,取上清液测定酶活。滤纸酶(FPA酶)活力测定:根据国际理论应用化学协会(IUPAC)的方法测定[7]。CMC酶活力测定见参考文献[8]。
1.4 菌株液体发酵产酶条件的优化
1.4.1 发酵时间的确定 发酵培养基内接入种子后,从12 h开始,每12 h取样测定酶活,直到72 h。
1.4.2 接种量的确定 按照1%、2%、3%、4%、5%和6%的接种量将种子液接入发酵培养基中,于37 ℃、摇瓶转速200 r/min的条件下发酵36 h后测酶活力。
1.4.3 培养基成分的优化
1.4.3.1 碳源的优化 (1)碳源种类的优化:以羧甲基纤维素钠(CMC-Na)、麸皮(过80目筛)、玉米粉、葡萄糖、蔗糖、淀粉和微晶纤维素作为唯一碳源(2%)配制培养基,接入种子后发酵36 h后测酶活力。(2)碳源浓度的优化:在优化碳源种类后,配制碳源浓度为0.5%、1%、1.5%、2%、2.5%、3%、35%和4%的发酵培养基,接入突变菌株发酵36 h后测酶活力。
1.4.3.2 氮源的优化 (1)氮源种类的优化:优化碳源后,以蛋白胨、豆饼粉(过80目筛)、大豆蛋白粉、硫酸铵、硝酸钾和尿素作为唯一氮源(0.5%)配制发酵培养基,接入种子后发酵36 h后测酶活力。(2)氮源浓度的优化:在优化氮源种类后,配制优化氮源浓度为0.1%、0.3%、0.5%、0.7%、0.9%和11%发酵培养基,接入种子后发酵36 h后测酶活力。
1.4.3.3 初始pH值的优化 分别配制pH值4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0碳氮源优化后发酵培养基,接入突变菌株发酵36 h后测酶活力。
1.4.3.4 磷酸盐浓度优化 配制K2HPO3浓度为01%、0.5%、0.9%、1.3%和1.7%的上述条件优化后的发酵培养基,接入突变菌株发酵36 h后测酶活力。
1.4.4 响应面设计试验 在上述优化基础上,根据Box-Behuken设计方法,采用minitab 16构建3因素(碳源浓度、氮源浓度和磷酸盐浓度)3水平响应面分析[9-10]。
1.4.5 统计分析 利用SPASS软件实现统计分析及差异显著性检验[11]。
2 结果与分析
2.1 发酵时间的确定
接入种子液后,从发酵12 h开始每隔12 h测定FPA酶活和CMC酶活,直到发酵后72 h,结果如图1所示。发酵时间为36 h时,菌株产FPA酶和CMC酶都表现出了比较高的酶活力,继续发酵到48 h会有少许增加,之后逐渐下降。经差异显著性检验,发酵36 h酶活与发酵48 h酶活差异不显著(P>0.05),而与其他发酵时间的酶活差异极显著(P<0.01),确定36 h为最优发酵时间。
2.2 接种量的确定
不同接种量下菌株发酵产酶结果见图2。随接种量提高,菌株产酶活力不断提高。接种量大于4%时,酶活提高量变小。经差异显著性检验,4%、5%和6%这3种接种量条件下的酶活差异不显著(P>0.05),综合考查,选择4%的接种量为优化条件。
2.3 初始pH值的优化
菌株DM-4在不同初始pH值条件下发酵产纤维素酶活力结果见图3。试验结果显示,初始pH值为5.5~6.0时,菌株DM-4产酶活性最高。显著性检验结果表明,初始pH值5.5条件下菌株所产酶活与初始pH值6.0条件下差异不显著(P>005),而与其他初始pH值条件下差异极显著(P<0.01),因此,确定最优产酶初始pH值为5.5~6.0。
2.4 培养基组分的优化
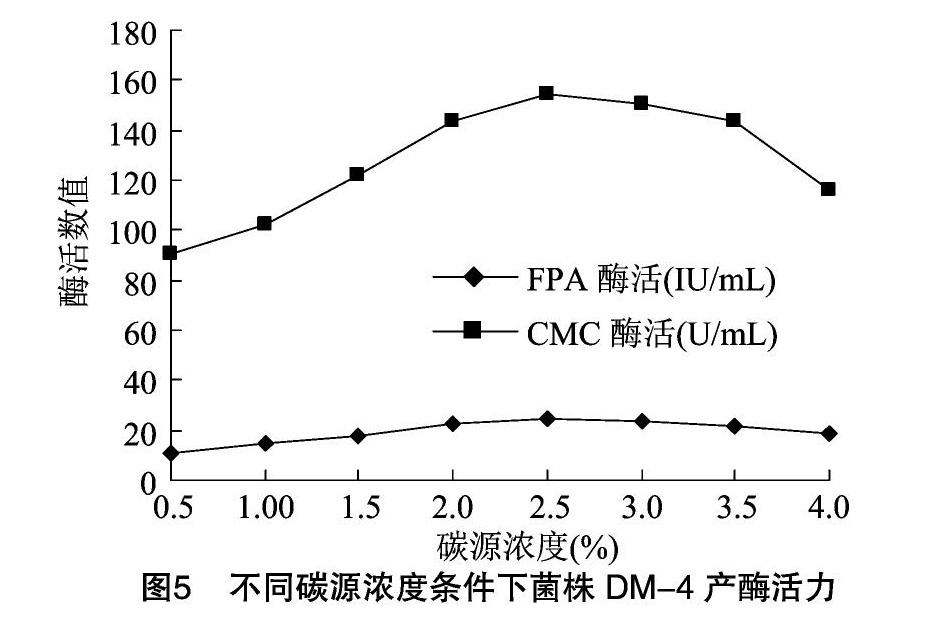
2.4.1 碳源的优化 分别利用不同碳源作为唯一碳源配制培养基进行发酵,结果见图4。总体分析,含有纤维素物质的碳源比不含纤维素物质的碳源所产酶活高。其中以麸皮为唯一碳源时产酶能力最强,与其他碳源比较差异极显著(P<0.01),确定麸皮为最优碳源。由图5可知,当麸皮浓度在 2.5% 以下时,随着麸皮浓度升高,酶活升高,超过2.5%时,酶活反而下降。在碳源浓度为2.5%时菌株所产酶活与其他浓度下所产酶活比较具有显著性差异。碳源浓度过低会造成营养不足,能源物质少,细胞不能生成足够的ATP满足菌体的生长代谢,菌体生长不良,产酶活性低;而碳源浓度过高时,能源物质充足,细胞生长快,同时发酵液黏度升高,溶氧不足,使细胞产酶量下降,降低活性。在本试验条件下选择麸皮浓度2.5%作为优化碳源浓度。
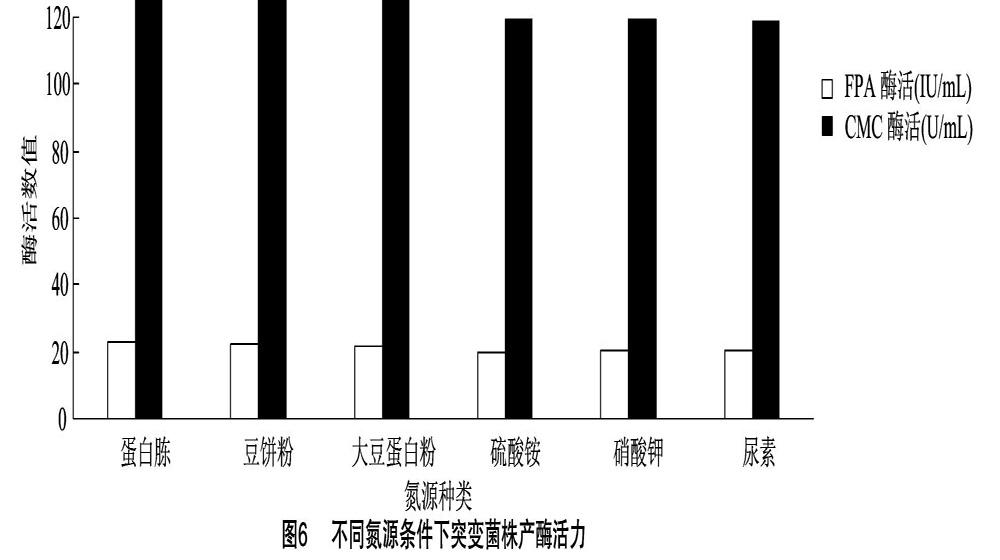
2.4.2 氮源的优化 分别以不同物质作为唯一氮源进行发酵试验,结果见图6。总体而言,有机氮源产纤维酶酶活性要比无机氮源稍高。差异显著性检测表明,蛋白胨、豆饼粉和大豆蛋白粉作为氮源时,其酶活之间差异不显著(P>005),而与硫酸铵、硝酸鉀和尿素作为氮源时的产酶活性差异极显著(P<0.01)。由于试验菌株是在酒醅中筛选出来的,经常年不断优化,适应了有机氮源的营养,同时,有机氮源中所含的营养,除氮源外还有其他营养成分,会促进菌体产酶。综合考虑,本试验以蛋白胨作为最佳氮源。氮源浓度优化试验结果(图7)显示,随氮源浓度增加,菌株产酶活力增加,当氮源浓度为0.9%时,菌株产酶活力最高,氮源浓度继续提高至1.1%后,酶活力少许下降。氮源是细胞合成产物的重要物质,数量过少,产物合成不足,数量过多,有可能造成底物抑制,细胞合成酶的数量降低,从而使菌体产酶活性降低。通过0.9%浓度时的酶活力与其他氮源浓度下的酶活力差异性比较可知,氮源浓度0.9%时,FPA酶活和CMC酶活与其他浓度下的酶活具有显著性差异(P<0.05),因此,选择氮源浓度为0.9%作为优化浓度。
2.4.3 磷酸盐浓度的优化 配制磷酸盐浓度分别为0.1%、0.5%、0.9%、1.3%和1.7%的培养基,接入菌株后进行发酵,36 h后测定纤维素酶活力,结果见图8。当磷酸盐(KH2PO3)浓度为 0.5% 时,菌株所产酶活最高。浓度进一步增加后,酶活反而下降。磷酸盐浓度很小时,磷元素不足造成细胞代谢缓慢,磷酸盐浓度过高,会引起细胞生长过快,导致营养物质只合成细胞而不产酶。显著性检验表明,在磷酸盐浓度为0.5%的条件下,与其他浓度条件下的酶活差异极显著(P<0.01),因此,确定磷酸盐0.5%的浓度作为优化结果。
2.3.5 响应面试验结果 选择碳源(麸皮)浓度、氮源(蛋白胨)浓度和磷酸盐(KH2PO3)浓度作为培养基组分优化因子(分别为X1、X2、X3)以FPA酶(Y1)和CMC酶(Y2)活力分别作为响应值设计试验方案。试验因子和水平见表1,试验方案和结果见表2。
使用mintab 16进行关于响应值与因子麸皮浓度(X1)、蛋白胨浓度(X2)和磷酸盐浓度(X3)的二次回归分析,去掉不显著因素,得到二次表达式:
Y1=29.81-X3-4.267 5X21-1.872 5X22-3.52X23-1.352 5X2X3;
Y2=134.14+2.355X1-1.383 8X3-6.913 7X21-3.091 2X22-5.166 3X23-1.837 5X2X3。
方程显著性检验结果如表3至表6所示,2个回归方程都具有显著性(R21=0.936,R22=0.949,P<0.01),失拟项不显著(P>0.05),剔除其他项后,保留的各项系数都具有显著性(P<0.05)。根据显著性检验结果可以得知,对于菌株产FPA酶活力来说,培养基中的麸皮浓度和蛋白胨浓度在二次水平上影响FPA酶的产生,磷酸盐浓度在一次水平和二次水平上都对FPA酶的产生具有显著性影响,麸皮浓度和蛋白浓度之间及麸皮与磷酸盐浓度之间不具有交互作用,而蛋白胨和磷酸盐之间对FPA酶的产生具有交互作用。对菌株所产CMC酶来说,麸皮浓度在一次水平上也会影响CMC酶活的生产,其他与FPA酶一致,由此说明,菌株所产的CMC酶活力是FPA酶活力的重要组成部分。
利用mintab 16软件绘出等值线图及响应面图(图9、图10)。等值线的形状反映因素间交互作用的大小,图形倾斜表示交互作用显著。结合方差分析和响应面图可知,蛋白质浓度与磷酸盐浓度交互作用具有显著水平,而麸皮与蛋白胨、麸皮与磷酸盐之间的交互作用不显著。
FPA酶优化后水平为:X1=0,X2=0.055 1,X3=-0.152 6;CMC酶优化后因子水平为:X1=0.170 3,X2=0.037 8,X3=0.141 4。考虑2种酶取因子水平平均值:X1=0.085 15,X2=0.046 45,X3=-0.005 6。对应的麸皮浓度为2.54%,蛋白胨为0.92%,磷酸盐为0.497%(取0.50%)。在此条件下利用回归表达式预测2种酶活力大小,FPA酶为29.78 IU/mL,CMC酶为134.29 U/mL。
2.4 优化结果验证
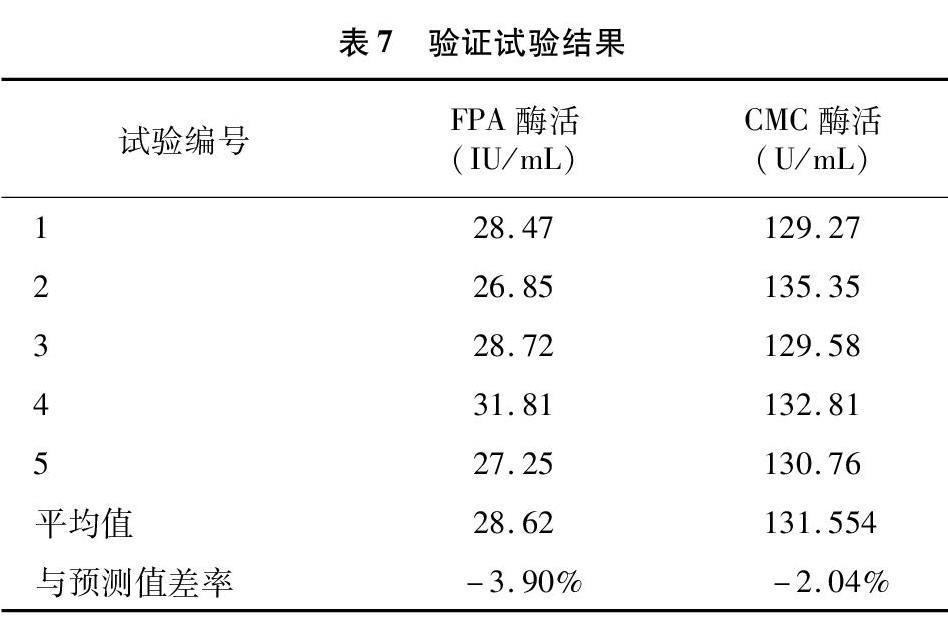
根据优化结果,在麸皮浓度2.54%、蛋白胨浓度0.92%、磷酸盐浓度0.50%、发酵初始pH值 5.5、接种量4%和发酵时间36 h的条件下对菌株进行5次产酶试验,检测产酶活力,并与模型预测值比较,结果如表7所示。
验证试验显示,在菌株所产纤维素酶活力与模型预测值接近,差率很小(<5%),由此可确定对菌株DM-4产酶条件的优化模型是有效和可靠的。
3 结论
利用单因素试验和响应面试验,确定产纤维酶菌株DM-4的产酶优化条件为:发酵时间为36 h,接种量4%,培养基初始pH值5.5~6.0,培养基麸皮浓度2.54%,蛋白胨浓度0.92%,磷酸盐浓度 0.5%。验证试验表明优化模型是有效和可靠的。
参考文献:
[1]Peter M,Zarnea G,Adrina P,et al. Biodegradation and bioconversion of cellulose wastes using bacterialb and fungalcells immobilized hydrogels[J]. Resources Conservation and Recycling,1999,27(5):309-332.
[2]Rabinovich M L,Melnick M S,Bolobova A V. The structure and
mechanism of action of cellulolytic enzymes[J]. Biochemistry-Moscow,2002,67(8):850-871.
[3]Chinnarjan R,Thangiah N,Govindaswamy R V. Optimization of alkaline cellulase production by the marine-derived fungus Chaetomium sp. using agricultural and industrial wastes as substrates[J]. Botanica Marina,2010,53(3):275-282.
[4]Taechapoempol K,Sreethawong T,Rangsunvigit P,et al. Cellulase-Producing bacteria from Thai higher termites,Microcerotermes sp.:enzymatic activities and ionic liquid tolerance[J]. Applied Biochemistry and Biotechnology,2011,164(2):204-222.
[5]Deka D,Jawed M,Goyal A.Purification and characterization of an alkaline cellulase produced by Bacillus subtilis (AS3)[J]. Preparative Biochemistry & Biotechnology,2013,43(3):256-270.
[6]Choudhuryl B,Chauhan S,Singh S N,et al. Production of xylanase of Bacillus coagulans and its bleaching potential[J]. World Journal of Microbiology & Biotechnology,2006,22(3):283-288.
[7]Ghose T K. Measurement of cellulase activity[J]. Pure and Applied Chemistry,1987,59(2):257-268.
[8]Nwagu K E,Ominyi M C,Nwoba G E. Isolation,screening and measurement of amylase and cellulase activities of some microorganisms[J]. Continental Journal of Biological Sciences,2012,6(1):37.
[9]Wang G G. Adaptive response surface method using inherited Latin hypercube design points[J]. Journal of Mechanical Design,2003,125(2):210-220.
[10]Steinberg D M,Bursztyn D. Response surface methodology in biotechnology[J]. Quality Control & Applied Statistics,2011,22(2):109-110.
[11]Hoshino T,Hashimoto T,Shigemasu K. A bayesian significance test for the difference and linear combination of factor means between groups[J]. Japanese Journal of Educational Psychology,2001,49(1):31-40.李林紅,李孟涵. 农产品图文呈现与在线评论不一致性对销量的影响——以苹果为例[J].

