虾青素介导Nrf2信号通路对大强度运动诱导大鼠肾脏损伤的保护作用
李锋 曹卉 曹建民

摘 要:目的:觀察补充虾青素能否介导核因子E2相关因子2(Nrf2)信号通路,缓解长时程、大强度运动诱导的氧化应激,降低肾脏细胞凋亡水平,保护大鼠肾脏结构/功能的正常。方法:7周龄SD雄性大鼠,适应性饲养及训练后随机分为对照组(C组,10只),大强度训练组(HT组,15只),虾青素+大强度训练组(HTA组,15只)。C组无运动干预,HT和HTA组进行6周递增负荷跑台训练。训练期间HTA组以虾青素溶液灌胃,每天1次,剂量为20 mg/kg/d,其他组灌胃等体积大豆油。末次训练结束后24 h取材,测定血清肌酐(Cr)和尿素氮(BUN)水平,测定肾脏凋亡指数、B细胞淋巴瘤因子-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、Nrf2、p-Nrf2、血红素加氧酶-1(HO-1)蛋白表达及肾脏组织总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)活性和丙二醛(MDA)浓度。结果:与C组相比,HT组大鼠肾脏组织形态发生病理改变,血清Cr和BUN水平升高(P<0.01),肾脏细胞凋亡水平及肾脏Bax蛋白表达增强(P<0.01),Bcl-2蛋白表达减少(P<0.01),Nrf2蛋白表达变化无统计学差异(P>0.05),但p-Nrf2、HO-1蛋白表
关键词:虾青素;大强度运动;氧化应激;核因子E2相关因子2(Nrf2);大鼠
Abstract:Objective: To observe whether supplementation of astaxanthin can mediate Nrf2 pathway and alleviate renal injury in rats after 6-week high-intensity exercise. Methods: 7-week SD male rats were divided into 3 groups randomly: control group (C group, n=10), high intensity training group (HT group, n=15), astaxanthin and high intensity training group (HTA group, n=15) after adaptive feeding and exercise. There was no exercise intervention in C group, the HT and HTA group underwent 6-week incremental load treadmill exercise. During the training period, the rats in HTA group were administered astaxanthin 20 mg/kg intragastrically daily, the other groups were administered equal amount of soybean oil. The serum creatinine (Cr) and blood urea nitrogen (BUN), myocardial apoptosis index, the expression of myocardial B cell lymphoma-2 protein (Bcl-2), Bcl-2 associated x protein (Bax), nuclear factor erythroid 2-related factor 2 (Nrf2), heme oxygenase-1 (HO-1), myocardial malonaldehyde (MDA), superoxide dismutase (SOD)and total antioxidative capacity (T-AOC) activity were detected at 24 hours after the last training. Results: Compared with C group, histopathological changes in kidney were observed in HT group, serum Cr and BUN levels increased (P<0.01), renal apoptosis and Bax expression in the kidney were enhanced (P<0.01), Bcl-2 expression decreased(P<0.01), there was no statistical difference in Nrf2 (P>0.05), but p-Nrf2 and HO-1 expression decreased (P<0.01 orP<0.05), SOD and T-AOC activity decreased (P<0.01), MDA concentration increased (P<0.01). Compared with the HT group, histopathological changes in kidney were significantly relieved in HTA group, serum Cr and BUN levels increased (P<0.01), renal apoptosis and Bax expression in the kidney decreased (P<0.01), Bcl-2, Nrf2, p-Nrf2 and HO-1 expression increased (P<0.05 orP<0.01), SOD and T-AOC activity increased (P<0.05 orP<0.01), MDA concentration decreased (P<0.05). Conclusion: These results demonstrate that supplementation of astaxanthin can mediate Nrf2 pathway, up-regulate the protein expression of Nrf2 and HO-1, increase the activity of SOD and T-AOC, and reduce the degree of oxidative stress and apoptosis of rat kidney cells induced by 6-week high-intensity exercise training, and alleviate the occurrence of renal injury effectively.
Key words:astaxanthin; high-intensity exercise; oxidative stress; nuclear factor erythroid 2-related factor 2 (Nrf2); rat
虾青素是一种萜烯类不饱和化合物,天然存在于多种海洋生物和微生物中。虾青素中由羟基和酮基构成的共轭双键,能够通过提供电子,将自由基转化为更为稳定的产物,终止自由基链式反应,是一种功能强大的抗氧化剂[1]。现有研究已证实,虾青素具有对抗氧化应激和炎症的作用,可以有效地预防心血管疾病,抗癌,调节免疫系统[1]。长时程、大强度运动中肾脏血流急剧下降,运动后血液的大量回流,伴随着缺血再灌注过程,氧化应激水平也随之增强,极易引发肾脏损伤[2]。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)信號通路是目前发现的最重要的内源性抗氧化应激通路。正常生理状态下,Nrf2处于非活化状态,位于细胞质内与kelch样ECH相关蛋白1(kelch-like ECH-associated protein-1,Keap1)结合;氧化应激状态下,Nrf2活化后与keap1解离进入细胞核与抗氧化反应元件(antioxidant response element,ARE)相互作用,调控下游血红素加氧酶1(heme oxygenase-1,HO-1)及超氧化物歧化酶(superoxide dismutase,SOD)等抗氧化酶的转录和表达,从而实现对抗氧化应激损伤的保护作用[3]。有研究表明,虾青素可以促进Nrf2的核转位和转录活性,并上调SOD、HO-1的表达,淬灭较高水平的活性氧簇(reactive oxygen species,ROS),最终抑制肾小球系膜细胞中高糖诱导的肾纤维化[4]。同时,虾青素预处理通过改善B淋巴细胞瘤因子-2(B cell lymphoma-2 protein,Bcl-2)蛋白家族表达,可以显著减轻脂肪肝缺血再灌注损伤中的损伤程度[5]。目前,虾青素对运动性肾脏损伤的保护作用的相关研究较少。本研究通过在6周大强度训练期间对大鼠进行虾青素补充,探讨虾青素能否通过介导Nrf2通路,延缓大强度运动训练诱导的氧化应激,有效抑制大鼠肾脏细胞的过度凋亡,进而保护肾脏结构/功能的正常,为虾青素在长时程、大强度运动训练致运动性肾损伤防控中的应用提供实验依据。
1 材料与方法
1.1 实验对象和分组
SPF级雄性SD大鼠,体重202.41±9.52 g,7周龄,购自中华人民解放军军事医学科学院实验动物中心(动物生产合格证编号SCXK(军)2012-0004)。北京体育大学SPF级动物实验室饲养,温度(22±2)℃,相对湿度55%~75%,正常昼夜节律。
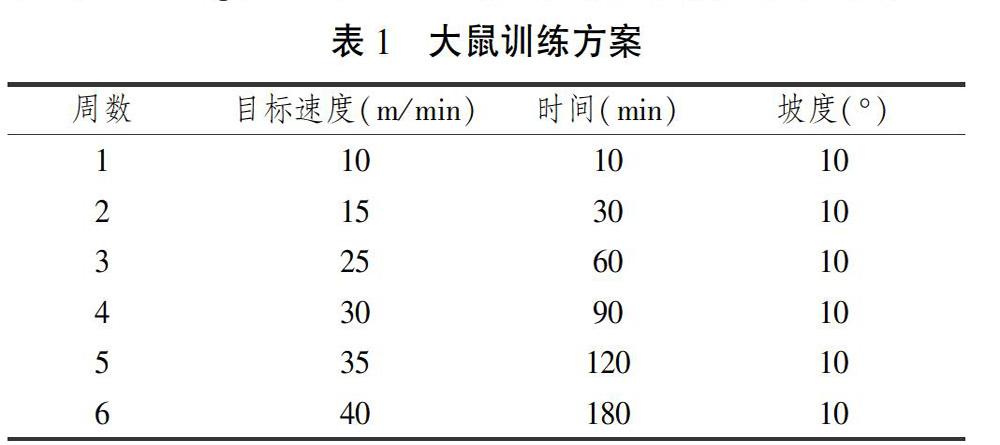
大鼠在进行4 d适应性喂养后,以10 m/min,坡度0 °,10 min/d的运动量进行适应性训练,筛选以剔除不能完成训练及运动能力较差的大鼠,按照数字随机分组法将40只大鼠随机分为3组:安静对照组(C组,10只),大强度训练组(HT组,15只)和虾青素+大强度训练组(HTA组,15只)。HT组、HTA组大鼠因训练强度及疲劳恢复等原因出现死亡情况,最终HT组剩余12只,HTA组剩余13只。
1.2 训练和营养补充方案
C组正常饲养,不进行运动干预;HT和HTA组进行6周递增负荷跑台训练,训练方案(见表1)。第2周训练开始,每次从10 m/min开始,每5 min速度增加5 m/min,直至本周目标速度。最后一周大鼠若无法维持目标速度,则运动至力竭。
训练期间,HTA组每天训练后进行1次虾青素(纯度>95%,购自Santa Cruz Biotechnology公司)灌胃,使用食用大豆油(购自益海嘉里食品营销有限公司)作为溶剂,配置浓度为4 mg/ml的虾青素溶液,通过预实验及文献[6-7]确定灌胃剂量为20 mg/kg/d,灌胃体积为5 ml/kg,C组和HT组灌胃等体积食用大豆油。
1.3 样本采集
末次训练结束后24 h处死大鼠。2%戊巴比妥钠溶液腹腔注射麻醉大鼠,腹总动脉取血5 ml并放入促凝管中,静置2 h待血清和血细胞分离后,将其放入4 ℃的低温离心机进行3 000 rpm离心15 min,取上层血清分装后置-20 ℃冰箱中保存待查。
取左侧肾脏置于预冷的生理盐水中洗净血污,准确称取重量,按照组织重量/匀浆介质1 ∶ 9的比例加入PBS缓冲液,充分研磨制成10%的肾脏组织匀浆液,5 000 rpm离心5 min取上清待测。另取右侧肾脏浸入4%多聚甲醛中固定。
1.4 指标测试
1.4.1 肾脏组织病理学评价
将肾脏从多聚甲醛固定液中取出,流水洗涤12 h后进行梯度酒精脱水、透明,石蜡包埋制成4 μm切片,HE染色后在400倍光镜下,观察肾脏组织病理学变化。
1.4.2 肾脏细胞凋亡指数
采用TUNEL法检测肾脏细胞凋亡指数。将肾脏从固定液中取出,流水洗涤12 h,梯度酒精脱水后透明,石蜡包埋,制成石蜡切片。将组织切片上机在扫描仪的镜头下逐步移动,边移动边成像进而将组织切片上所有的组织信息都扫描成像。用Pannoramic Viewer软件进行400倍放大后截取任意部位图片,扫描完成后进入Quant Center分析软件自动识别,切片上细胞核呈深棕色为强阳性,棕黄色为中度阳性,浅黄色为弱阳性,蓝色为阴性。通过对每个组织点进行识别分析出强阳性、中度阳性、弱阳性、阴性的面积(单位:像素)及阳性百分比,随后进行细胞凋亡指数(H-score)评分,从而对其进行半定量分析。H-score=(弱阳性细胞密度×1)+(中阳性细胞密度×2)+(强阳性细胞密度×3)[8-9]。TUNEL试剂盒购自瑞士Roche公司。
1.4.3 蛋白质免疫组化测试
采用免疫组化法检测肾脏Nrf2、Nrf2磷酸化(pS40)、HO-1、Bcl-2相关X蛋白(Bcl-2 Associated X Protein,Bax)和Bcl-2的蛋白表达水平。将制好的石蜡切片脱蜡水化后进行抗原修复,避光、室温孵育25 min,脱色洗涤3次后进行血清封闭,封闭后加入一抗、二抗进行DAB显色,显色终止随后脱水封片。于显微镜下随机选取5个高倍镜视野(×400),每个视野随机计数100个细胞,计算其中阳性细胞数得到平均值,按照着色深浅对蛋白表达情况进行分级:无着色为阴性,黄色为弱阳性,棕色为中阳性,棕褐色为强阳性。按照着色强度和着色范围用H-socre方法进行半定量分析,H-score计算方法同1.4.2。Nrf2、Nrf2磷酸化(pS40)、HO-1、Bax和Bcl-2的一抗、相应二抗和DAB显色剂,购自Sigma及Servicebio公司。
1.4.4 其他指標的测试
采用Jaffe苦味酸法测定血清肌酐(creatinine,Cr),采用二乙酰-肟法测定血清尿素氮(blood urea nitrogen,BUN),试剂盒购自北京华英生物技术研究所。采用酶联免疫吸附法测定肾脏总抗氧化能力(total antioxidant capacity,T-AOC)、SOD活性以及丙二醛(malondialdehyde,MDA)浓度,酶联免疫试剂盒购自美国BD公司。以上指标的测试过程均严格按照试剂盒说明书进行。
1.5 统计学处理
使用SPSS 20.0统计软件处理数据,结果用均数±标准差(x±s)表示,组间分析采用单因素方差分析,P<0.05表示为显著性差异,P<0.01表示为非常显著性差异。
2 结果
2.1 虾青素和运动干预后大鼠肾脏组织病理学变化
光镜下观察显示(图1),C组大鼠肾脏组织形态正常,肾小球未出现淤血、变性和水肿现象,肾小管管腔内未发现管型;HT组大鼠肾脏组织形态较C组发生显著改变,肾小球可见淤血,肾小管严重损伤,上皮细胞可见水肿、空泡变性和管腔扩张现象,管腔中有多种管型出现;HTA组大鼠肾脏组织形态较HT组有所改善,但肾小管上皮细胞仍轻度水肿、空泡变性和管腔扩张出现,但管腔内无蛋白管型和细胞管型出现。
2.2 虾青素和运动干预后大鼠血清Cr和BUN浓度变化
本研究的结果显示(表2),与C组比较,HT组血清Cr和BUN水平均显著升高(P<0.01);与HT组比较,HTA组血清Cr和BUN水平均显著性降低(P<001)。从结果可以看出,本研究采用的6周递增负荷跑台训练诱发了大鼠肾脏功能损伤,而训练期间的虾青素干预有效地缓解了大鼠肾脏功能损伤。
2.3 虾青素和运动干预后大鼠肾脏Nrf2、p-Nrf2和HO-1蛋白表达变化
本研究的结果显示(表3、图2),与C组比较,HT组肾脏Nrf2表达无明显差异(P>0.05),但p-Nrf2和HO-1表达均呈现显著下降(P<0.01或P<0.05);与HT组比较,HTA组的Nrf2、p-Nrf2和HO-1表达均显著上调(P<0.01或P<0.05)。
2.4 虾青素和运动干预后大鼠肾脏SOD、T-AOC活性和MDA浓度变化
本研究的结果显示(表4),与C组比较,HT组的SOD、T-AOC的活性均显著降低(P<0.01),同时MDA的浓度显著升高(P<0.01)。与HT组比较,HTA组的SOD、T-AOC的活性均较HT组显著升高(P <0.01),同时MDA的浓度显著下降(P<0.05),但与C组相比仍存在显著差异(P<0.01)。由此说明,本研究的大强度训练诱发了氧化应激反应,ROS产生增多,导致肾脏抗氧化状态失衡,训练期间虾青素的干预通过激活Nrf2通路促进了抗氧化酶活性增强,进而改善了肾脏的氧化应激水平。
2.5 虾青素和运动干预后大鼠肾脏细胞凋亡水平变化
TUNEL染色结果显示(表5、图3),与C组比较,HT组和HTA组肾脏细胞凋亡H-score显著性升高(P<0.01);与HT组比较,HTA组肾脏细胞凋亡H-score显著性降低(P<0.01)。这表明大强度训练诱发了肾脏细胞的过度凋亡,而训练期间的虾青素干预在一定程度上抑制了肾脏细胞的过度凋亡,但与正常水平仍存在显著性差异。
2.6 虾青素和运动干预后大鼠肾脏Bax和Bcl-2蛋白表达变化
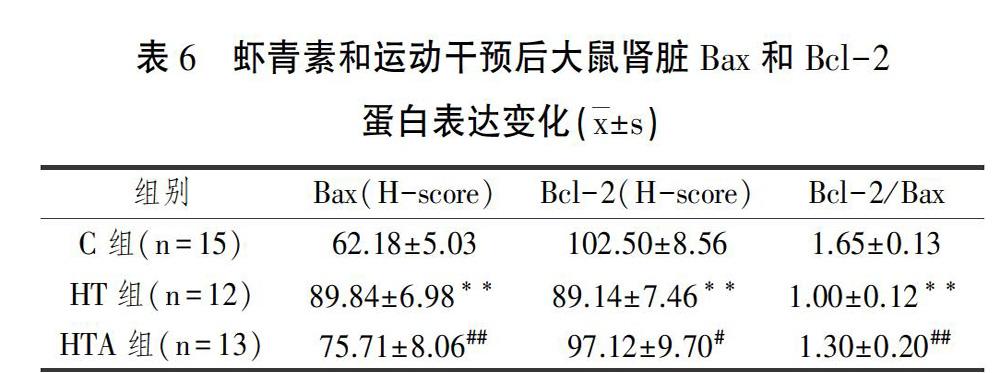
从凋亡相关蛋白表达变化可知(表6、图4),促凋亡蛋白Bax表达,HT组较C组显著升高(P<0.01);HTA组较HT组显著性下降(P<0.01),但较C组仍显著升高(P<0.01)。抑制凋亡蛋白Bcl-2表达,HT组较C组显著下降(P<0.01),HTA组较HT组显著升高(P<0.05),且与C组无统计学差异(p>0.05)。通过分析Bcl-2/Bax比值后发现,HT组较C组显著下降(P<0.01),而HTA组较HT组显著升高(P<0.01),但仍低于C组(P<0.01)。
3 分析与讨论
肾脏作为高灌注器官,对缺血缺氧极其敏感,长时程、大强度运动引发的缺血再灌注过程,超越了肾脏的自我调节能力,加剧了肾组织损伤程度。Cr是肌酸代谢的产物,释放到血液中,最终随尿液排出,其浓度变化主要由肾小球的滤过能力决定,血清Cr浓度升高意味着肾实质受损。尿素是蛋白质代谢的主要终产物,主要通过肾脏排泄,当肾实质发生损伤时,肾小球滤过率降低,血清BUN水平升高。因此常将血清Cr和BUN作为明确肾脏损伤程度的指标[10]。研究表明[11-12],长时程、大强度运动可导致大鼠出现运动性肾脏损伤,表现为血清Cr和BUN水平升高。其主要诱因为:长时程、大强度运动刺激肾脏增加对水和钠的重吸收,使肾脏对能量和氧气的需求增加,而此时肾脏中血液灌注减少,极易引发缺血缺氧反应,造成肾脏结构/功能损伤[13-14]。本研究发现HT组血清Cr和BUN水平较C组显著升高,同时结合大鼠肾脏组织形态的比较,说明6周递增负荷跑台训练对大鼠肾脏结构/功能造成损伤。
Nrf2是抑制氧化应激和维持细胞内氧化还原平衡的关键转录因子,Nrf2的靶基因包含HO-1及SOD等大量抗氧化酶,参与解毒、修复、去除受损蛋白、抑制炎症等过程[15-16]。非运动状态下,胞浆中的Nrf2可与其负调节因子Keap1形成二聚体抑制Nrf2表达水平[17]。运动状态下,产生大量的ROS,使Keap1结构发生变化,加速解偶联作用,进而刺激Nrf2从胞浆转移至胞核,导致核内的Nrf2蛋白表达升高,通过Nrf2/ARE信号通路,广泛激活下游抗氧化应答过程,发挥清除自由基的作用,增强细胞存活[18]。但运动对Nrf2表达的调节作用,存在一定剂量效应。有文献报道[19],适宜的运动可以通过提高Nrf2水平,改善氧化应激水平和肾脏功能。但在本研究中,尽管与C组相比,HT组肾脏细胞的Nrf2水平无明显变化,但其磷酸化水平显著降低,下游的HO-1的表达水平、SOD和T-AOC的活性均显著降低,同时MDA浓度显著升高。说明长时程、大强度运动可诱导机体氧化应激反应增强,自由基大量生成的同时无法及时清除,在一定程度上抑制了Nrf2通路发挥抗氧化作用并引发了机体氧化还原状态失衡。过量的ROS是加剧细胞凋亡的重要信号,有研究表明肾缺血再灌注可通过促凋亡途径引发肾损伤[20]。细胞凋亡是基因控制下自主地、有序地细胞死亡过程,是机体为了更好地适应生存环境而采取的调控措施。Bcl-2蛋白家族广泛参与细胞凋亡过程[21],已经发现的Bcl-2蛋白家族按功能可以分为两类,一类具有抑制凋亡作用,如Bcl-2;另一类具有促进凋亡作用,如Bax。Bcl-2/Bax相对比值的变化与细胞凋亡关系密切[22]。在本研究中,HT组肾脏细胞凋亡水平和促凋亡蛋白Bax表达水平均较C组显著升高,而抗凋亡蛋白Bcl-2表达水平显著降低,说明6周递增负荷跑台训练加剧了肾脏细胞的凋亡。由此可知,当Nrf2不能正常编码抗氧化酶类蛋白时,HO-1蛋白表达量显著下降,抗氧化酶SOD和T-AOC活性显著降低,同时脂质过氧化产物MAD浓度显著升高,Bcl-2/Bax比值显著降低,机体抗氧化能力受损加重肾脏细胞损伤程度,增强凋亡水平。
磷酸化修饰是调节Nrf2功能的重要途径,当Nrf2蛋白上第40位丝氨酸发生磷酸化时,可导致其与Keap1解离[23-24],使抗氧化元件ARE及其保护性蛋白的合成过程被激活,调节肾脏氧化应激过程[25]。本研究中,HTA组血清Cr和BUN水平较HT组显著下降,肾脏Nrf2、p-Nrf2和HO-1的表达水平、SOD和T-AOC活性均较HT组显著升高,MDA浓度下降。上述结果说明当肾脏遭受氧化攻击时,虾青素作为Nrf2的激动剂,可以通过提高Nrf2蛋白表达水平及磷酸化水平,有效改善大鼠肾脏氧化应激状态。付凯等[26]的研究中,2周虾青素补充可以显著提高发生缺血再灌注损伤肾脏中的SOD活性,并降低MDA水平。潘雷[27]的研究认为,天然虾青素可上调Nrf2/ARE信号通路中相关基因的mRNA和蛋白在细胞内表达,这可能是其发挥抗氧化应激保护作用的机制之一。Zhu等[28]的研究也發现,虾青素通过促进Nrf2核转位并增加其下游蛋白HO-1和SOD的表达,降低MDA生成,减轻糖尿病大鼠肾脏纤维化程度。与此同时,本研究中Bax蛋白表达水平显著下降,Bcl-2蛋白表达水平及Bcl-2/Bax比值均显著升高,说明训练期间的虾青素干预有效抑制了大强度运动诱导的肾脏细胞的过度凋亡,进而减轻了肾实质损伤。虾青素改善细胞凋亡情况的机制可能与其激活Nrf2信号传导途径,进而调节Bcl-2家族蛋白表达水平有关。在Niture等[29]的研究中,Nrf2可直接与Bcl-2的抗氧化反应元件结合,通过上调其表达,阻止细胞凋亡。Fan等[30]在体外和体内实验中均发现,虾青素预处理通过调节Bcl-2家族蛋白表达,可以阻断同型半胱氨酸诱导的线粒体功能障碍和氧化损伤,减少同型半胱氨酸诱导的心脏毒性。Guo等[31]的研究发现,虾青素通过减轻氧化应激和线粒体相关的细胞凋亡,可以减轻大鼠严重烧伤后早期急性肾损伤。本研究结果说明,虾青素可以通过介导Nrf2信号通路,改善肾脏氧化应激状态和细胞凋亡水平,对大强度运动诱导的大鼠肾脏损伤发挥保护作用,虾青素与运动性肾脏损伤的关系还有待进一步研究。
4 小结
本研究证实,6周大强度运动训练可加剧肾脏氧化应激反应及细胞凋亡,肾脏结构/功能出现损伤。训练期间的虾青素补充可通过介导Nrf2通路上调Nrf2/p-Nrf2和HO-1表达,提高下游II相解毒酶HO-1蛋白表达及抗氧化酶SOD和T-AOC活性,减少促凋亡蛋白Bax表达,增强抗凋亡蛋白Bcl-2表达,缓解肾脏细胞的过度凋亡,保护肾脏结构/功能的正常。
参考文献:
[1]RANGA R A, PHANG S M, SARADA R,et al. Astaxanthin:sources, extraction, stability, biological activities and its commercial applications—a review[J]. Mar Drugs, 2014, 12(1):128-152.
[2]周俊飞, 曹建民, 周海涛. 大鼠运动性肾脏缺血再灌注损伤及肉苁蓉配伍维生素C的保护[J]. 山东体育学院学报, 2014, 30(2):70-74.
[3]薛岩. 虾青素对缺血-再灌注致血管性认知功能障碍小鼠的神经保护作用及其机制的探讨[D]. 石家庄:河北医科大学, 2017.
[4]Chen Q, Tao J, Xie X. Astaxanthin promotes Nrf2/ARE signaling to inhibit HG-induced renalfibrosis in GMCs[J]. Mar Drugs, 2018, 16(4):E117.
[5]Shaowei L, TERUMI T, MASAYUKI F,et al. Astaxanthin prevents ischemia-reperfusion injury of the steatotic liver in mice[J]. PLoS One, 2017, 12(11):e0187810.
[6]沈宁. 补充天然虾青素对递增负荷训练大鼠骨骼肌自由基代谢的影响[J].成都体育学院学报, 2014, 40(2):75-79.
[7]周海涛, 曹建民,郭娴, 等. 虾青素对大鼠运动性心肌损伤的保护作用[J].天然产物研究与开发, 2016, 28(7):1150-1155.
[8]Yeo W, Chan S L, MO F K F,et al. Phase I/II study of temsirolimus for patients with unresectable Hepatocellular Carcinoma (HCC)-a correlative study to explore potential biomarkers for response[J]. BMC Cancer, 2015, 15(1):395-405.
[9]AZIM H A, PECCATORI F A, BROHE S, et al. RANK-ligand (RANKL) expression in young breast cancer patients and during pregnancy[J]. Breast Cancer Res, 2015, 17(1):24-32.
[10]姚凤华, 何娅妮, 詹俊, 等. 内质网应激在急性缺血性大鼠肾损伤中的作用[J]. 第三军医大学学报, 2009, 31(11):1002-1004.
[11]牛衍龙, 曹建民, 周海涛, 等. 6周大强度训练对大鼠肾功能的影响及其机制[J]. 中国应用生理学杂志, 2018, 34(1):65-68.
[12]周海涛, 曹建民, 郭娴, 等. 虾青素对运动性肾缺血再灌注损伤ECM表达的影响[J]. 天然产物研究与开发, 2015, 27(11):1871-1877.
[13]张富婷,常德辉,张斌, 等. 高原环境下大鼠力竭运动后急性肾损伤的研究[J]. 解放军医药杂志, 2015, 27(9):13-16.
[14]COEN C W G B, MOHAMMAD A, TOM N,et al. Impact of acute versus repetitive moderate intensity endurance exercise on kidney injury markers[J]. Physiol Rep, 2017, 5(24):e13544.
[15]HOLMSTRM K M, KOSTOV R V, DINKOVA-KOSTOVA A T. The multifaceted role of Nrf2 in mitochondrial function[J]. Curr Opin Toxicol, 2016(1):80-91.
[16]KOBAYASHI E H, SUZUKI T, FUNAYAMA R,et al. Nrf2 suppresses macrophage inflammatory response by blocking proinflammatory cytokine transcription[J]. Nat Commun, 2016(7):11624-11637.
[17]Qin S, Hou D X. Multiple regulations of Keap1/Nrf2 system by dietary phytochemicals[J]. Mol Nutr Food Res, 2016, 60(8):1731-1755.
[18]KENSLER T W, WAKABAYASHI N, BISWAL S. Cell survival responses to environmental stresses via the Keap1-Nrf2-ARE pathway[J]. Annu Rev Pharmacol Toxicol, 2007(47):89-116.
[19]AARON J D, TINNA T. Nrf2 mediates redox adaptations to exercise[J]. Redox Biol, 2016(10):191-199.
[20]韓庆玲, 郑德义, 李伟人, 等. 肾缺血再灌注通过促凋亡途径加重糖尿病小鼠肾损伤[J]. 安徽医科大学学报, 2018, 53(12):1834-1837.
[21]OLA M S, NAWAZ M, AHSAN H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J]. Mol Cell Biochem, 2011, 351(1/2):41-58.
[22]KIM J H, CHOI W, LEE J H,et al. Astaxanthin inhibits H2O2-mediated apoptotic cell death in mouse neural progenitor cells via modulation of P38 and MEK signaling pathways[J]. J Microbiol Biotechnol, 2009, 19(11):1355-1363.
[23]OSBURN W O, KENSLER T W. Nrf2 signaling:an adaptive response pathway for protection against environmental toxic insults[J]. Mutat Res, 2008, 659(1-2):31-39.
[24]BLOOM D A, JAISWAL A K. Phosphorylation of Nrf2 at Ser40 by protein kinase C in response to antioxidants leads to the release of Nrf2 from INrf2, but is not required for Nrf2 stabilization/accumulation in the nucleus and transcriptional activation of antioxidant response element-mediated NAD(P)H:quinone oxidoreductase-1 gene expression[J]. Journal of Biological Chemistry, 2003, 278(45):44675-44682.
[25]BROWN D R, GOUGH L A, Deb S K,et al. Astaxanthin in exercise metabolism, performance and recovery:a review [J]. Front Nutr, 2017(4):E76.
[26]付凱, 袁逸民, 蒋昊, 等. 虾青素在小鼠肾脏缺血再灌注损伤方面的保护作用[J]. 东南大学学报:医学版, 2015, 34(2):222-225.
[27]潘雷. 天然虾青素对大鼠脑缺血/再灌注损伤的保护作用及相关机制研究[D]. 重庆:重庆医科大学, 2018.
[28]Zhu X, Chen Y, Chen Q,et al. Astaxanthin promotes Nrf2/ARE signaling to alleviate renal fibronectin and collagen IV accumulation in diabetic rats[J]. J Diabetes Res, 2018(2018):e6 673031.
[29]NITURE S K, JAISWAL A K. Nrf2 protein up-regulates antiapoptotic protein Bcl-2 and prevents cellular apoptosis[J]. J Biol Chem, 2012, 287(13):9873-9886.
[30]Fan C, Sun J, Fu X, et al. Astaxanthin attenuates homocysteine-induced cardiotoxicity in vitro and in vivo by inhibiting mitochondrial dysfunction and oxidative damage[J]. Frontiers in physiology, 2017(8):1041-1050.
[31]Guo S X, Zhou H L, Huang C L,et al. Astaxanthin attenuates early acute kidney injury following severe burns in rats by ameliorating oxidative stress and mitochondrial-related apoptosis[J]. Mar Drugs, 2015, 13(4):2105-2123.

