有氧运动对慢性疲劳综合征建模大鼠海马ERK/CREB/BDNF信号通路的影响

摘 要:目的:探討3周有氧运动对慢性疲劳综合征大鼠海马区神经元形态结构及ERK/CREB/BDNF信号通路的影响。方法:雄性54只SD大鼠,随机分为3周对照组(C组)27只、模型组(M组)27只,C组常规饲养,M组进行三周慢性疲劳综合症(CFS)建模。建模结束后,C组、M组随机各选取6只进行取材;剩余模型组大鼠随机分为模型对照组(MC组)、模型运动组(ME组);剩余对照组随机分为6周对照组(CC组)、单纯运动组(CE组)。采用力竭游泳、束缚、禁食禁水、睡眠剥夺4种应激因素建立CFS模型,采用无负重游泳进行有氧运动干预。采用HE染色切片观察各组大鼠海马区神经元形态结构,采用Western Blotting方法检测信号通路P-ERK、CREB、P-CREB、BDNF蛋白的表达。结果:1)M组大鼠一般状况有明显的CFS特征;2)与C组相比,M组大鼠海马CA1区细胞损伤不明显,CA3区、DG区细胞出现明显损伤; MC组大鼠海马CA1区存在细胞损伤现象,CA3区、DG区细胞损伤现象有所好转;ME组、CC组、CE组大鼠细胞形态结构正常;3)与C组相比,M组大鼠海马区P-ERK蛋白表达显著下降(P<0.05),CREB、BDNF蛋白表达非常显著性下降(P<0.01);P-CREB蛋白表达没有显著性差异(P>0.05);4)与CC组相比,CE组大鼠海马组织P-ERK、CREB、P-CREB、BDNF蛋白表达均非常显著性增加(P<0.01);MC组大鼠海马组织P-ERK、CREB蛋白表达均非常显著性增加(P<0.01),P-CREB、BDNF蛋白表达均非常显著性减小(P<0.01);与CE组相比,ME组大鼠海马组织P-ERK蛋白表达非常显著性增高(P<0.01),CREB、P-CREB、BDNF蛋白表达均非常显著性减少(P<0.01)。结论:慢性疲劳综合征引起大鼠海马神经元损伤可能与ERK/CREB/BDNF信号通路有直接关系;有氧运动可促进大鼠海马ERK/CREB/BDNF信号通路蛋白的表达进而修复海马神经元损伤。
关键词:慢性疲劳综合征;有氧运动;海马;细胞外调节蛋白激酶;环磷酸腺苷反应元件结合蛋白;脑源性神经营养因子;神经元可塑性
Abstract:Objective: To investigate the effect of 3-week aerobic exercise on neuronal morphological structure and ERK/CREB/BDNF signaling pathway in hippocampus of chronic fatigue syndromeSchool of Physical Education, Chaohu University, Hefei 238000, Anhui, China rats. Methods: 54 male SD(Sprague-Dawley) rats were randomly divided into a 3-week control group (C) of 27 rats, and a model group (M) of 27 rats. After the modeling, 6 samples were randomly selected from C group and M group for sampling. The remaining model groups were randomly divided into model control group (MC) and model exercise group (ME). The remaining control group was randomly divided into six-week control group (CC) and simple exercise group (CE). The CFS model was established based on four stress factors: exhaustive swimming, restraint, fasting and water deprivation, and sleep deprivation. Aerobic exercise intervention was performed by swimming without weight. HE staining sections were used to observe the morphological structure of neurons in the hippocampal area of each group, and the protein expressions of P-ERK, CREB, P-CREB and BDNF were detected by Western Blotting. Results: 1) The general condition of group M rats had obvious CFS characteristics; 2) Compared with group C, the cells in the hippocampal CA1 area of group M were not significantly damaged, while in the CA3 area and DG area were significantly damaged. In the MC group, there was cell damage in the hippocampal CA1 area, and the in the CA3 area and DG area was improved. The morphological structures of the rat cells in ME group, CC group and CE group were normal. 3) Compared with group C, P-ERK protein expression was significantly decreased in the hippocampus of group M (P<0.05), and the expression of CREB and BDNF protein was significantly decreased (P<0.01). There was no significant difference in the expression of P-CREB protein (P>0.05). 4) Compared with the CC group, the expression levels of P-ERK, CREB, P-CREB and BDNF in the hippocampal tissues of the CE group were significantly increased (P<0.01). The expressions of P-ERK and CREB proteins in the hippocampal tissues of the MC group were significantly increased (P<0.01), and the expressions of P-CREB and BDNF proteins were significantly decreased (P<0.01). Compared with the CE group, the expression of P-ERK protein in the hippocampus of the ME group was significantly higher (P<0.01), and the expression of CREB, P-CREB and BDNF protein was significantly lower (P<0.01). Conclusion: The damage of hippocampal neurons induced by chronic fatigue syndrome may be directly related to ERK/CREB/BDNF signaling pathway. Aerobic exercise can promote the expression of ERK/CREB/BDNF signaling pathway protein in the hippocampus of rats and thus repair the damage of hippocampal neurons.
Key words:chronic fatigue syndrome; aerobic exercise; hippocampal; extracellular regulated protein kinases (ERK); cyclic adenosine monophosphate response element binding protein (CREB); brain-derived neurotrophic factor (BDNF); neuronal plasticity
慢性疲劳综合征(Chronic fatigue syndrome,CFS)发病机理尚不十分清楚,国内外已有的研究表明,CFS患者核磁共振信号呈现脑萎缩信号特征[1-4]。近年来的研究发现,环磷酸腺苷酸反应原件结合蛋白(cyclic adenosine monophosphate response element binding protein ,CREB )可能是应激性损伤后神经细胞存活的关键因素,具有重要的抗凋亡效应[5-6]。细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinase,ERK)是引起 CREB 磷酸化的重要激酶,只有磷酸化的 CREB 才能激活下游基因脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的表达[7]。CREB、BDNF参与神经细胞生长、发育、增殖、分化等过程;近年来,越来越多的研究证实了ERK/CREB/BDNF信号通路参与抑郁症、AD疾病中神经细胞的重塑,但关于该信号通路是否参与CFS发生后神经细胞重塑的相关研究很少见到。
CFS的非药物治疗法有行为心理疗法[8]、饮食干预[9]、高氧疗法[10-12]、低氧疗法[13-14],运动作为一种可自控、经济且无副作用的一种良性应激,它的功效被人们所重视,得到广泛的研究和应用。有氧运动可以通过激活CREB、BDNF 以及 ERK等重要信号蛋白的表达, 提高神经营养作用,促进神经元的生长,增加神经可塑性[15]。 CFS的运动疗法大多采用运动预干预,但是CFS患者是否适合有氧运动仍是很多人心中的疑虑。本实验研究CFS与海马区ERK/CREB/BDNF信号通路的关系,及有氧运动对CFS大鼠海马区神经元形态结构、ERK/CREB/BDNF信号通路蛋白表达的影响,探讨有氧运动改善CFS的可能机制,为CFS的治疗及预防提供理论依据。
1 材料与方法
1.1 实验动物及分组
8周龄SPF级健康雄性SD大鼠54只,购于广州中医药大学实验动物中心[动物生产许可证:SCXK(粤)2013-0034],体重为180~220 g。采用国家标准啮齿类动物干燥饲料喂养。动物饲养环境:温度25±2℃,相对湿度50%~65%,12 h光暗交替,大鼠游泳水温为32℃±1℃。大鼠适应性喂养一周后随机分为空白对照组(C组,n=27)、模型组(M组,n=27);体重分别为(220.81±7.4)g和(219.89±7.24)g,组间对比无显著性差异(P>0.05)。C组常规饲养,不进行任何干预;M组大鼠适应性游泳3 d(1次/d,10 min/次)后进行3周CFS建模,建模期间,大鼠意外死亡3只(游泳溺亡2只,束缚死亡1只)。建模结束后C组、M组各随机选取6只大鼠进行取材;剩余M组大鼠随机分为模型对照组(MC组,n=9)、模型运动组(ME组,n=9);剩余C组大鼠随机分为6周空白对照组(CC组,n=10)、单纯运动组(CE组,n=11)。
1.2 干预方式及取材
1.2.1 CFS建模方案
CFS大鼠建模方法参照文獻[16-19]并根据预实验结果,采用复合应激制备模型。本研究旨在模拟人类躯体疲劳、高压、饮食不规律、睡眠不足的实际情况,采用力竭游泳、束缚、禁食禁水、睡眠剥夺4种应激方式建立应激性CFS大鼠模型。每周建模6天,周日进行旷场实验。建模干预以两天为一个周期,具体方法如表1所示。
1.2.2 有氧运动方案
有氧运动方案选用无负重游泳,水温32℃±1℃;具体方案如表2。
1.2.3 各组大鼠干预方式
建模、有氧运动每周均为周一到周六进行,周日进行体重和旷场实验测试,实验过程中观察各组大鼠皮毛、精神状态、大便情况等一般状况。各组具体干预方式如表3。
1.3 实验取材
实验结束24 h后,所有大鼠禁食12 h,根据大鼠体重腹腔注射质量分数为10%的水合氯醛(0.35~0.4 ml/kg)进行腹腔麻醉,然后断头取脑,将左侧海马取出用锡纸包埋立即放入液氮中,-80℃保存,待测指标,整个过程均在冰面上快速进行操作;右侧脑放入装有4%多聚甲醛溶液的固定瓶中固定,待HE切片观察;两次取材由同一人员操作。
1.4 指标检测与方法
采用HE染色切片观察各组大鼠海马组织CA1、CA3、DG区细胞的形态结构;Western Blotting 方法检测各组大鼠海马组织中P-ERK、CREB、P-CREB、BDNF蛋白的表达量。
1.4.1 HE染色
将在4%的多聚甲醛中固定24 h以上的大鼠右侧脑组织从固定液取出,漂洗、用梯度酒精脱水、包埋、切片,片厚4 μm。将切片依次将切片放入二甲苯Ⅰ、二甲苯Ⅱ、无水乙醇Ⅰ、无水乙醇Ⅱ、95%酒精、90%酒精、80%酒精、70%酒精、蒸馏水洗;浸入Harris苏木素3~8 min,自来水洗,1%的盐酸酒精分化数秒,自来水冲洗,0.6%氨水返蓝,流水冲洗;在浸入伊红染液中染色1~3 min;依次放入95%酒精I、95%酒精II、无水乙醇Ⅰ、无水乙醇Ⅱ、二甲苯Ⅰ、二甲苯Ⅱ中脱水透明,随后稍晾干,用中性树胶封片。在光镜下放大40倍观察海马区神经元整体损伤情况,400倍光镜下观察大鼠海马CA1区、CA3区、DG区切片HE染色后神经元形态学变化,并进行拍照。
1.4.2 Western Blotting检测
将适量海马组织加入组织裂解液进行匀浆、离心处理,吸取上清液,考马斯亮蓝G-250染料检测样品的蛋白浓度,蛋白定量后,在沸水中煮8 min使蛋白质变性。用BCA法测定蛋白浓度,与加样缓冲液混匀,加样25 ul,进行SDS-PAGE电泳分离、转膜,将转移好的PVDF膜放入10%脱脂奶粉封闭液中封闭2小时,PBST洗膜5次,每次5 min。加P-ERK抗体1 ∶ 1 000(Abcam,Thr202/Tyr204)、CREB抗体1 ∶ 2 000(Abcam)、P-CREB抗体1 ∶ 1 000(Abcam,Ser133)、BDNF抗体1 ∶ 1 000(CST)孵育过夜,PBST洗膜5次,每次5min。加入辣根过氧化物酶标记的二抗1 ∶ 1 000(武汉博士德)孵育1 h,PBST洗膜5次,每次5 min。应用ECL荧光底物混合液浸泡PVDF膜,室温孵育3~5 min后,用滤纸擦干,于暗室曝光,胶片显影、定影。将胶片扫描出图像,用图像分析软件对图像进行光密度值分析。GAPDH作为内参蛋白,目的蛋白的相对含量以目的蛋白与内参蛋白条带光密度的比值表示。
1.5 数据处理
运用SPSS21.0统计软件进行数据分析。计量资料统计结果以均数±标准差(x±s)表示,采用单因素方差分析检验,P<0.05为具有统计学意义,P<0.01为具有极显著性差异。
2 研究结果与分析
2.1 大鼠一般状况变化
CFS建模前,C组和M组大鼠皮毛毛色白、均匀有光泽、眼睛有神、反应灵敏,动作活动正常。实验初期(CFS建模2~4天内),两组大鼠外观无明显改变,但均表现出对外界刺激反应敏感,警觉性高;随着建模时间的延长(CFS建模4~12天内),C组大鼠敏感表现消失,M组大鼠皮毛毛色逐渐发黄、缺少光泽、掉毛现象严重,抓取时表现出易“激惹”或躲避行为;应激干预进行14天后,M组大鼠眼神黯淡无神,明显消瘦,出现疲劳、精神萎靡现象,大便稀溏或干结情况明显,对外界应激表型出易“激惹”或淡漠现象。与建模前相比,M组大鼠在建模结束时力竭游泳时间明显减少。C组在建模前后,一般状态表现无明显差异,神态平静。
MC组大鼠精神倦怠现象、大便情况、掉毛现象以及对抓取的反应等一般情况有所好转或消失,ME组大鼠一般状况恢复正常,与CC组、CE组相比没有明显差异。
2.2 大鼠体重
由表4可见,建模前C组、M组大鼠体重没有明显差异(P>0.05);建模1、2、3周后,M组大鼠体重明显小于C组(P<0.01);
2.3 大鼠旷场行为
由图1可见,建模0、1、2、3周,C组、M组大鼠水平活动次数没有明显差异(P>0.05);由图2可见,建模0、2、3周,C组、M组大鼠竖直活动次数没有明显差异(P>0.05)。建模1周时,与C组大鼠相比,M组大鼠竖直活动次数增多,且具有非常显著性差异(P<0.01)。
2.4 大鼠海马区细胞形态
本研究中选取大鼠海马组织CA1区、CA3区和DG区3个区域观察大鼠海马神经细胞形态变化。
2.4.1 CFS建模大鼠海马区细胞形态
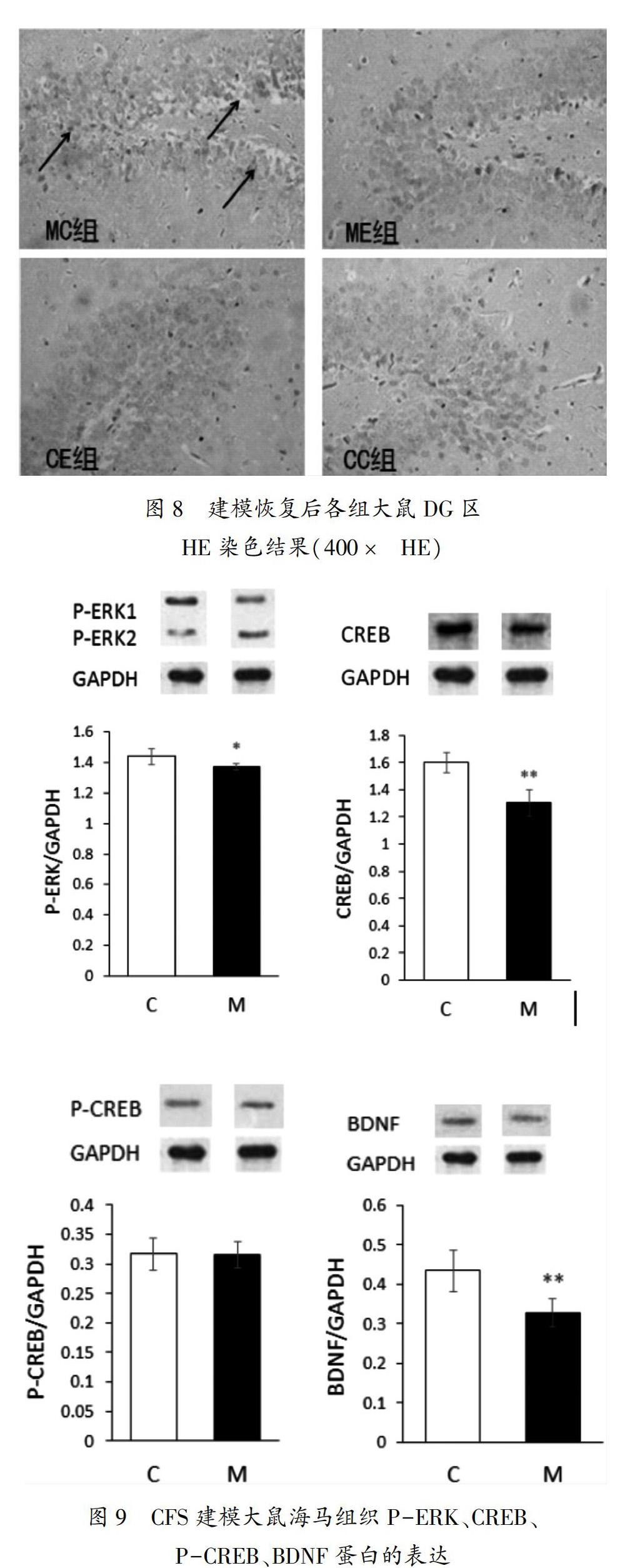
如图3、图4、图5所示,C组大鼠海马组织CA1区、CA3区、DG区神经细胞大而圆,细胞的细胞结构细胞膜、细胞核能清晰地看到。M组大鼠海马CA1区细胞形态结构损伤不明显;CA3区、DG区大多数细胞出现明显的损伤,细胞核固缩、细胞深染呈三角形、梭形或不规则形,看不到细胞膜、细胞核等细胞结构。图中箭头标注部位均存在细胞深染、不规则变形等现象。
2.4.2 CFS建模恢复后大鼠海马区细胞形态
MC组大鼠海马CA1区、CA3区、DG区均存在细胞损伤;与M组相比,CA1区细胞损伤明显,CA3區无明显变化,DG区损伤有所好转;ME组大鼠海马CA1区、CA3区细胞形态正常,DG区少数细胞存在损伤;CC组、CE组大鼠海马各区细胞形态结构正常。如图6、图7、图8所示,图中箭头标注部位均存在细胞深染、不规则变形等现象。
2.5.1 CFS建模大鼠海马组织P-ERK、CREB、P-CREB、BDNF蛋白的表达
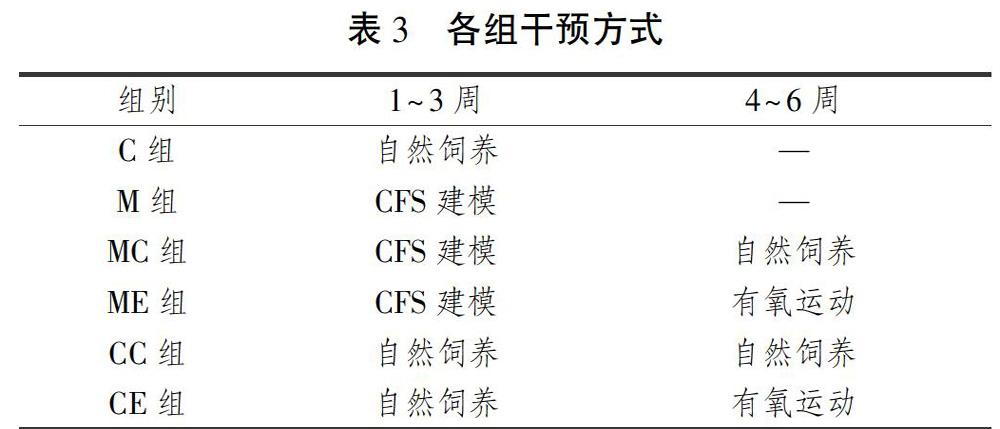
与C组相比,M组大鼠海马区P-ERK蛋白表达显著性下降(P<0.05);CREB、BDNF蛋白表达均非常显著性下降(P<0.01);P-CREB蛋白表达无显著性差异(P>0.05)(见图9)。
2.5.2 CFS建模恢复后大鼠海马组织P-ERK、CREB、P-CREB、BDNF蛋白的表达
与CC组相比,CE组、MC组、ME组大鼠海马区P-ERK、CREB蛋白表达量均非常显著性增加(P<001);CE组、ME组大鼠海马区P-CREB、BDNF蛋白表达量均非常显著性增加(P<0.01);MC组大鼠海马区P-CREB、BDNF蛋白表达量均非常显著性减小(P<001); 与CE组相比,ME组大鼠海马区P-ERK蛋白表达量非常显著性增加(P<0.01);CREB、P-CREB、BDNF蛋白表达量非常显著性减少(P<0.01);与MC组相比,ME组大鼠海马区P-ERK、CREB、P-CREB、BDNF蛋白表达均非常显著性增加(P<0.01)(见图10)。
3 讨论
由于目前对CFS发病机制尚不清楚,大多数研究都是观察CFS患者发病的症状、体征等一般状况,询问并分析患者主诉症状发生的各种原因模拟进行动物建模,建模方式各异。如有研究[20-23]采用注射脂多糖(lipopolysaccharide, LPS)、布鲁氏杆菌(Brucella abortus, BA)、多聚肌胞苷酸(poly I:C)等造成动物机体免疫紊乱进而诱发慢性疲劳综合征,这种建模方法是模拟毒感染引发的CFS或者是临床CFS患者表现出的免疫紊乱现象,主要进行对症治疗的研究,在国内比较少见。大部分研究都采用应激建模,多数研究者认为应激建模更符合临床CFS患者发病原因;一般采用单因素建模、双因素建模、多因素复合应激建模。一般应激因素有束缚、冷水游泳、悬垂、力竭游泳、禁食禁水、睡眠剥夺、空瓶刺激等。
本研究模拟现代生活中人们所面临的多种应激:身体疲劳、饮食不规律、睡眠缺失、压力大,采用力竭游泳、禁食禁水、睡眠剥夺、束缚4种应激方式进行生理-心理双重应激建立CFS大鼠模型,采用大鼠一般状况、体重、旷场实验进行模型评价,研究有氧运动对CFS的作用效果。
3.1 CFS建模效果
一般状况是评价大鼠精神状态的直观性指标,在CFS建模实验中,大鼠一般状态常常与CFS患者的状态进行类比,用以评价建模是否成功具有重要的参考评价意义。
本研究结果显示,在造模过程种大鼠一般状况有明显的改变:C组在前2~4天表现出对外界抓取敏感,随后这种现象消失。M组大鼠对外界抓取开始表现出易激惹、对外界环境反应敏感;随着建模时间的延长M组大鼠毛色逐渐发暗、脱毛情况普遍,眼睛无神、目光呆滞,体重严重下降,出现疲劳、精神萎靡现象,大便稀溏或干结情况明显,对外界应激反应过于敏感或无视。这与姚斐等[24]采用睡眠剥夺(12 h)+力竭游泳(负重自身体重5%) 4周建立CFS模型,孟昭琴等[17]采用单纯束缚4周建立CFS大鼠一般状况表现一致。
3.2 各组大鼠海马区神经元形态结构变化
临床及动物实验研究结果显示,CFS的发生会引起脑部萎缩,本研究选取大鼠海马CA1区、CA3区、DG区进行观察,探讨运动对CFS大鼠海马区神经元形态结构影响。
本研究结果显示,CFS建模后大鼠海马CA1区损伤不明显,CA2区、DG区损伤较为明显;黄瑶等[25]采用双侧海马氢质子磁共振波谱(1H-MRS)检测显示,CFS患者较正常人群存在脑内生化代谢异常,证实CFS患者存在中枢神经元损害和细胞代谢异常,这与本研究结果一致。
单纯运动组大鼠海马区神经细胞形态结构正常,说明本实验所采用的有氧运动强度不会引起正常大鼠海马区细胞的损伤。CFS大鼠三周自然恢复后,大鼠CA1区有明显损伤,而CA2区、DG区损伤有所好转,说明建模引起的损伤在短时间内不能得到恢复,且CA1区损伤有延迟性。孟盼 [19]的研究表明抑郁症神经再生主要发生在CA3区和DG区。本研究显示该CFS发生首先引起CA3区和DG区的损伤,这可能与建模方式有关。CFS大鼠有氧运动后海马组织各区已看不到细胞存在明显损伤,说明有氧运动能有效促进海马区神经元损伤后的修复。
3.3 CFS建模大鼠海马区P-ERK、CREB 、P-CREB、BDNF蛋白表达的变化
临床发现,CFS患者经常主诉头痛、健忘、注意力分散、睡眠异常[26],所以越来越多的机制类研究集中于中枢方面。有影像学资料显示,CFS患者呈现脑萎缩信号特征,主要表现为大脑灰质含量减少而白质高信号(WMHs)。注射BA誘导的CFS小鼠海马神经元凋亡增加以及海马组织萎缩;给予治疗后,CFS 小鼠海马组织重量恢复到正常小鼠水平,海马区神经元凋亡减少且新生神经元增多[27-28],海马区BDNF mRNA表达下降[28]。这些研究均提示CFS的发生与海马区神经元的损伤有一定的关系。ERK1/2信号通路是MAPK通路中非常活跃的通路之一,遵循三级酶促级联反应,即Ras-Raf-MEK-ERK途径,ERK/CREB/BDNF通路参与促进细胞增长、发育、增殖、分化等多种生理、病理过程,ERK通路可从多种途径在学习记忆的形成过程中发挥作用[29] 。Kelleher等[30]通过实验研究得出ERK可直接调控与LTP形成、关乎记忆功能的必要的树突蛋白的合成,这表明ERK是促进神经细胞结构蛋白合成的激酶之一。张亚军[16]采用束缚加强迫游泳建模CFS小鼠,海马区CREB磷酸化水平、BDNF蛋白表达量显著下降。本研究中CFS大鼠海马P-ERK、CREB、BDNF蛋白表达量均显著性下降,而P-CREB蛋白表达量无明显变化,说明CFS建模可能抑制了ERK/CREB/BDNF信号通路蛋白的表达;而CREB、BDNF蛋白含量均非常显著性下降,猜想可能与CREB、BDNF直接参与保护、促进神经结构和功能的可塑性有关。
3.4 有氧运动对大鼠海马区P-ERK、CREB 、P-CREB、BDNF蛋白表达的影响
有研究表明,8周自主跑轮可以非常显著性的促进大鼠海马P-ERK的表达[31] ,8周游泳训练可以显著性地上调大鼠海马内BDNF mRNA的表达[32]。运动预干预可以有效抵抗损伤引起的学习记忆能力下降。而过度运动对机体形成不良应激可以引起大鼠海马损伤,引起BDNF表达量下降[33]。3周游泳运动可非常显著性地上调大鼠海马区P-ERK、CREB、P-CREB、BDNF蛋白的表达[34]。本实验中单纯运动组P-ERK、CREB、P-CREB、BDNF蛋白含量均显著性高于正常对照组,表明运动可以促进ERK信号通路蛋白的表达,与文献结果一致。
CFS大鼠3周自然恢复后P-ERK、CREB蛋白含量均显著性升高,P-CREB、BDNF蛋白含量均显著性低于正常对照组,这与张亚军[16]采用束缚加强迫游泳致CFS小鼠模型经过7 d、10 d自然恢复后,CREB磷酸化水平和BDNF表达均显著性低于正常对照组结果一致,说明在应激源消失后信号通路蛋白表达有一定的自我恢复能力,但通路下游CREB蛋白磷酸化水平及 BDNF蛋白表达恢复能力较差。
有研究发现,神经元再生比较集中的海马颗粒细胞下层及其附近有P-CREB的高水平表达, CREB能够增强海马颗粒细胞神经元的整合和功能的可塑性[35]。本研究中与空白对照组、CFS自然恢复组大鼠相比,CFS运动组大鼠海马组织四种蛋白表达量均显著性增加,且大鼠海马区神经元损伤恢复正常,说明有氧运动能有效促进CFS大鼠ERK/CREB/BDNF信号通路蛋白的表达,达到修复海马神经细胞损伤的效果。
CREB是细胞核内的转录因子,多条信号通路的核心连接点, CFS的发生引起ERK/CREB/BDNF蛋白下降可能有其他通路作用,具体通路机制还需要进一步研究。
4 结论
3周有氧运动可以激活正常大鼠海马ERK/CREB/BDNF信号通路,上调通路蛋白的表达;CFS的发生伴随大鼠海马各区神经元不同程度的损伤,且海马组织中ERK/CREB/BDNF信号通路蛋白表达下降;而有氧运动可以有效提高CFS大鼠海马组织ERK/CREB/BDNF信号通路蛋白表达,修复海马各区神经元损伤,可为CFS的治疗提供新的思路。
参考文献:
[1]PURI BK, JAKEMAN PM, AGOUR M, et al.Regional grey and white matter volumetric changes in myalgic encephalomyelitis (chronic fatigue syndrome): a voxel-based morphometry 3 TMRI study[J]. The British Journal of Radiology, 2012,85(1015): E270-E273.
[2]SCHOLZ J, DE LANGE FP, VAN DER MEER JW,et al. White matter changes following cognitive behavioural therapy in patients with chronic fatigue syndrome[J]. Neuroimage, 2009(47):s39-s41.
[3]JOKE S, GIJS B, PETER H,et al. Gray Matter Volume Reduction in the Chronic Fatigue Syndrome[J]. NeuroImage, 2005,26(3): 777-781.
[4]LANGE G, DELUCA J, JOSEPH A,et al. Brain Mri Abnormalities Exist in a Subset of Patients with Chronic Fatigue Syndrome[J]. Journal of the Neurological Sciences, 1999, 171(1): 3-7.
[5]SHIN S,LE LJ,EVERETT LJ,et al. CREB mediates the insulinotropic and anti-apoptotic effects of GLP -1 signaling in adult mouse beta-cells[J].Mol Metab,2014(8):803-812.
[6]SCOTT BITNER R. Cyclic AMP response element-binding protein(CREB)phosphorylation:a mechanistic marker in the development of memory enhancing Alzheimer's disease therapeutics[J]. Biochem Pharmacol,2012(6):705-714.
[7]Zheng F,Zhou X,MOON C,et al. Regulation of brain-derived neurotrophic factor expression in neurons[J].Int J Physiol Pathophysiol Pharmacol,2012(4):188-200.
[8]STULEMEIJER M, LWAM DE J, FISELIER TJW, et al. Cognitive Behaviour Therapy for Adolescents with Chronic Fatigue Syndrome: Randomised Controlled Trial[J]. British Medical Journal,2005,330(7481):14-17.
[9]SANTAELLA ML, IVONNE F, ORVILLE MD. Comparison of Oral Nicotinamide Adenine Dinucleotide (Nadh) Versus Conventional Therapy for Chronic Fatigue Syndrome[J]. Puerto Rico health sciences journal, 2004,23 (2): 89-93.
[10 ]臧鐳镭,宋月晗,吴凤芝,等.从肝脾失调探讨心理疲劳治疗的研究与思考[J].现代中医临床,2015,22(6):50-52.
[11]赵学林,邵淑凤.慢性疲劳综合征的常见原因及防治对策[J].医学综述,2008(2):290-291.
[12]诸毅晖,梁繁荣,成词松,等.电针肾俞、足三里治疗慢性疲劳综合征的随机对照研究[J].上海中医药杂志,2008, 42(10):48-50.
[13]Yi-Wei T, Yea-Ru Y, PAULUS S,et al. Intermittent Hypoxia after Transient Focal Ischemia Induces Hippocampal Neurogenesis and C-Fos Expression and Reverses Spatial Memory Deficits in Rats[J]. Plos One, 2011, 6(8):E24001.
[14]LECONTE C, MARIANNE L, MICHEL B,et al. Repeated Mild Hypoxic Exposures Decrease Anxiety-Like Behavior in the Adult Mouse Together with an Increased Brain Adrenomedullin Gene Expression[J]. Behavioural Brain Research, 2012,230(1):78-84.
[15]戈含笑,魏宏文,张有志,等.有氧运动对慢性应激大鼠脑海马区神经可塑性的影响[J].北京体育大学学报,2017,40(5):39-45.
[16]张亚军. 低氧暴露对慢性疲劳综合征小鼠认知情绪的调节作用及机制研究[D].上海:上海体育学院,2013.
[17]孟昭琴,司绪岚,房冬梅. 游泳和五味子多糖对CFS大鼠的干预及IFN-γ,IL-4等指标的影响[J]. 江苏师范大学学报:自然科学版,2012,30(3):73-78.
[18]王向义,刘长征,雷波. 针刺对慢性疲劳综合征大鼠血清Th1/Th2的影响[J]. 针刺研究,2014(5):387-389.
[19]孟盼. 从cAMP-CREB-BDNF信号通路研究百事乐胶囊对抑郁模型大鼠海马神经再生的影响[D].长沙:湖南中医药大学,2013.
[20]GUPTA A,VIJ G,CHOPRA K.Possible Role of Oxidative Stress and Immunological Activation in Mouse Model of Chronic Fatigue Syndrome and Its Attenuation by Olive Extract[J]. JNeuroimmunol,2010,226(1/2):3-7.
[21]SACHDEVA AK,KUHAD A,TIWARI V,et al. Epigallocatechin Gallate Ameliorates Chronic Fatigue Syndrome in Mice: Behavioral and Biochemical Evidence[J]. Behav Brain Res,2009,205(2):414-420.
[22]VIJ G,GUPTA A,CHOPRA K. Modulation of Antigen-Induced Chronic Fatigue in Mouse Model of Water Immersion Stress by Naringin,a Polyphenolic Antioxidant[J]. Fundam Clin Pharmacol,2009,23(3):331-337.
[23]Sheng R,Xu X,Tang Q,et al. Polysaccharide of Radix Pseudostellariae Improves Chronic Fatigue Syndrome Induced by Poly I:C in Mice[J]. Evid Based Complement Alternat Med,2011:840516.
[24]姚斐,房敏. 不同强度按压背俞穴对CFS大鼠行为学及体重的影响[J]. 北京中医药大学學报,2011(10).
[25]黄瑶,张振贤,陈若宏,等. 温振运气方对慢性疲劳综合征患者负性情绪及脑海马区功能代谢影响的临床研究[J].上海中医药杂志,2016(10): 60-63.
[26]付玉娜,李佩哲,刘陨君,等.背部推拿结合针刺及药物疗法治疗慢性疲劳综合征失眠[J].吉林中医药,2019,39(7):969-971.
[27]Junji M, Rui C, JUN-ICHI Y,et al. Resveratrol improves hippocampal atrophy in chronic fatigue mice by enhancing neurogenesis and inhibiting apoptosis of granular cells.[J]. Biological & pharmaceutical bulletin,2011,34(3): 354-359.
[28]Rui C, Junji M, JUN-ICHI Y, et al. Brain Atrophy in a Murine Model of Chronic Fatigue Syndrome and Beneficial Effect of Hochu-ekki-to (TJ-41)[J]. Neurochemical Research,2008,33(9):1759-1767.
[29]FELD M, DIMANT B, DELORENZI A,et al. Phosphorylation of Extra-Nuclear Erk/Mapk Is Required for Long-Term Memory Consolidation in the Crab Chasmagnathus[J]. Behavioural Brain Research, 2005,158 (2): 251-261.
[30]KELLEHER RJ, GOVINDARAJAN A, JUNG HY, et al. Translational Control by Mapk Signaling in Long-Term Synaptic Plasticity and Memory[J]. Cell,2004,116(3):467-479.
[31]赵燕. 运动对慢性应激大鼠抑郁行为及脑ERK/CREB通路作用[J]. 中国公共卫生,2013(3):368-370.
[32]徐波,杨毅飞,季浏,等.游泳训练对大鼠学习记忆能力和海马、纹状体内BDNF mRNA表达的影响[J].北京体育大学学报,2007,30(10):1352-1354.
[33]乔德才,侯莉娟.运动疲劳对大鼠海马和纹状体BDNF、GFAP蛋白表达的诱导作用[J].北京体育大学学报,2007,30(6).
[34]李艳荣,兰顺领,晋倩.有氧运动对大鼠海马和前额叶皮层ERK/CREB/BDNF信号通路的影响[J].韶关学院学报,2019,40(6):87-91.
[35]李华南,韩一豪,刘洋,等.腹部推拿对慢性疲劳综合征模型大鼠行为学及海马区BDNF、CREB mRNA表达的影响[J].中国中医基础医学杂志,2019,25(6):750-753.

