不同NaHCO3 碱度对瓦氏雅罗鱼肾和肠组织显微结构的影响
高珊,赵雪飞,常玉梅,孙博,梁利群,张立民,董志国
(1.江苏海洋大学海洋生命与水产学院,江苏 连云港 222000;2.中国水产科学研究院黑龙江水产研究所,中国水产科学研究院特殊生境鱼类种质特性与抗逆育种重点实验室,农业农村部淡水水产生物技术与遗传育种重点实验室,淡水鱼类育种国家地方联合工程实验室,黑龙江 哈尔滨 150070;3.东北林业大学野生动物与自然保护地学院,黑龙江 哈尔滨 150040)
与陆生动物相比,鱼类为了适应水环境盐度、碱度、离子组成及pH 的变化,必须拥有高效的离子和渗透压调节机制[1]。鳃、肾、肠是鱼类渗透压调节的重要器官,在维持水盐平衡中发挥重要作用。但是,鱼类生存环境不同,参与渗透调节的组织器官略有侧重。淡水鱼类处在低渗环境中,不喝水或摄食时少量饮水,鳃和肾组织发挥主要作用[2];海水鱼类处在高渗环境中,吞饮海水补偿水分的被动损失,鳃和肠组织发挥主要作用[3,4]。
我国约有0.46 亿hm2高碳酸盐碱度(carbonate alkalinity,CA)、高pH、离子组成复杂的低洼盐碱水域,有别于淡水和海水[5]。研究发现,大部分传统淡水经济鱼类可在低碱度水体(CA<10 mmol)中存活,这类水体已基本开发利用;而中(CA10~30 mmol)、高(CA>30 mmol)碱度水体碱度和pH 偏高,渔业利用率极低,尚未得到有效开发[6]。目前采用高通量测序技术,筛选了许多耐中、高碱度土著鱼类鳃和肾组织基因的表达差异,如马加迪罗非鱼Oreochromis alacalicus grahami[7]、青海湖裸鲤Gymnocypris przewalskii[8]和瓦氏雅罗鱼Leuciscus waleckii[9-11]等,认为这两个组织富集了大量参与离子和渗透压调节的关键基因。但也有认为,肠道组织也参与耐盐碱鱼类的渗透调节。如Wood 等[12]在青海湖裸鲤前肠收集到了液体,王萍等[13]通过室内碱度短期胁迫实验发现,湖水组直肠排泄物的HCO3-浓度最高,支持湖裸鲤肠道在其渗透压调节中的重要作用。
瓦氏雅罗鱼在我国黑龙江、辽河、黄河流域及内陆盐碱湖泊均有分布,具有极强的耐高碱特性,能耐受内蒙古达里诺尔湖碳酸盐碱度高达54 mmol、pH9.6 的极端恶劣环境[14,15]。解析瓦氏雅罗鱼耐高碱的生理和分子机制,培育耐高碱新品种,对推进盐碱水域的开发利用具有重要的战略意义。前期虽通过高通量测序在鳃和肾组织中发掘了大量参与渗透压调节的候选基因,但是,缺乏这些组织的生理适应性变化数据,对耐盐碱候选基因在各组织的分布、定位及定量表达研究进展缓慢;除鳃组织外,肾和肠是否参与渗透压调节尚不清楚。
本研究通过观察室内中、高碳酸盐碱度胁迫后,达里诺尔湖瓦氏雅罗鱼(碱水种)和松花江瓦氏雅罗鱼(淡水种)肾和肠的组织显微结构,分析肠道内容物的pH,旨在探讨这两种组织耐中、高碱度中的作用,为瓦氏雅罗鱼耐高碱生理和分子机制研究及淡水经济鱼类向中、高碱度水体移植驯化提供科学依据。
1 材料与方法
1.1 材料
实验鱼为内蒙古达里诺尔湖瓦氏雅罗鱼自交F2和松花江瓦氏雅罗鱼自交F2,饲养于黑龙江水产研究所呼兰实验站。选择大小一致,体质量为(22.24±4.68)g 的个体45 尾,运回实验室,在循环可控水族箱(42.6cm×28.4cm×29.3cm)中暂养7d。实验用水为过滤、曝气24 h 的自来水。
1.2 方法
实验设置对照组(CA0)、NaHCO3碱度30mmol(CA30)、NaHCO3碱度50mmol(CA50)3 组,每组3个重复,每个重复5 尾鱼。以5 mmol/d 的速度缓慢提升,碱度至30mmol和50mmol后维持该碱度22d。实验期间,每天换水1/2,不投喂,采用YSI 多功能水质分析仪监测水质温度(T)、pH、溶氧度(DO)、盐度(SAL)、氨氮(NH4+,NH3)含量等指标,用酸碱滴定法测定水体碱度。不同碱度胁迫期间,各实验组水体检测指标见表1。
碱度胁迫实验结束时,每组采5 尾鱼的干肾和肠组织用于组织切片和测定肠道内容物的pH。参考金建丽等[16]的方法,将肠道按回折度分为前肠、中肠和后肠;参考Bergman 等[17]的方法,用镊子将肠道内容物挤出放入事先称量好的1.5mL 离心管中,加入200μL 灭菌水,漩涡震荡充分混匀,静置30min 后,12000r/min 离心5min,取上清测定pH;最后将前、中、后肠组织在Bouin’s 液(苦味酸饱和溶液+福尔马林25mL+冰醋酸5mL)固定24h 后,转移至70%乙醇于4℃保存备用。肾的固定方法与肠道相同。
用梅特勒-托利多pH 计(SevenCompact,德国)测定碱水种和淡水种肠前、中、后部内容物上清的pH。
组织切片及拍照观察参考杨建等[18]的方法。采用光学显微镜观察、拍照(Olympus BX53&DP74)。测微尺测定肾小球直径、近曲小管管径、肠道黏膜褶皱高度、环肌厚度、纵肌厚度等指标。
1.3 数据处理
实验数据以平均值±标准差表示,采用SPASS13.0 软件进行单因素方差分析(One-way ANOVA)。用Duncan 法进行组内多重比较分析,用t 检验比较分析组间差异。P<0.05 具有显著差异,P<0.01 具有极显著差异。
2 结果与分析
2.1 不同NaHCO3 碱度对瓦氏雅罗鱼肾显微结构的影响
组织切片显示,瓦氏雅罗鱼的肾组织由肾小球、第一近曲小管、第二近曲小管集合管和远曲小管组成。
正常条件下(CA0),两种实验鱼肾脏较为饱满,毛细血管发达,肾小球和肾小管完整;肾小球大多位于肾组织的边缘。第一近曲小管十分发达,管腔不规则,上皮细胞呈柱状;第二近曲小管呈圆形,管壁由单层柱状上皮细胞组成;远曲小管管腔大小不规则;集合管形状不规则,管径大于近曲小管(图1)。
NaHCO3碱度胁迫组鱼的肾小球和肾小管随着碱度升高,均发生了比较明显的皱缩(图1)。由表2可知,与对照组相比,随着碱度升高,两种实验鱼的肾小球直径和第二近曲小管管径均变小,收缩显著(P<0.05);CA 50 组碱水种的收缩程度更为明显,各肾单元均出现比较明显的空白间隙,肾小管管径变窄或无(图1)。
2.2 不同NaHCO3 碱度对瓦氏雅罗鱼肠内容物pH 的影响
由于碱水种淡水对照组数据缺失严重,故以淡水种淡水对照组的数据作为对照列入表3。由表3可知,对照组和碱度胁迫组瓦氏雅罗鱼肠道pH 呈现低-中-低的趋势,即肠道中部pH 较高。
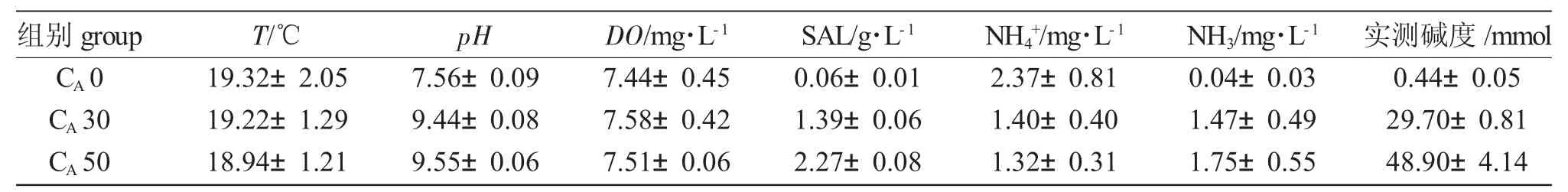
表1 对照组和实验组水体检测指标Tab.1 Water indicators in control group and experimental groups
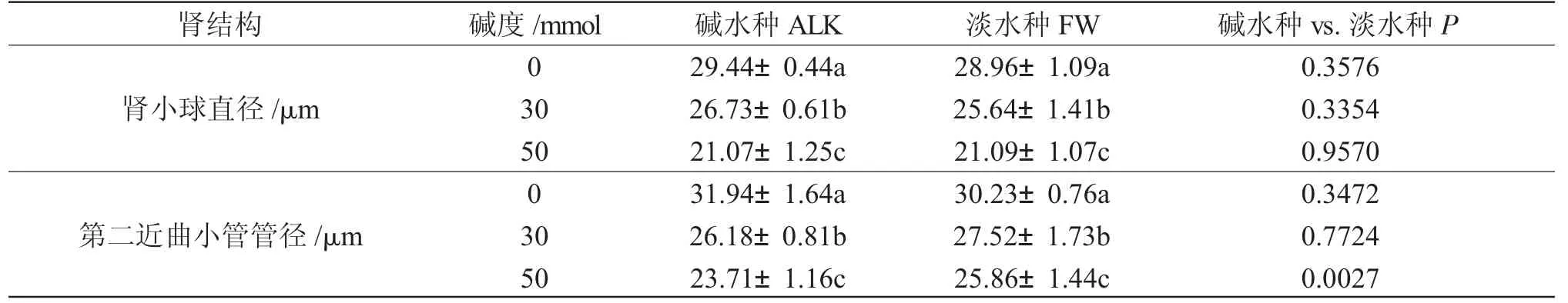
表2 不同NaHCO3 碱度对瓦氏雅罗鱼肾显微结构的影响(n=9)Tab.2 Effect of different NaHCO3 alkalinities on the micro-structure of kidney in Amur ide
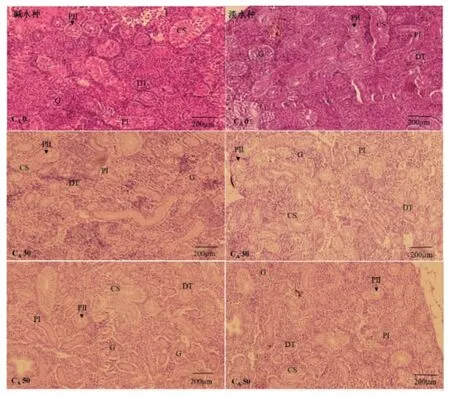
图1 不同碱度对碱水种和淡水种瓦氏雅罗鱼肾组织结构的影响Fig.1 Effect of different NaHCO3 alkalinity on the microstructure of kidney in alkaline water species and freshwater species of Amur ide
2.3 不同NaHCO3 碱度对瓦氏雅罗鱼肠显微结构的影响
组织切片显示,瓦氏雅罗鱼肠道由内至外分别由黏膜层、黏膜下层、肌肉层和浆膜层组成,肌肉层包括环肌和纵肌(图2)。
正常条件下(CA0),两种实验鱼的肠道黏膜层、黏膜下层、肌肉层、浆膜层完整,纹状缘发达,固有膜与粘膜下层界限不明显。两种实验鱼的肠粘膜褶皱均呈纵向“Z”形。从前肠到后肠,黏膜褶皱高度逐渐降低,纵肌变薄,环肌变厚(表4,图3)。两种实验鱼的前肠和中肠均观察到杯状细胞,位于黏膜层,呈圆形或椭圆形,细胞松散,分布不均;苏木精-伊红染色(hematoxylin-eosin staining,HE)染色后,呈透明状(图3)。

图2 瓦氏雅罗鱼肠道横切面和纵切面显示图Fig.2 Patterns of transversal and longitudinal sections of intestine in Amur ide
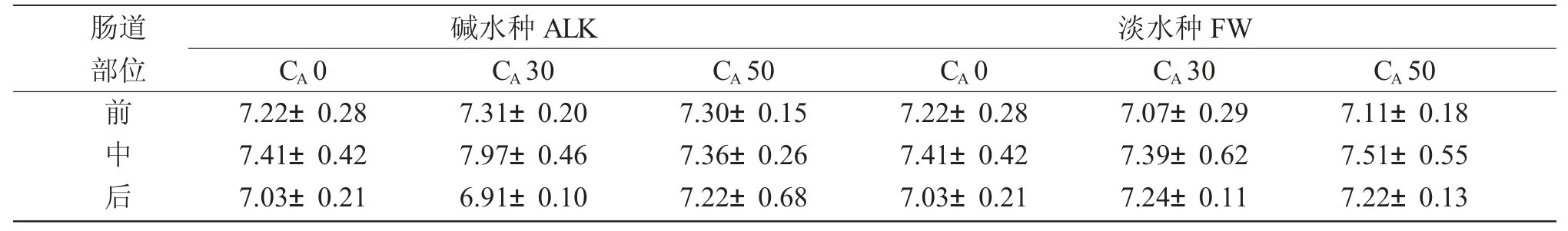
表3 不同NaHCO3 碱度对瓦氏雅罗鱼肠道内容物pH 的影响(n=5)Tab.3 Effect of different NaHCO3 alkalinities on intestine pH in Amur ide(n=5)
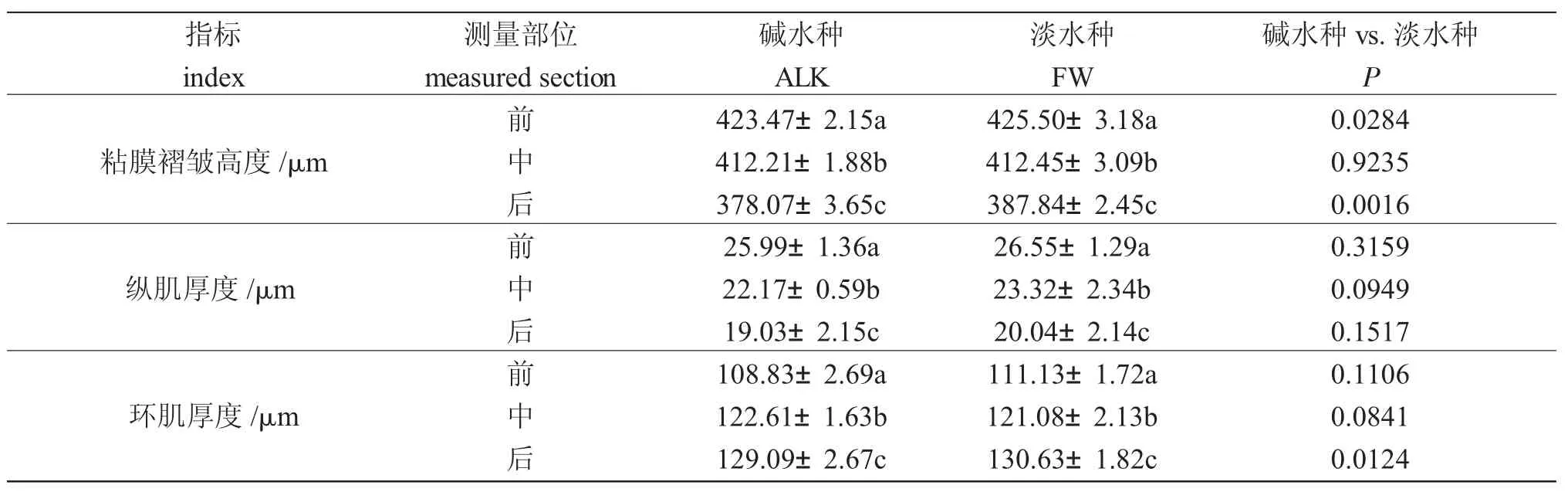
表4 瓦氏雅罗鱼肠道基本结构部分测量指标Tab.4 Some measured indices of basic structure of intestine in Amur ide
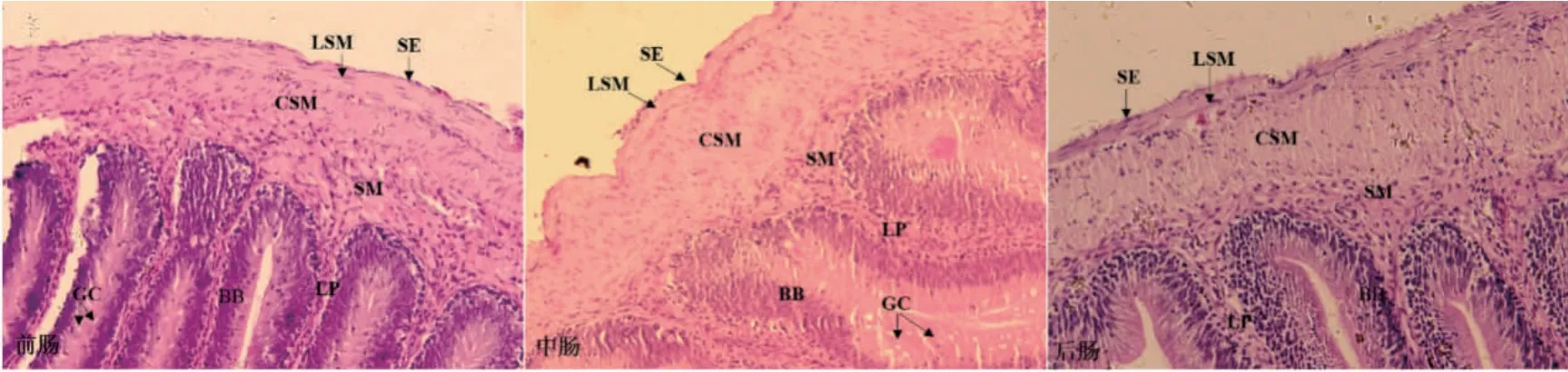
图3 瓦氏雅罗鱼肠道(前、中、后)肌肉层显微模式图Fig.3 Microstructure patterns of muscle layer of intestine(foregut,midgut,and hindgut)in Amur ide
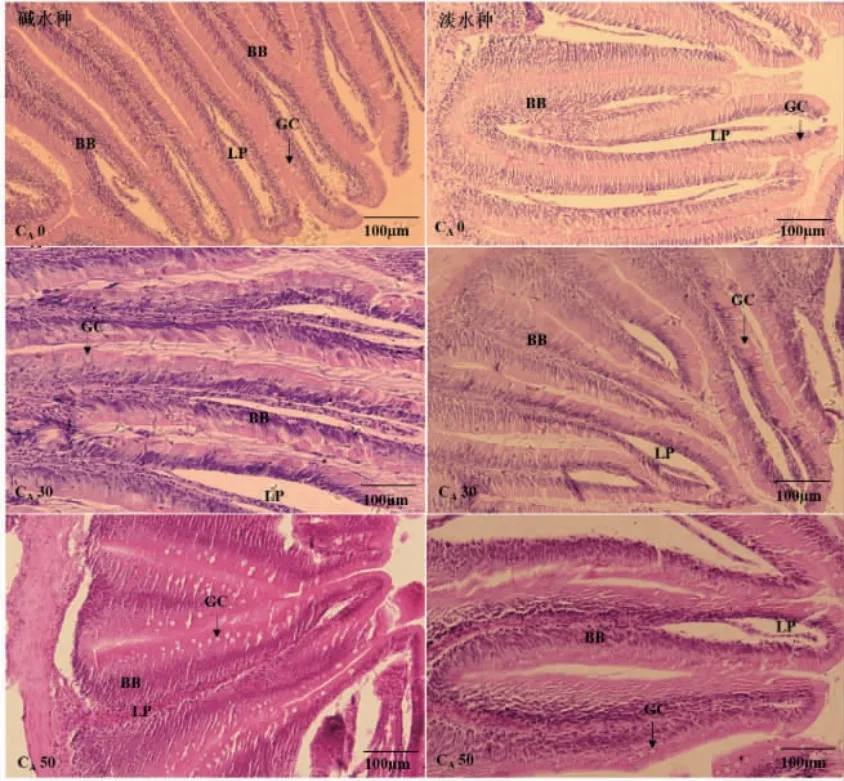
图4 瓦氏雅罗鱼碱水种和淡水种前肠显微模式对比图Fig.4 Microstructure comparison of foregut between alkali-adapted species and freshwater species of Amur ide
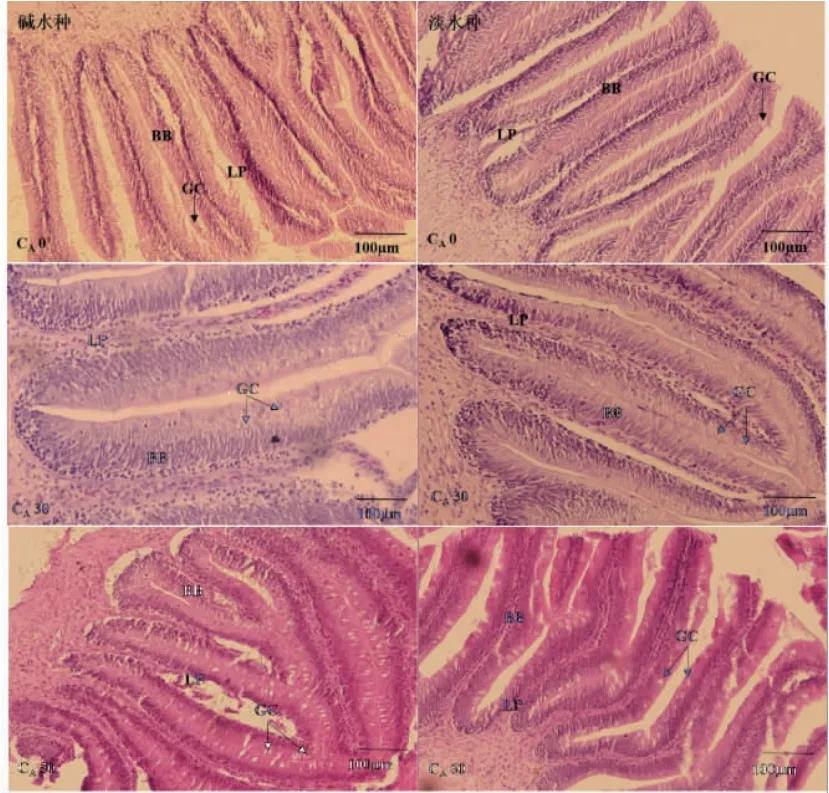
图5 瓦氏雅罗鱼碱水种和淡水种中肠显微模式对比图Fig.5 Microstructure comparison of midgut between alkali -adapted species and freshwater species of Amur ide
碱度胁迫下,随着碱度升高,两种实验鱼前肠中的杯状细胞数量逐渐增多,杯状细胞大而松散(图4);中肠杯状细胞小而密集,尤其在CA30 时,两种实验鱼杯状细胞富集更为明显(图5);在碱度胁迫下碱水种后肠有少量杯状细胞,而淡水种则未观察到杯状细胞(图6)。
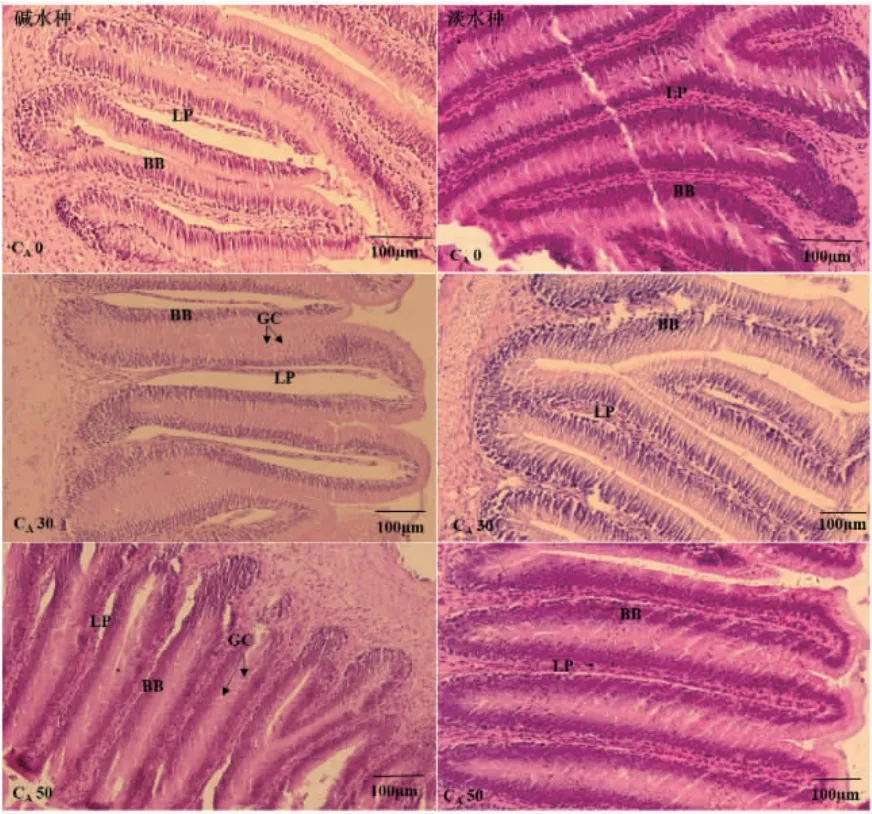
图6 瓦氏雅罗鱼碱水种和淡水种后肠显微模式对比图Fig.6 Microstructure comparison of hindgut between alkali -adapted species and freshwater species of Amur ide
3 讨论
3.1 NaHCO3 碱度对瓦氏雅罗鱼肾组织微观结构的影响
肾脏是淡水鱼类渗透压调节的重要器官,肾小球可过滤血液里的血细胞和大分子蛋白质,肾小管可重吸收水分、葡萄糖、氨基酸等物质[19]。本研究发现,正常条件下,两种实验鱼肾脏中肾小球和肾小管完整,肾小球发达,肾小管粗壮。随着碱度的升高,两种实验鱼的肾小球直径和第二近曲小管管径均变小,收缩显著(P<0.05)(表2)。尤其在接近达里诺尔湖碱度的条件下(CA50),碱水种各肾单元收缩更为明显(图1),表明碱度胁迫抑制瓦氏雅罗鱼的部分肾功能。该研究结果与耐盐碱的卡拉白鱼Chalcalburnus tarichi、青海湖裸鲤的研究结果相似。Oĝuz[20]比较了卡拉白鱼淡水群体和盐碱湖泊群体肾显微结构,发现盐碱湖泊群体肾小球结构萎陷,集合小管皱缩,肾单元的过滤速率显著降低。Na+-K+-ATPase(NKA)标记离子细胞发现,卡拉白鱼湖水族群和青海湖裸鲤一样,NKA 活性下降了30%,明显抑制了肾功能[12];Galat 等[21]通过比较生活在不同盐碱湖泊的钩吻鳟的肾组织显微结构发现,其肾组织均出现不同程度的退化,肾小球缩小甚至消失;杨建等[18]研究盐度对5 种淡水鱼幼鱼的肾组织的影响发现,幼鱼在低盐胁迫下,肾小球发达,肾小管粗壮,而在高盐胁迫下肾组织退化,肾小管缩短。可以看出,鱼类肾脏的萎缩程度与水体环境的渗透压呈正比[22],盐碱水和海水均属于高渗环境,明显抑制了鱼的肾功能。
3.2 NaHCO3 碱度对瓦氏雅罗鱼肠组织微观结构的影响
肠道能有效吸收液体弥补高渗环境造成的脱水,也是海水鱼类渗透压调节的重要器官[23]。本研究采用NaHCO3对两种驯养在淡水池塘的瓦氏雅罗鱼进行碱度胁迫实验,其水体相对与淡水环境来讲,属于高渗环境。前期已有学者认为,生活在高盐碱湖泊的鱼类行为生理与海水鱼类相似,可通过吞饮湖水调节渗透压。Wood 等[24]研究发现,马加迪罗非鱼以(8.01±1.29)mL/(kg·h)速率吞饮湖水,并通过鳃泌盐,保持体内较低的渗透压;随后Wood 等[12]在裸鲤的前肠部分收集到液体,并发现其肠内的Mg2+和Ca2+浓度均高于血浆含量,认为裸鲤与海水鱼类的肠道离子吸收机制相似;王萍等[13]的室内碱度短期胁迫实验发现,湖水组直肠排泄物的HCO3-浓度最高,支持湖裸鲤肠道在其渗透压调节中的重要作用。本研究发现,瓦氏雅罗鱼肠道前、中、后部组织结构基本相同,主要差异表现在黏膜褶皱高度、环肌和纵肌厚度(表3);另外,从两种实验鱼数据可以看出,二者主要在肠道后部的黏膜褶皱高度、环肌厚度以及杯状细胞数量存在显著差异(P<0.05)。其中,杯状细胞数量随着碱度升高显著增加,尤其是肠道中部增加较为明显。瓦氏雅罗鱼碱水种肠道后部在碱度胁迫下也出现了少量杯状细胞,而淡水种则未观察到(图6)。肠道内的杯状细胞增多,致使分泌黏液量增多,以防止肠道受损[25]。两种实验鱼前、中、后肠的pH 呈“低-高-低”的变化趋势,并未出现像马加迪罗非鱼从前肠到后肠pH逐渐升高的趋势[17],且远低于水环境pH(9.44~9.55)。因此,瓦氏雅罗鱼是否吞饮湖水,通过肠道参与渗透压调节,尚需要更多的生理和分子生物学证据。

