胃癌中CXCR1的表达及其临床意义
王娜娜,王岳君,冯天一,黄伟超,章俊生,孟 刚,3
胃癌是全球第二大肿瘤相关性致死因素[1]。根治性手术是治疗胃癌的主要方法,但胃癌患者初期症状隐匿,超过半数患者在疾病进展期时被确诊。侵袭和转移是导致胃癌患者复发和死亡的主要原因。长期以来肿瘤微环境一直被认为在肿瘤的发生和发展中起重要作用[2];在肿瘤微环境的众多因素中,炎症介质与肿瘤的进展关系密切[3]。由于IL-8是肿瘤微环境的重要组分,也是维持癌细胞干性的关键细胞因子,趋化因子与其受体相互作用与肿瘤的进展密切相关[4]。目前,关于IL-8的受体CXCR1在胃癌组织中表达的报道较少。本实验收集141例胃癌患者的临床病理资料,初步探讨CXCR1在胃癌中的表达及其与临床病理特征的关系,旨在提高临床和病理医师的认识水平。
1 材料与方法
1.1 临床资料收集2015~2019年安徽医科大学第四附属医院存档的行胃癌根治性切除标本141例,所有病例均为首发,并经病理学证实为胃癌,术前均未行放、化疗等抗肿瘤治疗。另收集癌组织及其对应癌旁>5 cm正常胃黏膜标本作为对照。患者年龄26~85岁,中位年龄67岁,男性102例,女性39例。所有组织标本均经石蜡包埋,每张切片厚3 μm,备用。临床分期(TNM):T1/2,N0:26例;T1/2,N+:5例;T3/T4a,N0:22例;T3/T4a,N+:82例;T4b,M+:6例。本实验经安徽医科大学第四附属医院伦理委员会批准,所有患者均知情同意。
1.2 方法选取胃癌组织和癌旁正常胃黏膜组织的存档蜡块,3 μm厚连续切片。免疫组化采用MaxVision两步法染色,一抗IL-8RA(CXCR1)(鼠单克隆抗体B-1,1 ∶300)购自Santa Cruz公司,CK(鼠单克隆抗体,AE1/AE3)及其余相关试剂均购自福州迈新公司。以PBS代替一抗作为阴性对照,组织内中性粒细胞、单核细胞、内皮细胞等作为阳性内对照。
1.3 结果判断所有切片均采用数字扫描仪转换成数字切片,免疫组化染色由两位病理医师采用双盲法进行半定量评分[5],每个标本随机选取10个高倍视野,对阳性细胞着色强度和所占百分比进行评分。CXCR1阳性着色定位于细胞膜和细胞质,以中性粒细胞、单核细胞等作为阳性内对照。(1)按肿瘤细胞阳性染色强度计分:未着色为0分,淡黄色为1分,中等棕黄色2分,深棕褐色为3分;(2)按肿瘤细胞着色的百分比计分:无阳性细胞为0分,≤10%为1分,11%~50%为2分,51%~80%为3分,>80%为4分;将上述两项评分结果相乘:<3分为阴性,≥3分为阳性。
1.4 统计学分析采用SPSS 21.0软件进行统计学分析。对CXCR1蛋白在胃癌组织中的表达特点和与各临床病理参数的关系采用χ2检验,分类变量采用频率描述。以P<0.05为差异有统计学意义。
2 结果
2.1 癌旁正常胃黏膜及胃癌组织中CXCR1的表达本实验结果显示,CXCR1在癌旁正常胃黏膜组织表达较弱或不表达,表达于嗜中性粒细胞、单核细胞、内皮细胞表面和部分胃癌细胞表面,其阳性率与肿瘤的分化程度有关。胃癌组织高+中分化组阳性率为36.5%,明显低于低分化组(64.1%)(P=0.001 1,图1)。
2.2 胃癌组织中CXCR1的表达141例胃癌有脉管侵犯组织中,CXCR1阳性者63例(61.8%);明显高于无脉管内侵犯的胃癌组(25.6%),差异有统计学意义(P=0.000 1)。本组采用免疫组化MaxVision两步法和HE染色,镜下可见CXCR1、CK在胃癌脉管内癌栓或胃癌组织中表达时常伴中性粒细胞簇的存在,且中性粒细胞的形态有差异(图2)。
2.3 胃癌中CXCR1表达与临床病理特征的关系141例胃癌组织中,CXCR1阳性73例(51.78%),CXCR1阴性68例(48.22%);CXCR1表达与患者性别、年龄、肿瘤大小无关;与胃癌分化(P=0.001 1)、肿瘤浸润深度(P=0.017 0)、脉管侵犯(P=0.000 1)、神经侵犯(P=0.000 1)和淋巴结转移(P=0.000 1)、TNM分期(P=0.004 1)均有关(表1)。
3 讨论
CXCR1基因组首先由Holmes等[6]成功克隆。人类CXCR1基因定位于染色体2q35,包含2个外显子与1个长约1.7 kb的内含子,包含1个糖基化N-端和1个具有7次跨膜域的G蛋白偶联受体[7]。CXCR1在机体内主要表达于中性粒细胞表面,当有外来病原体入侵时,炎症组织释放IL-8等趋化因子,经血液循环与中性粒细胞表面的CXCR1/2结合,从而趋化中性粒细胞迁移至炎症发生部位吞噬和杀灭病原体[8]。IL-8与其受体的结合可导致多个主要下游信号传导途径的激活,其中包括:磷脂酰肌醇-3激酶(PI3K)/AKT,磷脂酶C(PLC)/蛋白激酶C(PKC)和促分裂原活化蛋白激酶(MAPK),Rho家族GTP酶和Janus激酶(JAK)等,从而在多方面促进了肿瘤的进展[9]。有研究表明[10],CXCL8/CXCR1除具有免疫调节作用外,还能影响肿瘤的微环境、调节肿瘤血管形成。肿瘤的生长和转移,关键在于肿瘤细胞的增殖、黏附、迁移、血管生成和免疫逃避的能力[11]。CXCR1/2受体在卵巢癌、肝细胞癌、前列腺癌、肾细胞癌、鼻咽癌、乳腺癌等肿瘤中均高表达,且与肿瘤的增殖、转移和血管生成有关[12-15],分析表明肿瘤细胞可分泌大量IL-8,与自身或其他肿瘤细胞表面的CXCR1/2受体结合,从而促进肿瘤组织的血管生成、肿瘤细胞增殖和转移。肿瘤细胞可以受到某些趋化因子的趋化作用而发生迁移,该性质类似于某些炎细胞的特性,如中性粒细胞;Bi等[16]研究表明,肾癌组织细胞分泌的IL-8,可促进肿瘤间质干细胞的迁移,人类多种肿瘤的发生涉及到上皮细胞-间质转化(epithelial to mesenchy-mal transition, EMT)[17],目前其具体的机制尚不清楚。
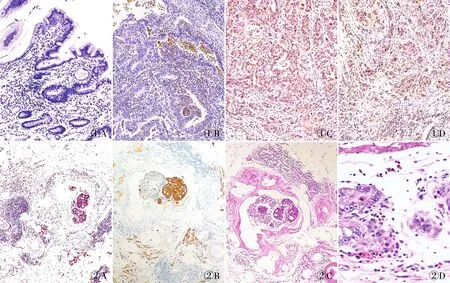
图1 A.CXCR1在癌旁正常胃黏膜组织中呈阴性,MaxVision两步法;B.CXCR1在部分高分化胃癌组织中呈阴性,MaxVision两步法;C.CXCR1在部分中分化胃癌组织中呈阳性,MaxVision两步法;D.CXCR1在部分低分化胃癌组织中呈阳性,MaxVision两步法 图2 A.胃癌脉管内癌栓及周围散在的肿瘤细胞中CXCR1呈细胞膜/细胞质阳性,MaxVision两步法;B.胃癌脉管内癌栓及脉管周围大量散在的肿瘤细胞中CK呈阳性,MaxVision两步法;C.胃癌脉管内癌栓旁伴大量中性粒细胞浸润;D.肿瘤周围中心粒细胞核形态多样,呈分叶状、圆形或不规则
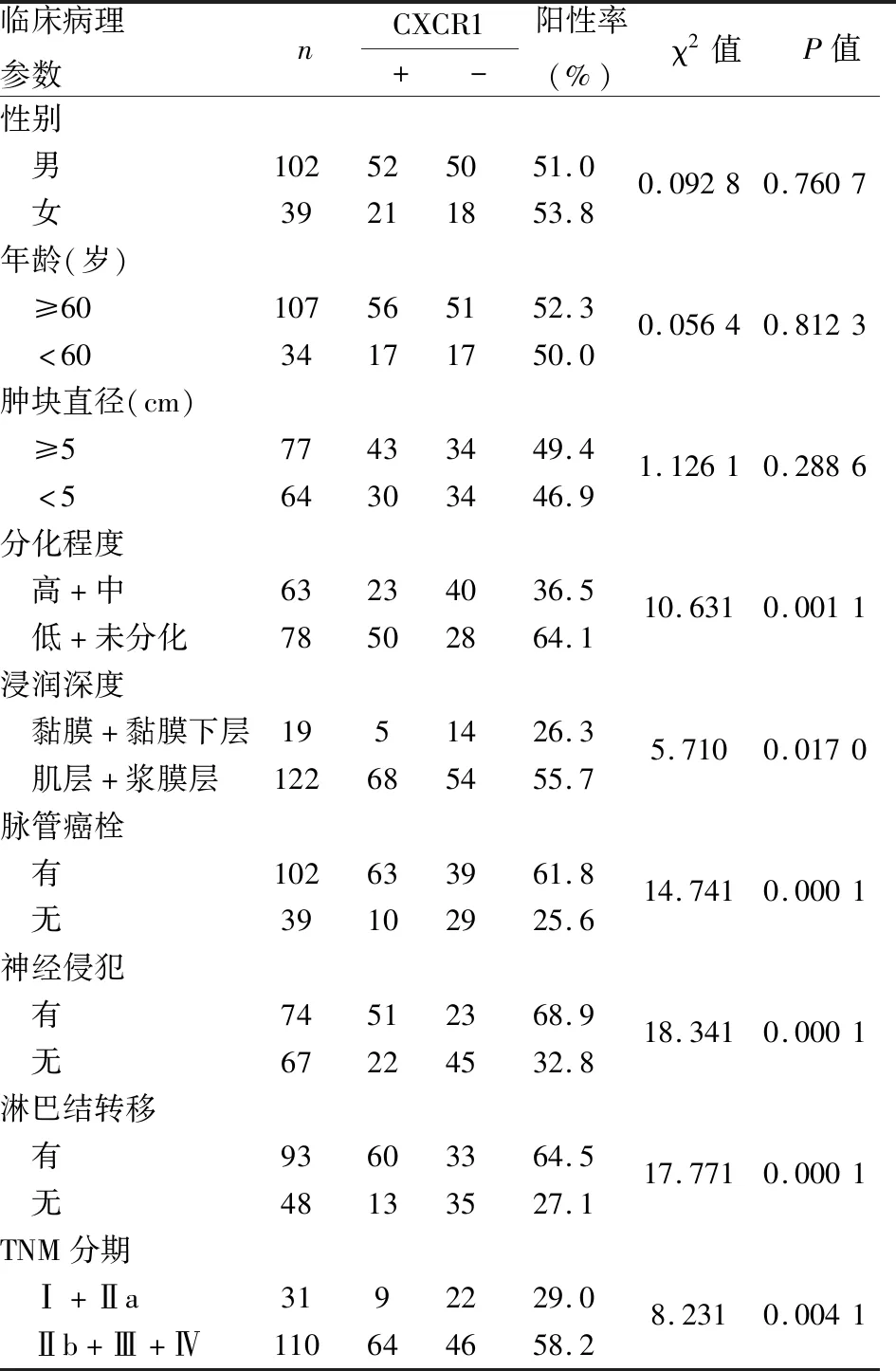
表1 胃癌组织中CXCR1表达与临床病理特征的关系
本组141例胃癌组织中,CXCR1在正常胃黏膜组织中不表达,其表达于嗜中性粒细胞、单核细胞、内皮细胞和部分胃癌组织及肿瘤相关间质细胞表面;CXCR1阳性者占51.78%(73/141),CXCR1阴性患者占48.22%(68/141);CXCR1表达与患者性别、年龄、肿瘤大小无关,与胃癌分化(P=0.001 1)、肿瘤的浸润深度(P=0.017 0)、脉管侵犯(P=0.000 1)、神经侵犯(P=0.000 1)和淋巴结转移(P=0.000 1)、TNM分期(P=0.004 1)有关,均提示CXCR1在胃癌的浸润和转移中起一定作用,与在其他肿瘤[11-14]中的表达和作用的研究结果一致。
本组实验还发现,CXCR1在胃癌脉管内癌栓或胃癌组织中表达,常伴中性粒细胞簇的存在,且中性粒细胞的形态有差异。有研究报道[18],中性粒细胞在肿瘤微环境中可被诱导分化为N1和N2两种亚型,其中N1型核在形态上呈分叶核,细胞毒性作用强,表达和分泌更多的促炎因子,能够趋化和诱导更多CD8+T细胞到达肿瘤部位,而抑制肿瘤的进展;而N2型在形态上细胞核分叶少,呈圆形或不规则,细胞毒性相对较弱,表达和分泌促炎因子较少,而VEGF等促进血管新生的因子增多,具有明显的促肿瘤作用。巴赛尔大学等[19]机构科学家研究表明肿瘤细胞会利用中性粒细胞来增强癌症的转移能力。因此,作者推测肿瘤组织或中性粒细胞、单核细胞表面表达CXCR1,与肿瘤微环境的主要成分IL-8相互作用,引起主要下游相关信号传导途径的激活,从而促进肿瘤的发展。
综上所述,胃癌组织中CXCR1表达与肿瘤浸润、转移有关,对胃癌组织中CXCR1表达与炎症因子的相互作用分析,为开发抑制胃癌转移的新型药物提供参考。

