国际子宫颈腺癌标准和分类(IECC)及进展
方三高,魏建国,王巍伟,薛德彬,李 力
子宫颈腺癌(endocervical adenocarcinoma, ECA)占子宫颈癌的20%~25%[1],近年其发病率及病死率逐年上升[2],患者趋于年轻化[3]。ECA临床症状不明显,病变部位深,阴道镜不易观察,取样困难,肿瘤异质性显著,有的形态存在交叉与重叠,相当一部分为非HPV相关性(non HPV-associated, NHPVA),免疫组化无特异性,给诊治带来挑战。2018年2月,Stolnicu等[4]收集全球7个不同机构的409例完整病例,其中297例制成组织芯片,通过免疫组化(p16、p53、vimentin、PR)和可识别18种高危型HPV RNA的原位杂交(in situ hybridization, ISH),首次利用形态学结合病因学对ECA进行分层,最终达成国际子宫颈腺癌标准与分类(International Endocervical Adenocarcinoma Criteria and Classification, IECC)共识。研究发现[5]IECC分类与肿瘤发展阶段、大小和席尔瓦浸润模式(silva pattern of invasion)等密切相关。另外,Hodgson等[6]验证表明一些临床病理特征不仅与患者预后不良相关,且观察者之间具有良好的临床一致性与诊断可重复性,报道指出IECC分类对ECA的管理具有实际意义。
1 ECA的IECC分类与WHO(2014)女性生殖系统肿瘤分类比较
两种分型均保留侵袭前或癌前病变——原位腺癌(adenocarcinoma in situ, AIS)。HPVA患者较年轻,中位年龄42岁,国际妇产科联合会(FIGO)分期多为Ⅰ+Ⅱ期,包括WHO(2014)女性生殖系统肿瘤分类的ECA(普通型)、黏液腺癌中的非特殊类型(not otherwise specified, NOS)、肠型、印戒细胞型、绒毛腺管状癌(villioglandular carcinoma)及新增病种“浸润性复层生黏液癌(invasive stratified mucin-producing carcinoma, ISMPC)”;NHPVA则包括黏液腺癌中的胃型(gastric type)、子宫内膜样癌、透明细胞癌、浆液性癌、中肾管癌;好发于老人,中位年龄55岁,肿瘤更大,FIGO分期更晚。无法通过IECC分类标准对肿瘤进行分类的病例被视为ECA-NOS或混杂型(miscellanous),仅占2%。高倍镜下(200倍)腔缘核分裂及凋亡小体若不明显,出现HPVA特征局灶或模糊,则认为肿瘤“具有有限的HPVA特征”,暂归为NHPVA中。IECC分类[4]与WHO(2014)女性生殖系统肿瘤分类[7]的对比详见图1。

图1 IECC分类与WHO(2014)女性生殖系统肿瘤中ECA分类:红色字体为HPVA,蓝色字体为NHPVA
2 IECC分类新增病种
IECC分类新增病种ISMPC原位对应者为复层产生黏液的上皮内病变(stratified mucin-producing intraepithelial lesion, SMILE),属于WHO(2014)女性生殖系统肿瘤AIS新增亚型。SMILE常伴随高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion, HSIL)或AIS其他变异型,其独立存在较为罕见,有时可见于鳞状细胞癌(squamous cell carcinoma, SCC)或ECA周围,细胞复层排列,轮廓圆形或呈小叶状分布,中表层细胞胞质含有黏液,并未形成明确腺体。ISMPC尽管柱状细胞呈复层,但侵袭性生长,肿瘤几乎完全(>90%)由含有黏蛋白的实性巢团构成,周围环绕栅栏状或镶嵌状排列的基底细胞/储备细胞。镜下易与腺鳞癌混淆,临床上复发率更高,预后不佳。
3 IECC分类的亮点
3.1 病因学依据根据IECC分类显示大多数ECA与HPV感染相关,尤其HPV 18、16和45[8]。子宫颈鳞柱交界区基底层有一组类似储备细胞的特殊种群,镜下呈低柱状/立方形,表达p63及CK7,是转化区一种特化的祖细胞或者干细胞样细胞,对致癌HR-HPV的攻击敏感性是其他细胞的15倍。感染后绝大多数病毒DNA以游离形式存在,为一过性,几年内逐渐被清除,但10%~20%呈持续性潜伏,感染早期即整合到宿主细胞,致E6、E7表达增加,E6使野生型p53降解,降低其抑癌作用,E7使Rb蛋白失活,失去对p16的抑制,引起细胞周期异常,促使宿主细胞突变,发生恶性转化并最终发展为癌。与游离型相比,整合后的HPV在宿主细胞内拷贝数少,敏感度低,易被漏检,但积累至一定程度则可通过免疫组化检测出来。因此,p16可作为高危型HPV感染的间接标志物或替代指标成为必查项目。如果≥80%的细胞观察到细胞核与细胞质呈弥漫大块状着色,则认为p16“过表达”;<80%的肿瘤细胞仅胞质斑片状表达,判为“斑驳”;如果未见染色,则为“阴性”。
3.2 获得基于Silva浸润模式的形态学支持正常子宫颈腺体可向深层内陷并逐级分支,形成复杂的“隧道样”结构;一些良性类似病变如隧道状腺丛(tunnel clusters, TC)、叶状子宫颈内膜腺体增生(lobular endocervical glandular hyperplasia, LEGH)等易与AIS及微小浸润性腺癌(microinvasion adenocarcinoma, MIA)混淆;而胃型腺癌大多分化良好,极高分化形式又称为微偏腺癌或恶性腺瘤,形态类似正常颈管型黏液上皮,核变圆形,不同程度由基底部上升到腔缘,染色质变深而胞质丰富,透明,双嗜性或轻度嗜酸。任何情况下p16均呈阴性,极易漏诊,但广泛取材,多点观察,可见腺体裂口、成角或出现分支及乳头,浸润深度超过子宫颈全层的2/3或>5 mm,紧邻厚壁血管或形成淋巴管血管侵犯(lymphovascular invasion, LVI),有时可见神经浸润及寻常部位的转移。HIK1083[9]及TFF2[10]免疫组化标记,有助于与其前驱病变或类似良性病变鉴别。ECA浸润深度的精确测量存在争议,浸润模式与患者淋巴结转移、子宫旁累及、肿瘤复发关系密切,而病理判读直接影响临床处理,为了避免漏诊导致治疗不足或误诊引起过度治疗,2013年Diaz De Vivar等[11]在Silva领导的多中心研究中,基于形态学用“浸润模式”取代传统的“浸润深度”,建立席尔瓦系统(Silva system);2016年Rutgers等[12]将其扩展到组织学描述;2017~2018年Roma和Park等进行一系列综述[13-14]。该系统不论浸润深度,只根据破坏性间质侵犯和LVI的程度将 ECA分为A、B、C三种模式[13](表1)。
尽管活检小标本仅代表病变的冰山一角,对于精准诊断仍存在局限性,但局部晚期(ⅠB2+ⅣA期)子宫颈癌(包括ECA)的标准治疗通常不行初级手术,而行术前放、化疗,活检材料往往是可获得的唯一组织,对确诊至关重要。临床医师可根据阴道镜异常表现或目视下的醋酸试验 (visual inspection with acetic acid,VIA),如子宫颈转化区绒毛样、片状、厚白上皮样改变等,选择可疑区域进行活检,对于定位不明者,12、3、6、9定点活检及子宫颈管搔刮并分装送检。模式A可“推挤”至子宫颈间质深部,位于较大血管附近。区分模式A和B,前提是对整个肿瘤进行全部取材,必要时深切,仔细观察,以除外<1 mm的破坏性浸润灶。对于那些间质促纤维反应、单个细胞浸润、出现LVI、高级别核型、分化差的实性区域或融合性乳头状结构,均应排除模式A;模式C和B的鉴别以破坏性浸润深度(depth of destructive invasion, DODI)≥5 mm(4倍视野)为界[15],模式B缺乏使恶性腺体分开的基质,仅在乳头核心内部存在基质。DODI概念的引入能够更安全地确定哪些病例可以保守治疗,哪些病变需要激进处理。活检、锥切或保留生育功能的根治性子宫颈切除标本中,当切缘阳性,不能以此诊断为模式A还是模式B;模式C肿瘤具有弥漫性破坏性侵犯,融合性病变充满4倍视野,或存在高级别结构如腺体融合、乳头状生长、混有肿瘤细胞的黏液湖形成、实性生长,以及频繁的LVI。值得注意的是:腺体的位置,包括浸润深度、大中型血管的关系与模式A的评定无关;活检标本不能评定模式A或B;存在混合模式,以从重原则、预后差为准,即出现模式C,模式A可以忽略,但最好报告各自比例。

表1 Silva systema分层系统将普通型ECA分型
a开放腺体(不完整的腺体)描述腺体具有不连续轮廓,显示出向间质破裂开口,常伴疏松间质和(或)炎性细胞浸润
分类好坏的判定标准在于是否有利于临床实践。活检标本出现模式A,应行LEEP/锥切/保留生育功能的根治性子宫颈切除,将肿瘤完整切除保证切缘≥3 mm并进行随访;若切缘阳性,需扩大手术再次评估,不用盆腔淋巴结清扫及辅助治疗;模式B治疗方式类似模式A,倾向保守,除保证切缘阴性,可参照LVI情况行选择性淋巴结清扫;模式C形态学亚型包括弥漫性破坏、融合性生长、广泛线性破坏(>5 mm)、带状淋巴细胞浸润、实性生长及出现微乳头,参考FIGO分期行根治术及盆腔淋巴结清扫,治疗方案相对积极,需辅助放、化疗。其中区分模式A与C尤为重要(表2)。需要强调的是,Silva system仅仅针对普通型HPVA,不适用于NHPVA。

表2 Silva system浸润模式A与C的组织学鉴别
a开放腺体(不完整的腺体)描述腺体具有不连续轮廓,显示出向间质破裂开口,常伴疏松间质和(或)炎性细胞浸润;b小管模式指迷宫样连通的腺体
4 IECC分类的难点
4.1 浸润深度及测量与微小浸润性鳞状细胞癌不同,子宫颈MIA常呈多灶性,部分跳跃性生长,当浸润性成分与AIS混合时,测量肿瘤厚度而非肿瘤深度可能会使分期过高,导致过度治疗,这就要求临床、影像与病理医师从手术定位、标本取样、切缘标记、子宫颈标本的规范化取材、形态学评估到免疫组化标记以及分子检测各环节无缝接驳,密切合作,确保精准诊断。美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)推荐的Sedlis标准中危因素包括子宫颈深部间质受侵、伴LVI、原发肿瘤较大(≥2 cm),需补充放疗和(或)同步化疗[16]。准确测量浸润深度对FIGO分期至关重要,病理医师不应从肿瘤表面上皮到浸润最深点来测量肿瘤厚度,而是通过从相邻非浸润性腺上皮基膜到浸润最深点测量来确定肿瘤深度,并报告肿瘤占子宫颈全层的相对比例。有放疗专家推荐下列方案[17]:(1)如子宫颈间质浸润深度<3 mm,无其他需盆腔辅助放疗的特征,则仅行经阴道近距离放疗即可;(2)如侵及子宫颈深度>2/3,或侵犯子宫颈深度<1/3但伴LVI,则建议盆腔放疗;(3)如术中未对淋巴结进行评估,则子宫颈浸润深度>2 mm或>3 mm者大部分建议行盆腔放疗,尤其是高级别肿瘤。卡铂(或顺铂)、紫杉醇(或吉西他滨)和贝伐单抗(Bevacizumab)联合化疗是目前应用较多的方案,但不良反应也不容忽视。有学者尝试将帕姆单抗(Pembrolizumab)用于PD-L1阳性或MSI-H/dMMR复发转移子宫颈癌患者的二线治疗,表现有持久的抗肿瘤活性和可控的安全性[18]。
4.2 LVI的判定及意义LVI被认为是判断预后的独立指标,国际妇科肿瘤学家协会(Society of Gynecologic Oncologist, SGO)和NCCN均把缺乏LVI的早期子宫颈癌定义为IA1期,但FIGO未参考LVI及肿瘤的形态特征,仅凭深度进行分期[19-20]。即使是考虑保留生育功能的手术,NCCN要求对伴LVI的IA1期和任何IA2期或更高肿瘤分期患者进行子宫颈癌根治术+盆腔淋巴结清扫。Silva system与FIGO分期相结合,可能对患者更有益,避免过度治疗或治疗不足。值得注意的是,2018年FIGO联合临床、手术与病理医师重新修订的子宫颈癌分期[19]中,ⅠA期取消水平浸润≤7 mm的标准,ⅠA1期≤3 mm,而以前标准是<3 mm;ⅠB期>3 mm,但≤5 mm;ⅡA1<4 cm,ⅡA2≥4 cm;ⅢC期增加盆腔淋巴结和腹主动脉旁淋巴结的情况,盆腔淋巴结转移者为ⅢC1期,腹主动脉旁淋巴结归于ⅢC2期,均为新变化,但仍保留部分旧版内容,如ECA普通型仍为子宫颈管型(endocervical type)。妇科专家们或许并非对最新WHO女性生殖系统分类视而不见,而是缺乏与病理医师的有效沟通。LVI是术后补充治疗的1个中危因素,准确判定除形态外,需要脉管标志物如CD31、CD34、FⅧRAg、ERG及D2-40等协助。尽管LVI不改变FIGO分期,但会影响治疗决策,临床上ⅠA1出现LVI需按ⅠA2处理。腺癌与肿瘤直径>3 cm、LVI、子宫颈外1/3间质浸润共同构成综合治疗的“四因素模型”,存在上述任何两个因素,补充放疗均有益。
5 IECC分类与WHO女性生殖系统肿瘤分类的兼容性
尽管WHO(2014)女性生殖系统肿瘤分类删除了MIA,但仍在AIS及浸润性腺癌 (invasive adenocarcinoma, IAC)章节中提及。Silva system在两种分类中做了调停与重构,其浸润模式与AIS、MIA与IAC之间存在大致对应关系(表3)。模式A的肿瘤相当于AIS及非破坏性生长方式的ECA(推挤性生长或膨胀性浸润),仅保守治疗,避免一些不必要的淋巴结清扫及辅助治疗,锥形切除标本切缘阴性者,可不必行子宫全切。显微镜下,MIA的浸润性腺体超出子宫颈腺体所在正常位置或出现于厚壁血管周围,肿瘤细胞向外出芽形成子腺体,与AIS相比,腺体更密集,形状更不规则,成簇增生形成乳头、背靠背或实性结构,腺体形成不良,融合成筛状,丰富胞质,呈鳞状上皮样(squamoid appearance),有的核仁明显,其间质极少,促纤维增生,周围淋巴细胞浸润,癌性腺体中常混杂有正常腺体或AIS,部分病例可见LIV。MIA与IAC的鉴别关键在于量,即间质浸润超过1个低倍(4倍)视野或最大径≥5 mm。
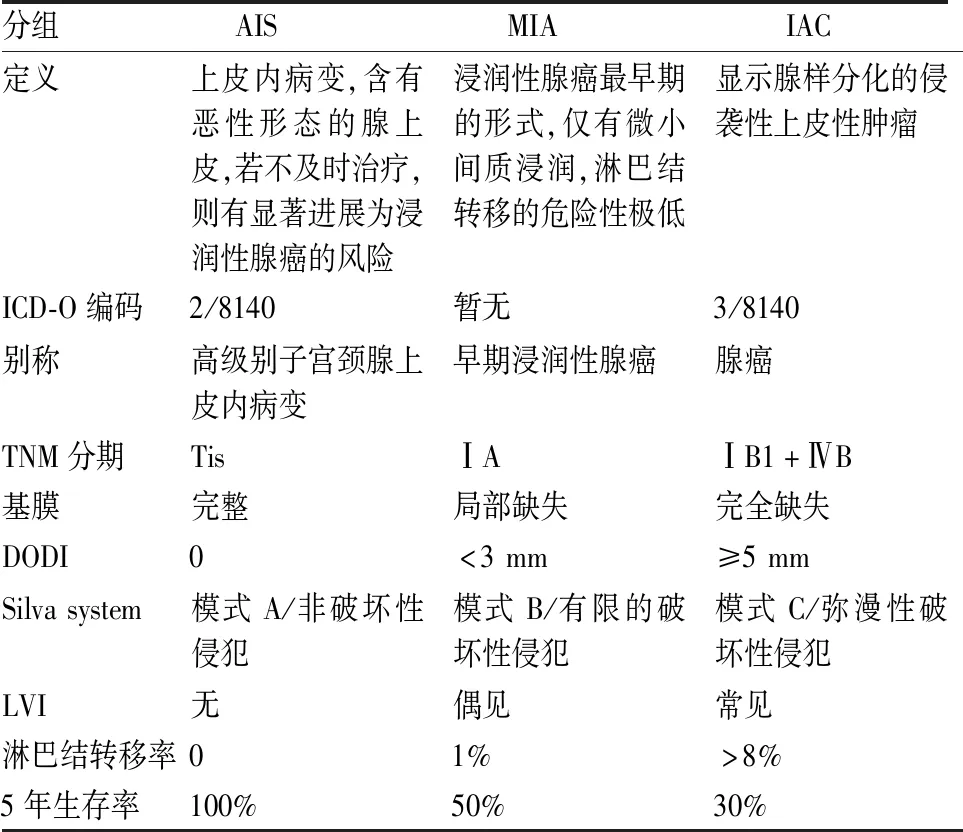
表3 AIS、MIA与IAC的鉴别
6 不同国际机构ECA相关内容的衔接
早期浸润性癌间质浸润是必备条件,FIGO要求深度<5 mm,由于存在许多“人工假象(artefact)”,删除了宽度<7 mm的内容,指出LVI不影响分期;而SGO深度仅为3 mm,对宽度未作具体规定,但必须未见LVI。MIA的最初形式是AIS腺体细胞向邻近部位出芽或呈不规则舌样,超出正常小叶,可见实性和(或)筛状结构伴间质促纤维反应及血管旁浸润。WHO(2014)女性生殖系统肿瘤分类不再将微小浸润癌列入是有原因的,除了子宫颈外形不规则、鳞柱交界区上皮形态多变、内部腺体结构复杂、锥切标本深浅难定且容易受挤压及烧灼、病变深度不易测量等客观因素外,相关临床科室长期忽略病理科的实际重要性,有的国际组织在制定标准时根本就未邀请病理医师参会,无相关病理专家的意见和建议,学科间缺乏真诚而有效的学术沟通与交流。WHO、FIGO、SGO、NCCN及国际抗癌协会(International Union Against Cance, UICC)等机构对某些观点缺乏整合或统一,意见存在较大分歧。当送检标本未能明确标记钟点方位或具体切缘内外,混装入标本袋中,让病理科医师进行分期的做法是极不科学的。形态学观察是协助临床分期最重要的途径,前提是需要按规范送检。只有在锥切及子宫颈全切标本才能做出微小浸润癌的诊断,应从缝线标注的12点位置起连续取材,每点至少1块,关注病变是否为多点,是否连续或跳跃,有无LVI。仔细检查有无阴道穹隆组织,如有则测量和记录其具体数据并报告子宫颈内外切缘有无累及。遇到具有融合性生长方式的微小浸润灶时,应连续切片,以期发现最大的浸润深度和范围。如果切缘阴性,尚需报告从浸润癌及这些切缘的距离。如果HSIL累及腺体,应从病变腺体的基膜开始测量,一般鳞状上皮内病变的锥切范围较低,形如金字塔,而AIS与可疑MIA的位置较高,类似埃菲尔铁塔状,其顶端角度仅为鳞状上皮内病变的一半。冷刀锥切或LEEP,应尽量整块切除,保证标本的完整性,锥切形状和深度需与病灶大小、形状和病变部位相适应,应设计成狭长锥形,延伸至子宫颈内口,避免遗漏子宫颈管病变。美国病理学家协会(College of American Pathologists, CAP)协议属于普遍推荐的大体取材规范,但最新研究[21]提倡子宫颈癌纵切,而子宫内膜癌横取,为了标本完整性,并不主张子宫颈与子宫体离断,所取组织块必须包括子宫颈全层、子宫颈管、阴道壁切缘。
7 存在的问题
好的分类应利于指导实践和准确推测预后,值得临床推广,目前WHO(2014)女性生殖系统肿瘤分类与IECC分类还缺乏让人信服的基因分型,相当一部分NHPVA腺癌能检测到HR-HPV的RNA,若被普遍接受,尚需时日。

