基于纳米脂质体的药物载体开发研究
王 婷
(上海泊燊医疗器械有限公司,上海201807)
纳米脂质体药物载体具有尺寸小, 生物相容性好, 毒副性小,选择性高,细胞亲和性强等特点,被广泛用于如蛋白质药物、抗肿瘤化疗、靶向治疗药物、抗病毒药物以及基因药物、疫苗等的体内传输[1]。 以脂质体为载体的各类纳米药物,药物靶向性、延长药效、降低药物毒性、提高疗效、改变给药途径等优点,从而受到科研者的广泛关注,在医药领域发挥了重要作用,拥有广阔的发展前景。
1 纳米药物载体优点分析
近年来,治疗药物与纳米技术交叉学科领域发展迅速,纳米药物传输系统的优势逐渐凸显。 其是通过以高分子纳米粒、纳米球、 纳米囊等载体与药物结合在一起制成药物, 其粒径在100~500nm 之间[1-3],将药物包封于微粒中,可调节释药的速度,增加生物膜的透过性,提高利用率,降低药物毒副作用,增加药物体内循环时间,减少药物用量。 相比传统的药物载体,纳米载体还可对其表面进行功能化修饰[2],从而提高其靶向性及特异性识别性[3],提高装载药物的稳定性,调节释放的速度能等。 纳米药物载体可以制成注射液进行静脉给药( 伊立替康、阿霉素、长春新碱、伊马替尼等纳米脂质体药物),或经胶囊后制成口服药进行口服给药( 如口服胰岛素)等多种给药途径。
2 脂质体系统
2.1 脂质体
脂质体是一种由仿细胞膜结构的磷脂双分子层自主装形成的中空球囊结构,其粒径尺寸可在20nm-2000nm 可调[1-2]。 构成脂质体的磷脂分子为细胞膜的主要成分,因此脂质体具有优异的生物相容性。 特殊的中空球囊结构能很好的起到保护被包封的药物活性,控制药物释放的作用,实现药物的缓释,对人体肠胃刺激性小,且脂质体的大小在纳米尺寸,这种小尺寸颗粒易于被细胞摄取, 能够被体内分解酶代谢降解, 有利于药物的吸收。 此外,脂质体作为药物载体能靶向传输药物,提高药物的治疗效果,降低毒副作用,被广泛的应用在抗癌纳米药物的开发中[4], 在癌症治疗中的优势日益凸显。 自Ryman 等科学家在1971年提出了将脂质体用于药物载体以来,这方面的研究成为热点,相关理论及技术也得到突破,多种纳米脂质体药物产品上市,或已进入临床阶段。
2.2 一般合成工艺
脂质体的粒径大小、 分布均匀、 包封率及稳定性是关键因素。不同的制备方法会对其粒径、结构等产生影响。通常脂质体的常用的合成方法有薄膜分离法、微射流法[5]、超声冷冻干燥法[6]等。 薄膜分散法又称Bangham 法,是将脂溶性药物[7-8]和脂类材料溶解于有机溶剂中,除去有机相后,形成薄膜,加入水相从而形成脂质体混悬液, 该方法为最早应用最广泛的方法。 微射流法是一种新兴的制备技术, 其将粗脂质体悬浮液经过动态高压微射流,通过多次液体的高速撞击、气蚀、高频剪切、高频振动、瞬间压降等综合作用, 得到粒度分布均匀的纳米脂质体其包封率也得到适当的提高。 超声冷冻干燥法是利用超声破坏悬浮颗粒,得到粒径较小的脂质体,在极低压力下除冰冻状态下的脂质体中的水分,将其分散到水性介质中,最终获得重建后的脂质体悬液。
3 药物载体开发实验
3.1 实验材料与仪器设备
3.1.1 实验材料
雷帕霉素( 阿拉丁试剂)、1,2- 二硬脂酰基-sn- 丙三基-3-磷酸胆碱( 阿拉丁试剂),胆固醇( 阿拉丁试剂),无水乙醇( 国药集团),去离子水( 北京索莱科技有限公司),甲醇( 国药集团)。
3.1.2 实验仪器
马尔文Zetasizer/Nano 纳米电位粒径分析仪( 英国马尔文仪器有限公司,ZCEC),冷冻离心机( Cence 仪器, H1850R),高效液相色谱仪( 美国沃特世仪器,Waters Breeze2),细胞粉碎机( 新芝生物,JY92-II N),透析袋( 美国MYM 生物技术公司,分子量30000)、超声清洗机( 深圳得康生物有限公司),恒温摇床( 无锡久平仪器,Cos-111B)。
3.2 纳米脂质体的制备
3.2.1 脂质体制备过程
将一定摩尔比的1,2- 二硬脂酰基-sn- 丙三基-3- 磷酸胆碱和胆固醇( 25 mg)称于1.5 ml 塑料离心管中,加入100μl 雷帕霉素乙醇溶液,溶解。将1ml 去离子水快速加入上述脂材和药物的溶液中,然后将该悬浮液置于细胞破碎机,功率为100W,超声20min,用离心机离心5min( 3000RPM),去除杂质,上清液转移至超滤离心管中,离心超滤30min( 4000r/min),最后将离心管中溶液转移至干净离心管中,即得到雷帕霉素纳米脂质体。
3.2.2 脂质体粒径及电位测试
对上述制备的脂质体采用马尔文Zetasizer/Nano 纳米电位粒径分析仪进行粒径和电位分析, 这两个测试均在室温下将脂质体溶液用去离子水稀释10 倍后进行测试。
3.2.3 包封药物浓度及包封率测定
对其包封的雷帕霉素采用HPLC 测定其药物浓度。 HPLC 采用的流动相为甲醇和水的混合物, 流速为0.75ml/min, 观察278nm 处 的 出 峰 位 置, 在PTFE ( 聚 四 氟 乙 烯) 膜 中 过 滤( 0.22μm)后进样,进样体积为100μl。通过超滤离心过程,除去未结合的药物后,脂质体中剩余的药物被认为是封装药物。 通过将脂质体溶解在流动相中并通过HPLC 方法对其进行分析来测量包封率( EE)。 封装效率通过以下公式[9-10]计算:

3.2.4 模拟环境中的药物释放[11]
将500μl 的雷帕霉素脂质体样品放入透析袋( 分子量:30,000) 中, 然后将其悬浮在装有250mL 去离子水的有盖烧杯中。 然后将烧杯放入温度控制( 37°C)的恒温水浴摇床中,摇动速率为每分钟50 次。 在不同的时间间隔, 从烧杯中取出2mL水,并通过HPLC 方法分析药物含量。在烧杯中重新加入2ml 去离子水以保持固定的体积。
4 结果分析
4.1 制备工艺参数的影响
在脂材摩尔比为7:3,总质量为25mg,不加药物,按照上述制备方法制备空白脂质体, 通过采用不同的超声功率和时间,考察超声参数对脂质体粒径的影响。 功超声功率为100w、50w、25w,超声时间为20min,15min,测试脂质体的粒径,其结果如下表1 所示。

表1 不同制备工艺参数下脂质体的粒径和粒径分布
通过对数据进行方差分析,p<0.05,各组数据有显著性差异,在工艺参数为功率100w,时间20min 下制备的脂质体粒径最小,因此在载药实验中采用此组参数进行载药研究。
4.2 纳米脂质体表征
选取1,2- 二硬脂酰基-sn- 丙三基-3- 磷酸胆碱和胆固醇的总量为25mg,其摩尔比分别为8:2,7:3, 6:4,超声参数为功率100W,时间20min,不添加药物,进行初步实验,按照上述方法准备空白脂质体,对不同脂材量进行比较。 实验中发现摩尔比为8:2 的脂材,有分层现象,脂质体不能成功制备,这意味着胆固醇的含量太低,不能稳定脂质体,因此可认为胆固醇含量对于脂质体的稳定性很重要。 因此,随后的实验是使用摩尔比为7:3 和6:4 的脂材进行实验。 投入药物含量分别为10 mg/ml, 5mg/ml, 2.5 mg/ml 雷帕霉素溶液,参数采用功率100w,时间20min。 具体配方见表2。 对制备出的脂质体进行粒径、电位及药物浓度的测试,见表3。

表2 不同脂质体配比及雷帕霉素药物浓度
表为磷酸胆碱和胆固醇脂材的摩尔比,雷帕霉素药物浓度单位为mg/ml。
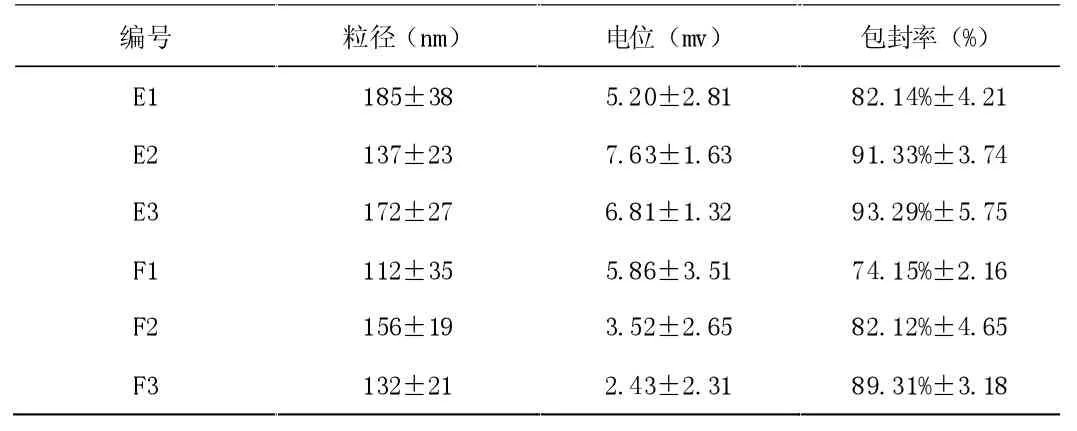
表3 雷帕霉素载药脂质体表征结果
从表3 看出,制备出的脂质体粒径均在200nm 以下,脂质体中雷帕霉素的包埋量随胆固醇和磷脂的摩尔比的变化略有不同, 数据表明胆固醇增加会减少脂溶性药物在脂质体中的包裹,这是因为胆固醇分子将其自身定位在脂质双层之间以赋予结构刚性和稳定性,且雷帕霉素为亲脂性药物[12],优先夹在双层中,因此随着胆固醇含量的增加,脂质体中的药物载量下降,脂材摩尔比为6:4 的包封率较7:3 的低。
4.3 模拟环境中的释放性能
通过模拟体外环境进行药物释放性能的研究, 如图1 所示结果可以看到其释放速度非常慢,24 小时后从各组配方中均释放出约7%的包埋药物, 表明雷帕霉素药物分子驻留在脂质体的双层中而不在脂质体的表面上。
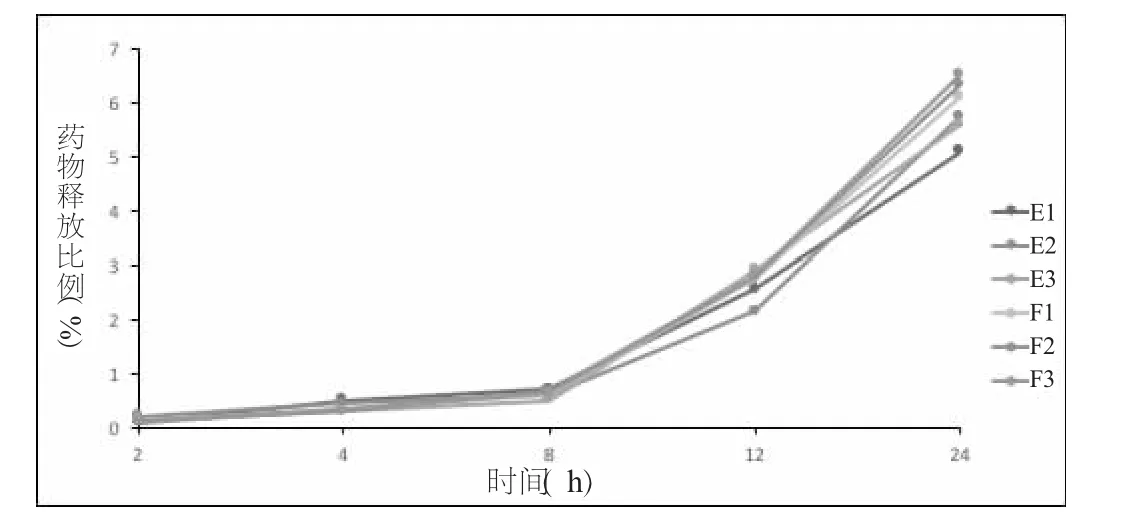
图1 随着时间变化的药物释放百分比
5 结论
本文采用一步超声法制备纳米脂质体, 此方法制备过程较传统制备方法更简单,得到的纳米脂质体粒径小,分布小,脂质体浓度高,载药量大,整个制备工艺都是在水溶液体系中进行,环境友好。 通过实验我们可以看到胆固醇对纳米脂质体的形成极其重要,工艺参数对粒径和粒径分布影响显著,不同的脂材比和药物浓度添加量可得到74%-93%范围不等的包封率,结果表明,在超声功率为100w,时间20min 下,脂材摩尔比为7:3,药物浓度为5%,制备出的纳米脂质体,包封率最高,粒径小,分布窄, 药物释放缓慢。 该方法下制备的纳米脂质体浓度高达25mg/ml,每1ml 脂质体溶液,含0.37-0.46mg 雷帕霉素,较其他传统的制备方法达到了较高的脂质体浓度以及药物含量。
——雷帕霉素

