H2O2诱导H9c2细胞凋亡中circNFIX表达及作用
崔向伦 蒋梅青 杨维维 刘格格 孙淑琦 徐文华

[摘要]目的 探討环状RNA NFIX(circNFIX)在H9c2细胞凋亡中的表达趋势和功能。方法 将H9c2细胞应用200 μmol/L的H2O2孵育0、1、3、6、12 h,应用荧光定量PCR方法检测H2O2诱导的H9c2细胞凋亡中circNFIX的表达趋势。将H9c2细胞分为空白对照组(未转染)、siRNA阴性对照组(转染siRNA阴性对照组)和siRNA组(转染siRNA),应用荧光定量PCR方法检测siRNA对circNFIX抑制效果。将H9c2细胞分为对照组(未转染)、H2O2组(应用200 μmol/L H2O2孵育12 h)、H2O2+NC组(先转染siRNA阴性对照,余处理同H2O2组)和H2O2+siRNA组(先转染siRNA,余处理同H2O2组),用TUNEL和Western blot方法检测敲低circNFIX对H9c2细胞凋亡的影响。结果 circNFIX表达趋势检测显示,随着H2O2孵育时间的延长,circNFIX的表达水平逐渐下降(F=23.677,P<0.01);转染siRNA可显著降低circNFIX的表达水平(F=424.70,t=24.44~25.97,P<0.01)。TUNEL和Western blot检测结果表明,转染siRNA使TUNEL阳性细胞率和Bax/Bcl-2表达水平显著降低(t=3.27~17.22,P<0.01)。结论 在H2O2诱导的H9c2细胞凋亡中circNFIX的表达水平减低,沉默circNFIX的表达抑制H9c2细胞凋亡。
[关键词] RNA,环状;过氧化氢;氧化性应激;细胞凋亡;心肌梗死
[中图分类号] R329.25 [文献标志码] A [文章编号] 2096-5532(2020)04-0389-05
doi:10.11712/jms.2096-5532.2020.56.091
[网络出版] http://kns.cnki.net/kcms/detail/37.1517.R.20200519.1427.001.html;2020-05-20 08:53
EXPRESSION AND ROLE OF circNFIX IN H2O2-INDUCED H9C2 CELL APOPTOSIS
CUI Xianglun, JIANG Meiqing, YANG Weiwei, LIU Gege, SUN Shuqi, XU Wenhua
(Department of Inspection, The Medical Faculty of Qingdao University, Qingdao 266071, China)
[ABSTRACT]Objective To investigate the expression tendency and role of circular RNA NFIX (circNFIX) in H9c2 cell
apoptosis.Methods H9c2 cells were incubated with 200 μmol/L H2O2 for 0, 1, 3, 6, or 12 h. Quantitative real-time PCR (qPCR) was used to determine the expression tendency of circNFIX in H2O2-induced H9c2 cell apoptosis. H9c2 cells were divided into blank control group (without transfection), siRNA negative control group (siRNA-transfected negative control group, NC group), and siRNA group (siRNA-transfected group). qPCR assay was used to determine the inhibitory effect of siRNA on circNFIX. The H9c2 cells were divided into control group (without transfection), H2O2 group (incubated with 200 μmol/L H2O2 for 12 h), H2O2+NC group (first transfected with NC, followed by the same treatment as the H2O2 group), and H2O2+siRNA group (first transfected with siRNA, followed by the same treatment as the H2O2 group). Terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling (TUNEL) and Western blot were used to determine the effect of circNFIX knockdown on H9c2 cell apoptosis. Results The testing results of circNFIX expression tendency suggested that the expression level of circNFIX was gradually down-regulated with increasing H2O2 incubation time (F=23.677,P<0.01); the expression level of circNFIX was significantly reduced after siRNA transfection (F=424.70,t=24.44-25.97,P<0.01). The results of TUNEL and Western blot indicated that siRNA transfection significantly reduced the proportion of TUNEL-positive cells and Bax/Bcl-2 levels (t=3.27-17.22,P<0.01).Conclusion In H2O2-induced H9c2 cell apoptosis, circNFIX expression is gradually down-regulated, and silencing circNFIX expression inhibits H9c2 cell apoptosis.
[KEY WORDS] RNA, circular; hydrogen peroxide; oxidative stress; apoptosis; myocardial infarction
心肌梗死是一种缺血性心脏病,在全球有较高的发病率和死亡率[1-2]。随着溶栓和经皮冠状动脉介入治疗的应用,心肌梗死病人的存活率显著提高。然而,再灌注过程中超氧化物过载和钙稳态失调使线粒体膜通透性转换孔开放,进而引起心肌细胞凋亡[3]。凋亡的心肌细胞将被成纤维细胞代替,进而导致左心室的收缩功能障碍,最终发展为心力衰竭[4]。因此,亟需研究和明确心肌细胞凋亡的分子
机制。环状RNA是一类闭合环状的分子,具有保守性好、稳定性高、组织特异性和疾病发展阶段特异性等特征[5]。环状RNA有多种生物学功能,参与神经系统疾病和肿瘤等疾病的发病过程[6-7]。最近研究结果显示,环状RNA在心血管疾病的发生发展中发挥至关重要的作用[8],而其在心肌细胞凋亡中的作用尚不明确。本研究探讨环状RNA NFIX(circNFIX)在H9c2细胞凋亡中的变化趋势和作用,为开发环状RNA相关的诊断标志物和治疗靶标提供实验依据。
1 材料和方法
1.1 细胞与试剂
大鼠心肌细胞H9c2购自中国科学院(上海)细胞库;DMEM高糖培养基购于美国GIBCO公司;胎牛血清购于上海吉泰依科赛生物科技有限公司;青霉素/链霉素混合液购于北京索莱宝科技有限公司;Trizol试剂、反转录试剂和SYBR green购于宝生物工程有限公司;Lipfectamine 3000购于赛默飞世尔科技公司;荧光定量PCR引物购于华大基因公司;siRNA和阴性对照(NC)购于上海吉玛制药技术有限公司;TUNEL细胞凋亡检测试剂盒购于上海翊圣生物科技有限公司;RIPA裂解液(高强度)、PAGE凝胶快速制备试剂盒(125 g/L)、Omni-ECL超灵敏化学发光检测试剂盒购于上海雅酶生物科技有限公司;Bax、Bcl-2抗体购于沈阳万类生物科技有限公司;GAPDH抗体、羊抗兔二抗和羊抗鼠二抗购于武汉爱博泰克生物科技有限公司。
1.2 实验方法
1.2.1 细胞培养 大鼠心肌细胞H9c2培养于含体积分数0.05 CO2、37 ℃湿润的细胞培养箱中,应用含有体积分数0.10胎牛血清和体积分数0.01青霉素/链霉素混合液的DMEM高糖培养基进行培养。培养基每48 h更换1次,取对数生长期的细胞进行实验。
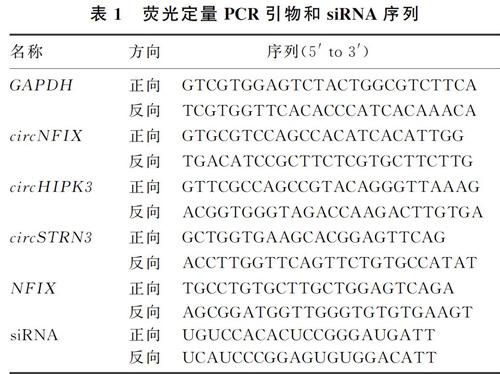
1.2.2 荧光定量PCR检测环状RNA和NFIX mRNA的表达 用Trizol法提取细胞总RNA,具体步骤参照Trizol试剂说明书。反转录按照反转录试剂说明书进行,反应条件为:37 ℃、15 min,85 ℃、5 s,4 ℃结束。荧光定量PCR的反应条件为:95 ℃预变性3 min,95 ℃变性5 s,60 ℃退火30 s,共40个循环。以GAPDH为内参,用2-△△CT法计算circNFIX的表达水平。每个样品设置3个复孔。引物序列见表1。1.2.3 候选环状RNA表达检测 选择对数生长期的H9c2细胞,分为对照组(无药物处理)、H2O2组(200 μmol/L H2O2孵育12 h)。收集细胞后,用1.2.2的方法检测候选环状RNA的表达水平。
1.2.4 circNFIX表达趋势检测 取对数生长期的H9c2细胞,分为0 h组(无药物处理)、1 h组(应用200 μmol/L H2O2孵育1 h)、3 h组(200 μmol/L H2O2孵育3 h)、6 h组(200 μmol/L H2O2孵育6 h)、12 h组(应用200 μmol/L H2O2孵育12 h)。各组处理相应时间后收集细胞,用1.2.2的方法检测circNFIX的表达水平。
1.2.5 siRNA转染效果检测 取对数生长期的H9c2细胞分为空白对照组(未转染)、siRNA阴性对照组(转染NC)、siRNA组(转染siRNA)。转染步骤按照Lipfectamine 3000说明书进行,转染24 h后收集各组细胞,用1.2.2的方法检测circNFIX和NFIX mRNA的表达水平。siRNA序列见表1。
NC组(先转染NC,其余处理同H2O2组)、H2O2+siRNA组(先转染siRNA,其余处理同H2O2组)。转染24 h后,除对照组外均加入H2O2(终浓度为200 μmol/L),继续培养12 h。按照TUNEL检测试剂盒说明书检测各组TUNEL阳性细胞率。
1.2.7 Western blot检测Bax和Bcl-2蛋白的表达
实验分组及处理方法与1.2.6相同,培养结束以后加入RIPA裂解液提取总蛋白。各组样品经SDS-PAGE蛋白质电泳后,将蛋白转移到硝酸纤维素膜上,然后用50 g/L脱脂奶粉室温封闭2 h。加入一抗(Bax,1∶500;Bcl-2,1∶500;GAPDH,1∶5 000)
4 ℃孵育过夜,然后加入二抗(羊抗鼠二抗1∶5 000;羊抗兔二抗1∶5 000)于室温孵育1 h,最后用ECL检测试剂盒显影。以GAPDH为内参,使用Image J软件分析条带的灰度值,结果以目的蛋白条带灰度值/GAPDH条带灰度值表示。
以上各指标检测均重复3次。
1.3 统计学分析
使用SPSS 21.0软件进行统计学分析,计量资料结果以[AKx-D]±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 环状RNA的筛选和circNFIX的表达趋势
应用荧光定量RCR检测H9c2细胞凋亡前后候选环状RNA的表达水平,结果显示,circNFIX在H9c2细胞凋亡前后变化最显著(t=17.535,P<0.01)。见表2。因此,选择circNFIX做进一步研究。对circNFIX表达趋势的检测显示,0、1、3、6、12 h组circNFIX相对表达量分别为1.00±0.01、0.92±0.06、0.84±0.04、0.79±0.05、0.62±0.02。随着H2O2处理时间的延长,circNFIX的表達量逐渐减少(F=23.677,P<0.01),其中12 h组较0 h组减少了48%(t=9.074,P<0.01)。表明在H2O2诱导的H9c2心肌细胞凋亡中circNFIX的表达水平明显下调。
2.2 沉默circNFIX表达对TUNEL阳性细胞率的影响
本文siRNA转染效果检测显示,空白对照组、siRNA阴性对照组、siRNA组circNFIX的表达量分别为1.00±0.03、0.96±0.02、0.34±0.03。与空白对照组和siRNA阴性对照组相比较,siRNA组中circNFIX的表达量下降了66%,差异有统计学意义(F=424.70,t=24.44~25.97,P<0.01);而siRNA阴性对照组与空白对照组间circNFIX表
达量差异无统计学意义(t=1.537,P>0.05)。此外,空白对照组(1.00±0.05)、siRNA阴性对照组(0.99±0.06)和siRNA组(0.93±0.05)间NFIX mRNA表达量比较差异无统计学意义(F=1.00,P>0.05)。结果表明,siRNA可以特异性地抑制circNFIX的表達。
TUNEL分析结果则表明,对照组、H2O2组、H2O2+NC组、H2O2+siRNA组TUNEL阳性细胞率分别为1.89±0.83、10.23±0.72、9.50±0.37、5.09±0.37。与对照组相比,H2O2组TUNEL阳性细胞率明显增高(t=13.68,P<0.01),说明H2O2使H9c2细胞的凋亡水平显著增高。H2O2+siRNA组的TUNEL阳性细胞率较H2O2+NC组减少了38%,差异有显著性(t=17.22,P<0.01);H2O2组与H2O2+NC组间的TUNEL阳性细胞率差异无统计学意义(P>0.05)。表明沉默circNFIX可使H2O2诱导的H9c2细胞凋亡减少。见图1。
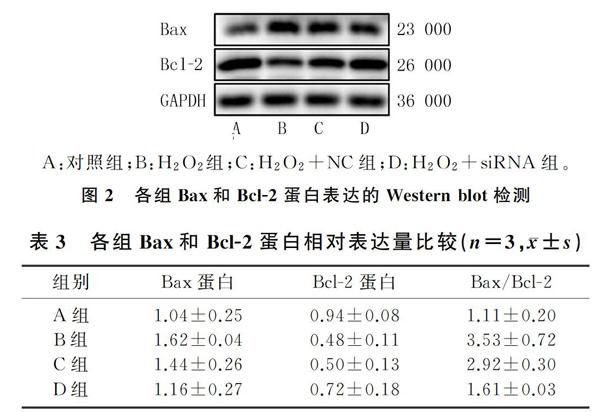
2.3 沉默circNFIX对Bax和Bcl-2蛋白表达影响
Western blot结果显示,与对照组(A组)比较,H2O2组(B组)Bax/Bcl-2明显增高,说明H2O2使H9c2细胞凋亡水平显著增加。H2O2+siRNA组(D组)的Bax/Bcl-2值与H2O2+NC组(C组)比较减少45%,差异有显著性(t=3.27,P<0.05);H2O2组与H2O2+NC组间Bax/Bcl-2值差异无统计学意义(P>0.05)。表明沉默circNFIX使H2O2诱导的H9c2细胞凋亡减少。见图2和表3。
3 讨 论
环状RNA分布广泛,调控机制多样,可在转录水平和转录后水平发挥重要作用[9]。环状RNA的调控机制主要有:①可作为miRNA海绵,进而抑制miRNA的功能并上调其靶蛋白的表达水平[10];②可与RNA结合蛋白(RBP)相互作用,进而改变蛋白的亚细胞定位或作为支架促进蛋白间的相互作用[11];③编码蛋白质,部分环状RNA具有开放阅读框(跨越剪接位点)和转录起始元件(核糖体插入位点或m6A修饰位点),可编码新型功能蛋白质[12]。凋亡又称程序性细胞死亡,是心肌梗死过程中心肌细胞死亡的主要形式之一[13]。氧气供应不足和氧化应激水平增加均会引起心肌细胞凋亡[3],减少其凋亡水平有助于保护病人心功能和改善预后。已有研究结果显示,环状RNA调控多种心血管疾病的发生发展[8],如自噬相关环状RNA ACR通过靶向Pink1介导的FAM65B磷酸化来抑制自噬和心肌梗死[14];敲低[STBX]circSlc8a1可缓解压力过载诱导心肌circAmotl1可结合PDK1和AKT,在多柔比星诱导的心肌病中起保护作用[16]。然而,环状RNA在心肌细胞凋亡中的调控作用仍不清楚。本研究旨在筛选心肌细胞凋亡相关的环状RNA并研究其作用,以进一步明确心肌细胞凋亡的分子机制。
环状RNA具有稳定的环形结构和较长的半衰期[5],可在血浆和唾液等体液中被检测到[17-18],并且在外泌体中表达丰富[19]。血浆中环状RNA的表达量与原位组织中表达有相同的趋势,而且具有疾病发展阶段特异性等特征[17]。因此,环状RNA有潜力成为疾病的诊断标志物。本研究按照以下标准筛选环状RNA:①在心脏中高表达;②在大鼠和人之间高度保守;③在心肌细胞凋亡前后表达水平发生明显变化。根据此标准可筛选出高保守性的、心肌细胞凋亡相关的环状RNA,并具有较好的临床转化潜质。检测血浆或外泌体中circNFIX的表达或可用于心肌梗死诊断和病情监测。
在疾病过程中升高的环状RNA可促进疾病的发生发展,而下调的环状RNA可以发挥抑制或者保护的效应。有研究结果显示,在结肠癌组织中上调的circPPP1R12A可促进结肠癌细胞的增殖、迁移和侵袭[20];在口腔鳞状细胞癌组织和细胞中下调的circRNA_0000140可抑制口腔鳞状细胞癌的生长和转移[21]。然而,部分环状RNA因发生应激性变化,其表达与功能呈负相关。研究显示,在缺血的心肌组织和低氧的心肌细胞中上调的circTtc发挥心脏保护作用[22]。本文研究结果显示,circNFIX在心肌细胞凋亡中有减少趋势,但其发挥促凋亡的作用,可能是受RBP、增强子等上游因子调控的结果。circNFIX的上游调控机制需要进一步研究。
miRNA海绵和结合RBP是环状RNA发挥作用的主要机制,探讨circNFIX下游的miRNA或RBP有助于明确其作用机制。而通过starBase数据库预测可能与circNFIX结合的miRNA,发现miR-204和miR-145与心肌细胞凋亡相关[23-25]。其中,miR-204在缺血再灌注的心肌组织中显著下降,可减少低氧/复氧诱导的H9c2细胞凋亡;而miR-145可抑制低氧或H2O2诱导的H9c2、HL-1和新生小鼠心肌细胞的凋亡[24-25]。另外还有研究结果显示,circNFIX可与凋亡相关的IDH2和hnRNPK结合[26]。在IDH2缺陷的小鼠中,超氧化物的产生和凋亡蛋白的表达增加,并伴随着线粒体功能障碍[27]。沉默IDH2可抑制H2O2诱导的H9c2细胞凋亡[28]。在膀胱癌中,hnRNPK可抑制细胞凋亡和促进细胞增殖[29]。circNFIX是否通过调控这些miRNA或RBP发挥作用有待进一步研究。
綜上所述,在H2O2诱导的H9c2细胞凋亡中circNFIX表达呈下降趋势,沉默circNFIX可以抑制H2O2诱导的H9c2细胞凋亡。circNFIX有潜力成为心肌梗死的诊断标志物和治疗靶点。
[参考文献]
[1]BENJAMIN E J, BLAHA M J, CHIUVE S E, et al. Heart disease and stroke statistics-2017 update a report from the American heart association[J]. Circulation, 2017,135(10): E146-E603.
[2]TOWNSEND N, WILSON L, BHATNAGAR P, et al. Car-diovascular disease in Europe: epidemiological update 2016[J].European Heart Journal, 2016,37(42):3232-3245.
[3]PEOPLES J N, SARAF A, GHAZAL N, et al. Mitochondrial dysfunction and oxidative stress in heart disease[J]. Experimental & Molecular Medicine, 2019,51(12):1-13.
[4]LI M Y, DING W, TARIQ M A, et al. A circular transcript of NCX1 gene mediates ischemic myocardial injury by targeting miR-133a-3p[J]. Theranostics, 2018,8(21):5855-5869.
[5]HAN Bing, CHAO Jie, YAO Honghong. Circular RNA and its mechanisms in disease: from the bench to the clinic[J]. Pharmacology & Therapeutics, 2018,187:31-44.
[6]SURESH L M, DEMPSEY R J, VEMUGANTI R. Role of circular RNAs in brain development and CNS diseases[J]. Progress in Neurobiology, 2020,186:101746.
[7]LIU Jianhong, LI Dongpei, LUO Hui, et al. Circular RNAs: the star molecules in cancer[J]. Molecular Aspects of Medicine, 2019,70:141-152.
[8]AUFIERO S, RECKMAN Y J, PINTO Y M, et al. Circular RNAs open a new chapter in cardiovascular biology[J]. Nature Reviews Cardiology, 2019,16(8):503-514.
[9]CUI Xianglun, WANG Jianxun, GUO Zongjun, et al. Emerging function and potential diagnostic value of circular RNAs in cancer[J]. Molecular Cancer, 2018,17(1):123.
[10]QIANG Su, LV Xiangwei. Revealing new landscape of cardiovascular disease through circular RNA-miRNA-mRNA axis[J]. Genomics, 2020,112(2):1680-1685.
[11]ZANG Jiankun, LU Dan, XU Anding. The interaction of circRNAs and RNA binding proteins: an important part of circRNA maintenance and function[J]. Journal of Neuroscience Research, 2020,98(1):87-97.
[12]PAN Wu, MO Yongzhen, MIAO Peng, et al. Emerging role of tumor-related functional peptides encoded by lncRNA and circRNA[J]. Molecular Cancer, 2020,19(1):22.
[13]BURGOS J I, MORELL M, MARIANGELO J E, et al. Hyperosmotic stress promotes endoplasmic reticulum stress-dependent apoptosis in adult rat cardiac myocytes[J]. Apopto-
sis: an International Journal on Programmed Cell Death, 2019,24(9/10):785-797.
[14]ZHOU Luyu, MEI Zhai, YAN Huang, et al. The circular RNA ACR attenuates myocardial ischemia/reperfusion injury by suppressing autophagy via modulation of the Pink1/ FAM65B pathway[J]. Cell Death and Differentiation, 2019,26(7):1299-1315.
[15]LIM T B, ALIWARGA E, LUU T D A, et al. Targeting the highly abundant circular RNA circSlc8a1 in cardiomyocytes attenuates pressure overload induced hypertrophy [J]. Cardiovascular Research, 2019,115(14):1998-2007.
[16]YAN Z, WILLIAM W D, WU Y Y, et al. A circular RNA binds to and activates AKT phosphorylation and nuclear localization reducing apoptosis and enhancing cardiac repair[J]. Theranostics, 2017,7(16):3842-3855.
[17]VEA A, LLORENTE-CORTES V, DE GONZALO-CALVO D. Circular RNAs in Blood[J]. Advances in Experimental Medicine and Biology, 2018,1087:119-130.
[18]GHODS F J. Circular RNA in saliva[J]. Advances in Experimental Medicine and Biology, 2018,1087:131-139.
[19]WANG Yangxia, LIU Jinbo, MA Junfen, et al. Exosomal circRNAs: biogenesis, effect and application in human diseases[J]. Molecular Cancer, 2019,18(1):116.
[20]XIAO Zheng, CHEN Lujun, YOU Zhou, et al. A novel protein encoded by a circular RNA circPPP1R12A promotes tumor pathogenesis and metastasis of colon cancer via Hippo-YAP signaling[J]. Molecular Cancer, 2019,18(1):47.
[21]PENG Qiushi, CHENG Yanan, ZHANG Wenbai, et al. circRNA-0000140 suppresses oral squamous cell carcinoma growth and metastasis by targeting miR-31 to inhibit hippo signaling pathway[J]. Cell Death & Disease, 2020,11(2):112.
[22]CAI Lidong, QI Baozhen, WU Xiaoyu, et al. Circular RNA Ttc3 regulates cardiac function after myocardial infarction by sponging miR-15b[J]. Journal of Molecular and Cellular Car-
diology, 2019,130:10-22.
[23]QIU Ruixia, LI Wen, LIU Yunhai. MicroRNA-204 protects H9C2 cells against hypoxia/reoxygenation-induced injury through regulating SIRT1-mediated autophagy[J]. Biomedicine & Pharmacotherapy, 2018,100:15-19.
[24]SUN Nianzi, MENG Fanyan, NING Xue, et al. Inducible miR-145 expression by HIF-1α protects cardiomyocytes against apoptosis via regulating SGK1 in simulated myocardial infarction hypoxic microenvironment[J]. Cardiology Journal, 2013,25(2):268-278.
[25]YUAN Ming, ZHANG Liwei, YOU Fei, et al. MiR-145-5p regulates hypoxia-induced inflammatory response and apoptosis in cardiomyocytes by targeting CD40[J]. Molecular and Cellular Biochemistry, 2017,431(1/2):123-131.
[26]HUANG Senlin, LI Xinzhong, ZHENG Hao, et al. Loss of super-enhancer-regulated circRNA Nfix induces cardiac rege-
neration after myocardial infarction in adult mice[J]. Circulation, 2019,139(25):2857-2876.
[27]KU H J, AHN Y, LEE J H, et al. IDH2 deficiency promotes mitochondrial dysfunction and cardiac hypertrophy in mice[J]. Free Radical Biology and Medicine, 2015,80:84-92.
[28]KU H J, PARK J W. Downregulation of IDH2 exacerbates H2O2-mediated cell death and hypertrophy[J]. Redox Report, 2017,22(1):35-41.
[29]CHEN Xu, GU Peng, XIE Ruihui, et al. Heterogeneous nuclear ribonucleoprotein K is associated with poor prognosis and regulates proliferation and apoptosis in bladder cancer[J]. Journal of Cellular and Molecular Medicine, 2017,21(7):1266-1279.
(本文編辑 黄建乡)
[收稿日期]2019-12-24; [修订日期]2020-03-31
[基金项目]国家自然科学基金项目(81770900),山东省科技发展基金项目(2014GHY115025)
[第一作者]崔向伦(1995-),男,硕士研究生。
[通信作者]徐文华(1971-),女,博士,教授,硕士生导师。E-mail:qd.wh@163.com。

